2.1: Teoría molecular cinética
- Page ID
- 75527
Objetivos de aprendizaje
- Comprender la significación de la teoría cinética molecular de los gases.
Las leyes que describen el comportamiento de los gases estaban bien establecidas mucho antes de que alguien hubiera desarrollado un modelo coherente de las propiedades de los gases. En esta sección, presentamos una teoría que describe por qué los gases se comportan de la manera en que lo hacen. La teoría que presentamos también puede ser utilizada para derivar leyes como la ley del gas ideal a partir de principios fundamentales y las propiedades de las partículas individuales.
Una descripción molecular
La teoría molecular cinética de los gases explica las leyes que describen el comportamiento de los gases. Desarrollada a mediados del siglo XIX por varios físicos, entre ellos el austriaco Ludwig Boltzmann (1844—1906), el alemán Rudolf Clausius (1822—1888), y el inglés James Clerk Maxwell (1831—1879), quien también es conocido por sus contribuciones a la electricidad y al magnetismo, esta teoría se basa en las propiedades de partículas individuales como se define para un gas ideal y los conceptos fundamentales de la física. Así, la teoría molecular cinética de los gases proporciona una explicación molecular para las observaciones que condujeron al desarrollo de la ley de gases ideales. La teoría molecular cinética de los gases se basa en los siguientes cuatro postulados:
cuatro postulados de la Teoría Molecular Cinética
- Un gas está compuesto por una gran cantidad de partículas llamadas moléculas (ya sean monatómicas o poliatómicas) que se mueven aleatoriamente en línea recta, movimiento continuo.
- Las moléculas de gas chocan entre sí y con las paredes del contenedor, pero estas colisiones son perfectamente elásticas; es decir, no cambian la energía cinética promedio de las moléculas.
- Debido a que la distancia entre las moléculas de gas es mucho mayor que el tamaño de las moléculas, el volumen de las moléculas es insignificante. Se consideran partículas “puntuales”.
- Las interacciones intermoleculares, ya sean repulsivas o atractivas, son tan débiles que también son insignificantes.
Si bien las moléculas de los gases reales tienen volúmenes distintos de cero y ejercen fuerzas atractivas y repulsivas unas sobre otras, por el momento nos centraremos en cómo la teoría molecular cinética de los gases se relaciona con las propiedades de los gases que hemos estado discutiendo. En los siguientes apartados, explicamos cómo se debe modificar esta teoría para dar cuenta del comportamiento de los gases reales.
Los postulados 1 y 2 establecen que las moléculas de gas están en constante movimiento y chocan frecuentemente con las paredes de sus contenedores. La colisión de moléculas con las paredes de sus contenedores resulta en una transferencia de impulso (impulso) de las moléculas a las paredes (Figura\(\PageIndex{2}\)).
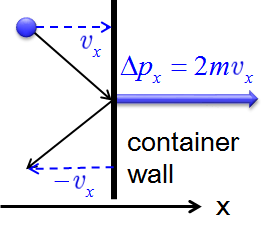
La transferencia de impulso a la pared perpendicular al\(x\) eje como una molécula con una velocidad inicial\(v_x\) en los impactos de\(x\) dirección se expresa como:
\[\Delta p_x=2mv_x \label{10.7.1}\]
La frecuencia de colisión, un número de colisiones de las moléculas a la pared por unidad de área y por segundo, aumenta con la velocidad molecular y el número de moléculas por unidad de volumen.
\[f\propto (v_x) \times \Big(\dfrac{N}{V}\Big) \label{10.7.2}\]
La presión que ejerce el gas sobre la pared se expresa como el producto del impulso y la frecuencia de colisión.
\[P\propto (2mv_x)\times(v_x)\times\Big(\dfrac{N}{V}\Big)\propto \Big(\dfrac{N}{V}\Big)mv_x^2 \label{10.7.3}\]
En cualquier instante, sin embargo, las moléculas en una muestra de gas están viajando a diferente velocidad. Por lo tanto, debemos sustituir\(v_x^2\) en la expresión anterior con el valor promedio de\(v_x^2\), que se denota por\(\left\langle v_x^{2}\right\rangle\). La barra superior designa el valor promedio sobre todas las moléculas.
La expresión exacta para la presión se da como:
\[P=\dfrac{N}{V}m\left\langle v_x^{2}\right\rangle\label{10.7.4}\]
Por último, debemos considerar que no hay nada de especial en\(x\) la dirección. Debemos esperar que
\[\left\langle v_x^{2}\right\rangle= \left\langle v_y^{2}\right\rangle=\left\langle v_z^{2}\right\rangle=\dfrac{1}{3}\left\langle v^{2}\right\rangle\]
Aquí la cantidad\(\left\langle v^{2}\right\rangle\) se llama la velocidad media cuadrada definida como el valor promedio de velocidad cuadrada (\(v^2\)) sobre todas las moléculas. Desde
\[v^2=v_x^2+v_y^2+v_z^2\]
para cada molécula, entonces
\[\left\langle v^{2}\right\rangle=\left\langle v_x^{2}\right\rangle+\left\langle v_y^{2}\right\rangle+\left\langle v_z^{2}\right\rangle\]
Al sustituir\(\left\langle v_x^{2}\right\rangle\) en\(\dfrac{1}{3}\left\langle v^{2}\right\rangle\) la expresión anterior, podemos obtener la expresión final de la presión:
\[P=\dfrac{1}{3}\dfrac{N}{V}m\left\langle v^{2}\right\rangle \label{10.7.5}\]
Debido a que los volúmenes y las interacciones intermoleculares son insignificantes, los postulados 3 y 4 establecen que todas las partículas gaseosas se comportan de manera idéntica, independientemente de la naturaleza química de sus moléculas componentes. Esta es la esencia de la ley de gas ideal, que trata a todos los gases como colecciones de partículas que son idénticas en todos los aspectos excepto en masa. El Postulado 3 también explica por qué es relativamente fácil comprimir un gas; simplemente se disminuye la distancia entre las moléculas de gas.
Adicionalmente, la energía cinética promedio de las moléculas de cualquier gas depende solo de la temperatura, y a una temperatura dada, todas las moléculas gaseosas tienen exactamente la misma energía cinética promedio. Esto a veces se considera Postulado 5 de Teoría Molecular Cinética. Este postulado proporciona una explicación molecular de la temperatura de un gas. Se refiere a la energía cinética traduccional promedio de las moléculas de un gas\(\left\langle {E_k}\right\rangle\), que se puede representar como y establece que a una temperatura Kelvin dada\((T)\), todos los gases tienen el mismo valor de
\[\left\langle {E_k}\right\rangle=\dfrac{1}{2}m\left\langle v^{2}\right\rangle=\dfrac{3}{2}\dfrac{R}{N_A}T \label{10.7.6}\]
donde\(N_A\) está la constante de Avogadro. La energía cinética traduccional total de 1 mol de moléculas se puede obtener multiplicando la ecuación por\(N_A\):
\[N_A\left\langle {E_k}\right\rangle=\dfrac{1}{2}M\left\langle v^{2}\right\rangle=\dfrac{3}{2}RT \label{10.7.7}\]
donde\(M\) es la masa molar de las moléculas de gas y se relaciona con la masa molecular por\(M=N_Am\). Al reorganizar la ecuación, podemos obtener la relación entre la velocidad cuadrática-raíz (\(v_{\rm rms}\)) y la temperatura. La velocidad rms (\(v_{\rm rms}\)) es la raíz cuadrada de la suma de las velocidades cuadradas dividida por el número de partículas:
\[v_{\rm rms}=\sqrt{ \left\langle v^{2}\right\rangle }=\sqrt{\dfrac{v_1^2+v_2^2+\cdots v_N^2}{N}} \label{10.7.8}\]
donde\(N\) es el número de partículas y\(v_i\) es la velocidad de la partícula\(i\).
La relación entre\(v_{\rm rms}\) y la temperatura viene dada por:
\[v_{\rm rms}=\sqrt{\dfrac{3RT}{M}} \label{10.7.9}\]
En Ecuación\(\ref{10.7.9}\),\(v_{\rm rms}\) tiene unidades de metros por segundo; en consecuencia, las unidades de masa molar\(M\) son kilogramos por mol, la temperatura\(T\) se expresa en kelvin, y la constante de gas ideal\(R\) tiene el valor 8.3145 J/ (K•mol). \(\ref{10.7.9}\)La ecuación muestra que\(v_{\rm rms}\) de un gas es proporcional a la raíz cuadrada de su temperatura Kelvin e inversamente proporcional a la raíz cuadrada de su masa molar. La velocidad media cuadrática de la raíz de un gas aumenta con el aumento de la temperatura. A una temperatura dada, las moléculas de gas más pesadas tienen velocidades más lentas que las más ligeras.
La velocidad rms y la velocidad promedio no difieren mucho (típicamente en menos del 10%). La distinción es importante, sin embargo, porque la velocidad rms es la velocidad de una partícula de gas que tiene energía cinética promedio. Las partículas de diferentes gases a la misma temperatura tienen la misma energía cinética promedio, no la misma velocidad promedio. En contraste, la velocidad más probable (vp) es la velocidad a la que se mueve el mayor número de partículas. Si la energía cinética promedio de las partículas de un gas aumenta linealmente al aumentar la temperatura, entonces Ecuación nos\(\ref{10.7.8}\) dice que la velocidad rms también debe aumentar con la temperatura porque la masa de las partículas es constante. A temperaturas más altas, por lo tanto, las moléculas de un gas se mueven más rápidamente que a temperaturas más bajas, y vp aumenta.
A una temperatura dada, todas las partículas gaseosas tienen la misma energía cinética promedio pero no la misma velocidad promedio.
Ejemplo\(\PageIndex{1}\)
Las velocidades de ocho partículas fueron 1.0, 4.0, 4.0, 6.0, 6.0, 6.0, 6.0, 8.0 y 10.0 m/s, calculando su velocidad promedio (\(v_{\rm av}\)) velocidad media cuadrática (\(v_{\rm rms}\)) y velocidad más probable (\(v_{\rm m}\)).
Dado: velocidades de partículas
Preguntado por: velocidad promedio (\(v_{\rm av}\)), velocidad cuadrática media (\(v_{\rm rms}\)) y velocidad más probable (\(v_{\rm m}\))
Estrategia:
Use Ecuación\(\ref{10.7.6}\) para calcular la velocidad promedio y Ecuación\(\ref{10.7.8}\) para calcular la velocidad rms. Encuentra la velocidad más probable determinando la velocidad a la que se mueve el mayor número de partículas.
Solución:
La velocidad promedio es la suma de las velocidades divididas por el número de partículas:
\[v_{\rm av}=\rm\dfrac{(1.0+4.0+4.0+6.0+6.0+6.0+8.0+10.0)\;m/s}{8}=5.6\;m/s \nonumber\]
La velocidad rms es la raíz cuadrada de la suma de las velocidades cuadradas dividida por el número de partículas:
\[v_{\rm rms}=\rm\sqrt{\dfrac{(1.0^2+4.0^2+4.0^2+6.0^2+6.0^2+6.0^2+8.0^2+10.0^2)\;m^2/s^2}{8}}=6.2\;m/s oumber\]
La velocidad más probable es la velocidad a la que se mueve el mayor número de partículas. De las ocho partículas, tres tienen velocidades de 6.0 m/s, dos tienen velocidades de 4.0 m/s, y las otras tres partículas tienen velocidades diferentes. De ahí\(v_{\rm m}=6.0\) m/s La\(v_{\rm rms}\) de las partículas, que está relacionada con la energía cinética promedio, es mayor que su velocidad promedio.
Distribuciones de Velocidades Moleculares
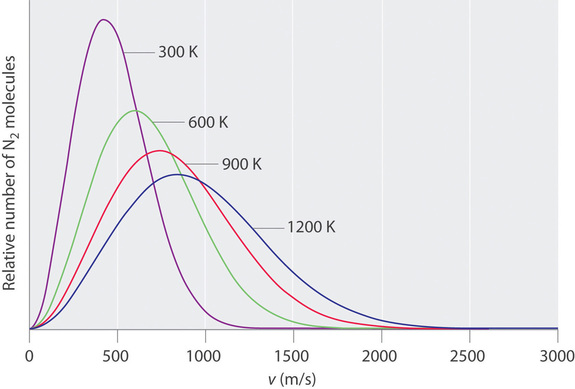
En un momento dado, ¿qué fracción de las moléculas de una muestra en particular tiene una velocidad dada? Algunas de las moléculas se moverán más lentamente que la media, y algunas se moverán más rápido que la media, pero ¿cuántas en cada situación? Las respuestas a preguntas como estas pueden tener un efecto sustancial en la cantidad de producto que se forma durante una reacción química. Este problema fue resuelto matemáticamente por Maxwell en 1866; utilizó el análisis estadístico para obtener una ecuación que describe la distribución de velocidades moleculares a una temperatura dada. En la Figura se muestran curvas típicas que muestran las distribuciones de velocidades de moléculas a varias temperaturas\(\PageIndex{3}\). El aumento de la temperatura tiene dos efectos. Primero, el pico de la curva se mueve hacia la derecha porque la velocidad más probable aumenta. En segundo lugar, la curva se hace más amplia debido a la mayor dispersión de las velocidades. Así, el aumento de la temperatura aumenta el valor de la velocidad más probable pero disminuye el número relativo de moléculas que tienen esa velocidad. Si bien las matemáticas detrás de curvas como las de Figura\(\PageIndex{3}\) fueron elaboradas por primera vez por Maxwell, las curvas son referidas casi universalmente como distribuciones de Boltzmann, después de una de las otras figuras principales responsables de la teoría molecular cinética de los gases.
Las relaciones entre presión, volumen y temperatura
Ahora describimos cómo la teoría molecular cinética de los gases explica algunas de las relaciones importantes que hemos discutido anteriormente.
- Presión versus Volumen: A temperatura constante, la energía cinética de las moléculas de un gas y por lo tanto la velocidad rms permanecen sin cambios. Si se permite que una muestra de gas dada ocupe un volumen mayor, entonces la velocidad de las moléculas no cambia, pero la densidad del gas (número de partículas por unidad de volumen) disminuye, y la distancia promedio entre las moléculas aumenta. De ahí que las moléculas deben, en promedio, viajar más lejos entre colisiones. Por lo tanto, chocan entre sí y con las paredes de sus contenedores con menos frecuencia, lo que lleva a una disminución de la presión. Por el contrario, el aumento de la presión obliga a las moléculas a acercarse entre sí y aumenta la densidad, hasta que el impacto colectivo de las colisiones de las moléculas con las paredes del contenedor apenas equilibra la presión aplicada.
- Volumen versus temperatura: Al elevar la temperatura de un gas, se aumenta la energía cinética promedio y, por lo tanto, la velocidad rms (y la velocidad promedio) de las moléculas de gas. De ahí que a medida que aumenta la temperatura, las moléculas chocan con las paredes de sus contenedores con mayor frecuencia y con mayor fuerza. Esto aumenta la presión, a menos que el volumen aumente para reducir la presión, como acabamos de ver. Por lo tanto, un aumento en la temperatura debe ser compensado por un aumento en el volumen para que el impacto neto (presión) de las moléculas de gas en las paredes del recipiente permanezca sin cambios.
- Presión de las Mezclas de Gases: El postulado 4 de la teoría molecular cinética de los gases establece que las moléculas de gas no ejercen fuerzas atractivas o repulsivas entre sí. Si las moléculas gaseosas no interactúan, entonces la presencia de un gas en una mezcla de gases no tendrá ningún efecto sobre la presión ejercida por otro, y la ley de Dalton de presiones parciales se mantiene.
Ejemplo\(\PageIndex{2}\)
La temperatura de un contenedor de 4.75 L de gas N 2 se incrementa de 0°C a 117°C. ¿Cuál es el efecto cualitativo de este cambio en el
- energía cinética promedio de las moléculas N 2?
- rms velocidad de las moléculas N 2?
- velocidad promedio de las moléculas N 2?
- impacto de cada molécula N 2 en la pared del contenedor durante una colisión con la pared?
- número total de colisiones por segundo de N 2 moléculas con las paredes de todo el contenedor?
- número de colisiones por segundo de N 2 moléculas con cada centímetro cuadrado de la pared del contenedor?
- presión del gas N 2?
Dado: temperaturas y volumen
Preguntado por: efecto de aumento de temperatura
Estrategia:
Utilizar las relaciones entre presión, volumen y temperatura para predecir el efecto cualitativo de un aumento en la temperatura del gas.
Solución:
- Al aumentar la temperatura, se incrementa la energía cinética promedio de las moléculas de N 2.
- Un aumento en la energía cinética promedio puede deberse solo a un aumento en la velocidad rms de las partículas de gas.
- Si la velocidad rms de las moléculas N 2 aumenta, la velocidad promedio también aumenta.
- Si, en promedio, las partículas se mueven más rápido, entonces golpean las paredes del contenedor con más energía.
- Debido a que las partículas se mueven más rápido, chocan con las paredes del contenedor más a menudo por unidad de tiempo.
- El número de colisiones por segundo de N 2 moléculas con cada centímetro cuadrado de pared del contenedor aumenta debido a que el número total de colisiones ha aumentado, pero el volumen ocupado por el gas y por lo tanto el área total de las paredes no cambian.
- La presión ejercida por el gas N 2 aumenta cuando la temperatura se incrementa a volumen constante, como predice la ley de gas ideal.
Ejercicio\(\PageIndex{2}\)
Una muestra de gas helio es confinada en un cilindro con un pistón deslizante hermético al gas. El volumen inicial es de 1.34 L y la temperatura es de 22°C, el pistón se mueve para permitir que el gas se expanda a 2.12 L a temperatura constante. ¿Cuál es el efecto cualitativo de este cambio en la
- energía cinética promedio de los átomos de He?
- rms velocidad de los átomos He?
- velocidad media de los átomos de He?
- impacto de cada átomo de He en la pared del contenedor durante una colisión con la pared?
- número total de colisiones por segundo de átomos He con las paredes de todo el contenedor?
- número de colisiones por segundo de átomos He con cada centímetro cuadrado de la pared del contenedor?
- presión del gas He?
- Contestar a
-
sin cambios
- Respuesta b
-
sin cambios
- Respuesta c
-
sin cambios
- Respuesta d
-
sin cambios
- Respuesta e
-
disminuye
- Respuesta f
-
disminuye
- Respuesta g
-
disminuye
Resumen
- La teoría molecular cinética de los gases proporciona una explicación molecular para las observaciones que condujeron al desarrollo de la ley de gases ideales.
- Energía cinética promedio:\[ \left\langle {E_k}\right\rangle =\dfrac{1}{2}m{v_{\rm rms}}^2=\dfrac{3}{2}\dfrac{R}{N_A}T n\nonumber\]
- Velocidad media cuadrática de la raíz:\[v_{\rm rms}=\sqrt{\dfrac{v_1^2+v_2^2+\cdots v_N^2}{N}} \nonumber\]
- Teoría molecular cinética de los gases:\[v_{\rm rms}=\sqrt{\dfrac{3RT}{M}} \nonumber\]
El comportamiento de los gases ideales se explica por la teoría molecular cinética de los gases. El movimiento molecular, que conduce a colisiones entre las moléculas y las paredes de los contenedores, explica la presión, y las grandes distancias intermoleculares en los gases explican su alta compresibilidad. Aunque todos los gases tienen la misma energía cinética promedio a una temperatura dada, no todos poseen la misma velocidad cuadrática media (rms) (v rms). Los valores reales de velocidad y energía cinética no son los mismos para todas las partículas de un gas sino que están dados por una distribución de Boltzmann, en la que algunas moléculas tienen velocidades (y energías cinéticas) mayores o menores que la media.

