25.2: Diagramas de fases para mezclas binarias
- Page ID
- 75249
Como sugiere la Regla de Fase Gibbs, las variables más importantes que describen una mezcla son la presión, la temperatura y la composición. En el caso de sistemas de un solo componente, la composición no es importante por lo que solo la presión y la temperatura se representan típicamente en un diagrama de fases. Sin embargo, para mezclas con dos componentes, la composición es de vital importancia, por lo que generalmente hay una elección que debe hacerse en cuanto a si la otra variable a representar es la temperatura o la presión.
Los diagramas de temperatura-composición son muy útiles en la descripción de sistemas binarios, muchos de los cuales serán para composiciones bifásicas a una variedad de temperaturas y composiciones. En esta sección, consideraremos varios tipos de casos en los que la composición de mezclas binarias se representan convenientemente utilizando este tipo de diagramas de fases.
Líquido parcialmente miscible
Un par de líquidos se considera parcialmente miscible si existe un conjunto de composiciones sobre las cuales los líquidos formarán un sistema líquido bifásico. Esta es una situación común y es el caso general de un par de líquidos donde uno es polar y el otro no polar (como el agua y el aceite vegetal). Otro caso que se usa comúnmente en el laboratorio de química orgánica es la combinación de éter dietílico y agua. En este caso, la solubilidad diferencial en los disolventes inmiscibles permite que el sistema líquido de dos fases se utilice para separar solutos mediante un método de embudo de separación.
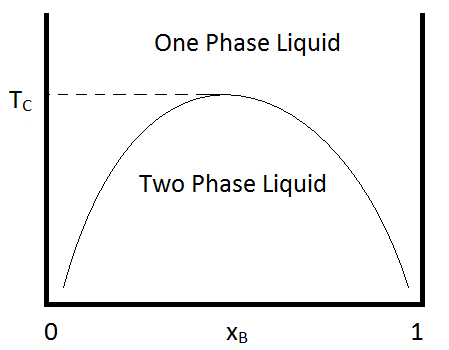
Como es el caso de la mayoría de los solutos, su solubilidad depende de la temperatura. Para muchas mezclas binarias de líquidos inmiscibles, la miscibilidad aumenta con el aumento de la temperatura. Y luego a alguna temperatura (conocida como la temperatura crítica superior), los líquidos se vuelven miscibles en todas las composiciones. Un ejemplo de un diagrama de fases que demuestra este comportamiento se muestra en la Figura\(\PageIndex{1}\). Un ejemplo de una combinación binaria que muestra este tipo de comportamiento es el del acetato de metilo y el disufuro de carbono, para lo cual la temperatura crítica es de aproximadamente 230 K a una atmósfera (Ferrini & Spinolo, 1974). Se observa un comportamiento similar para mezclas de hexano/nitrobenceno, para las cuales la temperatura crítica es de 293 K.
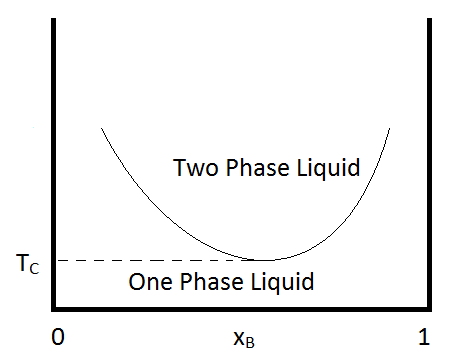
Otra condición que puede ocurrir es que los dos líquidos inmiscibles se vuelvan completamente miscibles por debajo de cierta temperatura, o que tengan una temperatura crítica más baja. Un ejemplo de un par de compuestos que muestran este comportamiento es el agua y la trimetilamina. Un diagrama de fases típico para tal mezcla se muestra en la Figura\(\PageIndex{2}\). Algunas combinaciones de sustancias muestran una temperatura crítica superior e inferior, formando sistemas líquidos bifásicos a temperaturas entre estas dos temperaturas. Un ejemplo de una combinación de sustancias que demuestran el comportamiento es la nicotina y el agua.
La regla de la palanca
La composición y cantidad de material en cada fase de un líquido bifásico se puede determinar usando la regla de palanca. Esta regla se puede explicar usando el siguiente diagrama.
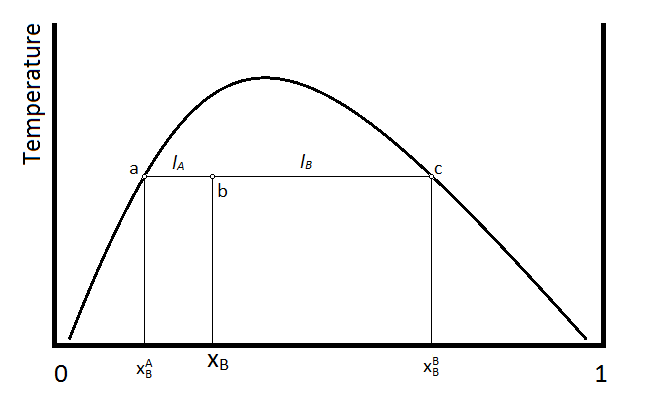
Supongamos que la temperatura y composición de la mezcla viene dada por el punto b en el diagrama anterior. El segmento lineal horizontal que pasa por el punto b, termina en los puntos a y c, los cuales indican las composiciones de las dos fases líquidas. El punto a indica la fracción molar del compuesto B (\(X_B^A\)) en la capa que es predominantemente A, mientras que el punto c indica la composición (\(X_B^B\) ) de la capa que es predominantemente compuesto B. Las cantidades relativas de material en las dos capas es entonces inversamente proporcional a la longitud de las líneas de unión a-b y b-c, que están dadas por\(l_A\) y\(l_B\) respectivamente. En términos de fracciones molares,
\[ l_A = X_B - X_B^A\]
y
\[ l_B = X_B^B - X_B \]
El número de moles de material en la capa A (\(n_A\)) y el número de moles en la capa B (\(n_B\)) son inversamente proporcionales a las longitudes de las dos líneas\(l_A\) y\(l_B\).
\[ n_A l_A = n_B l_B\]
O bien, sustituyendo las definiciones anteriores de las longitudes\(l_A\) y\(l_B\), la relación de estas dos longitudes da la relación de moles en las dos fases.
\[ \dfrac{n_A}{n_B} = \dfrac{l_B}{l_A} = \dfrac{ X_B^B - X_B}{X_B - X_B^A}\]
Colaboradores
Patrick E. Fleming (Department of Chemistry and Biochemistry; California State University, East Bay)


