25.1: Ley de Raoult y Mezclas Ideales de Líquidos
- Page ID
- 75234
Esta página trata sobre la Ley de Raoult y cómo se aplica a mezclas de dos líquidos volátiles. Abarca casos en los que los dos líquidos son completamente miscibles en todas las proporciones para dar un solo líquido, NO aquellos en los que un líquido flota sobre el otro (líquidos inmiscibles). La página explica lo que se entiende por una mezcla ideal y analiza cómo se construye y usa el diagrama de fases para tal mezcla.
Mezclas Ideales
Una mezcla ideal es aquella que obedece a la Ley de Raoult, pero quiero ver las características de una mezcla ideal antes de afirmar realmente la Ley de Raoult. La página fluirá mejor si lo hago de esta manera. ¡En realidad no existe tal cosa como una mezcla ideal! No obstante, algunas mezclas líquidas se acercan bastante a ser ideales. Se trata de mezclas de dos sustancias muy parecidas. Los ejemplos comúnmente citados incluyen:
- hexano y heptano
- benceno y metilbenceno
- propan-1-ol y propan-2-ol
En un líquido puro, algunas de las moléculas más energéticas tienen suficiente energía para superar las atracciones intermoleculares y escapar de la superficie para formar un vapor. Cuanto menores sean las fuerzas intermoleculares, más moléculas podrán escapar a cualquier temperatura en particular.

Si tienes un segundo líquido, lo mismo es cierto. A cualquier temperatura en particular una cierta proporción de las moléculas tendrá suficiente energía para salir de la superficie.
En una mezcla ideal de estos dos líquidos, la tendencia de los dos tipos diferentes de moléculas a escapar no cambia.
Se podría pensar que el diagrama muestra solo la mitad de cada molécula escapando, pero la proporción de cada escape sigue siendo la misma. El diagrama es para una mezcla 50/50 de los dos líquidos. Eso significa que solo hay la mitad de cada tipo de molécula en la superficie que en los líquidos puros. Si la proporción de cada escape se mantiene igual, obviamente solo la mitad de ellos escaparán en un momento dado. Si las moléculas rojas siguen teniendo la misma tendencia a escapar que antes, eso debe significar que las fuerzas intermoleculares entre dos moléculas rojas deben ser exactamente las mismas que las fuerzas intermoleculares entre una molécula roja y una azul.
Si las fuerzas fueran distintas, la tendencia a escapar cambiaría. Exactamente lo mismo ocurre con las fuerzas entre dos moléculas azules y las fuerzas entre una azul y una roja. También deben ser los mismos de lo contrario los azules tendrían una tendencia diferente a escapar que antes. Si sigues la lógica de esto a través, las atracciones intermoleculares entre dos moléculas rojas, dos moléculas azules o una molécula roja y una azul deben ser todas exactamente iguales para que la mezcla sea ideal.
Es por ello que mezclas como hexano y heptano se acercan al comportamiento ideal. Son moléculas de tamaño similar y, por lo tanto, tienen atracciones de van der Waals de tamaño similar entre ellas. No obstante, obviamente no son idénticos -y así aunque se acercan a ser ideales, en realidad no son ideales. Para los efectos de este tema, ¡acercarse al ideal es bastante bueno!
Mezclas ideales y la entalpía de la mezcla
Cuando haces cualquier mezcla de líquidos, tienes que romper las atracciones intermoleculares existentes (que necesita energía), y luego rehacer otras nuevas (que liberan energía). Si todas estas atracciones son iguales, no habrá ningún calor ni evolucionado ni absorbido. Eso significa que una mezcla ideal de dos líquidos tendrá cero cambio de entalpía de mezcla. Si la temperatura sube o baja cuando mezclas los dos líquidos, entonces la mezcla no es la ideal. Es posible que hayas cruzado una versión ligeramente simplificada de la Ley de Raoult si has estudiado el efecto de un soluto no volátil como la sal sobre la presión de vapor de disolventes como el agua. La siguiente definición es la que debes usar si estás hablando de mezclas de dos líquidos volátiles.
Definición: Ley de Raoult
La presión parcial de vapor de un componente en una mezcla es igual a la presión de vapor del componente puro a esa temperatura multiplicada por su fracción molar en la mezcla.
La Ley de Raoult solo funciona para mezclas ideales. En forma de ecuación, para una mezcla de líquidos\(A\) y\(B\), esto dice:
\[ P_A = X_A P^*_A \label{1}\]
\[ P_B = X_B P^*_B \label{2}\]
En esta ecuación,\(P_A\) y\(P_B\) están las presiones de vapor parciales de los componentes\(A\) y\(B\). En cualquier mezcla de gases, cada gas ejerce su propia presión. Esto se llama su presión parcial y es independiente de los demás gases presentes. Aunque te llevaras todos los demás gases, el gas restante seguiría ejerciendo su propia presión parcial. La presión de vapor total de la mezcla es igual a la suma de las presiones parciales individuales:
\[ P_{\text{total}} = P_A + P_B \label{3}\]
Los\(P^*\) valores son las presiones de vapor de\(A\) y\(B\) si fueran por su cuenta como líquidos puros. \(X_A\)y\(X_B\) son las fracciones molares de\(A\) y\(B\). Eso es exactamente lo que dice que es -la fracción del número total de moles presentes que es\(A\) o\(B\). Calcula la fracción molar usando, por ejemplo:
\[ X_A = \dfrac{\text{moles of A}}{\text{total number of moles}} \label{4}\]
Ejemplo\(\PageIndex{1}\)
Supongamos que tenía una mezcla de 2 moles de metanol y 1 mol de etanol a una temperatura particular. La presión de vapor del metanol puro a esta temperatura es de 81 kPa, y la presión de vapor del etanol puro es de 45 kPa. ¿Cuál es la presión de vapor total de esta solución?
Solución
Hay 3 moles en la mezcla en total.
- 2 de estos son metanol. La fracción molar de metanol es 2/3.
- De igual manera, la fracción molar de etanol es 1/3.
Puedes encontrar fácilmente las presiones de vapor parciales usando la Ley de Raoult, asumiendo que una mezcla de metanol y etanol es ideal.
Primero para metanol:
\[ P_{methanol} = \dfrac{2}{3} \times 81\; kPa\]
\[ = 54\; kPa\]
Luego para el etanol:
\[ P_{ethanol} = \dfrac{1}{3} \times 45\; kPa\]
\[ = 15\; kPa\]
Obtienes la presión de vapor total de la mezcla líquida al sumarlas juntas.
\[ P_{total} = 54\; kPa + 15 \; kPa = 69 kPa\]
En la práctica, ¡todo esto es mucho más fácil de lo que parece cuando conoces por primera vez la definición de la Ley de Raoult y las ecuaciones!
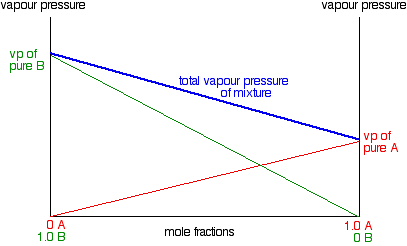
Diagramas de presión de vapor y composición
Supongamos que tiene una mezcla ideal de dos líquidos A y B. Cada uno de A y B está haciendo su propia contribución a la presión de vapor general de la mezcla, como hemos visto anteriormente. Centrémonos en uno de estos líquidos - A, por ejemplo. Supongamos que duplica la fracción molar de A en la mezcla (manteniendo la temperatura constante). De acuerdo con la Ley de Raoult, duplicarás su presión parcial de vapor. Si triples la fracción molar, su presión parcial de vapor se triplicará, y así sucesivamente. En otras palabras, la presión parcial de vapor de A a una temperatura particular es proporcional a su fracción molar. Si traza una gráfica de la presión parcial de vapor de A contra su fracción molar, obtendrá una línea recta.
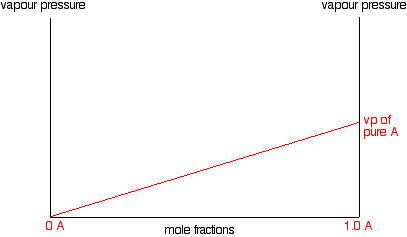
Ahora haremos lo mismo para B -salvo que lo trazaremos en el mismo conjunto de ejes. La fracción molar de B cae a medida que A aumenta por lo que la línea se inclina hacia abajo en lugar de hacia arriba. A medida que la fracción molar de B cae, su presión de vapor caerá a la misma velocidad.
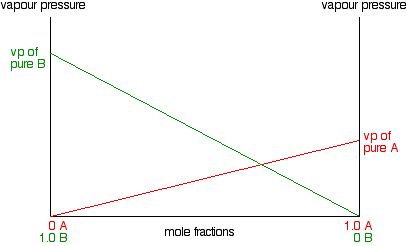
Observe que la presión de vapor de B puro es mayor que la de A. pura Eso significa que las moléculas deben desprenderse más fácilmente de la superficie de B que de A. B es el líquido más volátil. Para obtener la presión de vapor total de la mezcla, es necesario agregar los valores de A y B juntos en cada composición. El efecto neto de eso es darle una línea recta como se muestra en el siguiente diagrama.
Diagramas de punto de ebullición y composición
La relación entre el punto de ebullición y la presión de vapor
- Si un líquido tiene una alta presión de vapor a una temperatura particular, significa que sus moléculas están escapando fácilmente de la superficie.
- Si, a la misma temperatura, un segundo líquido tiene una baja presión de vapor, significa que sus moléculas no escapan tan fácilmente.
¿Qué implican estos dos aspectos sobre los puntos de ebullición de los dos líquidos? Hay dos formas de ver la pregunta anterior:
O bien:
-
Si las moléculas escapan fácilmente de la superficie, debe significar que las fuerzas intermoleculares son relativamente débiles. Eso significa que no tendrás que suministrar tanto calor para romperlos por completo y hervir el líquido. Por lo tanto, el líquido con la mayor presión de vapor a una temperatura particular es el que tiene el punto de ebullición más bajo.
O bien:
-
Los líquidos hierven cuando su presión de vapor se vuelve igual a la presión externa. Si un líquido tiene una alta presión de vapor a alguna temperatura, no tendrás que aumentar mucho la temperatura hasta que la presión de vapor alcance la presión externa. Por otro lado si la presión de vapor es baja, tendrás que calentarla mucho más para alcanzar la presión externa. Por lo tanto, el líquido con la mayor presión de vapor a una temperatura particular es el que tiene el punto de ebullición más bajo.
Para dos líquidos a la misma temperatura, el líquido con la presión de vapor más alta es el que tiene el punto de ebullición más bajo.
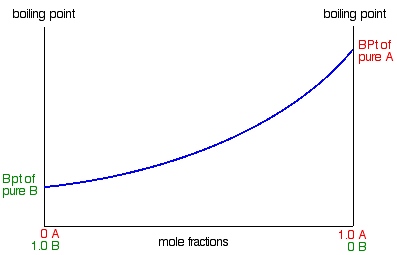
Construcción de un diagrama de punto de ebullición/composición
Para recordarte, acabamos de terminar con este diagrama de presión/composición de vapor:

Vamos a convertir esto en un diagrama de punto de ebullición/composición. Comenzaremos con los puntos de ebullición de A y B. puros Dado que B tiene la presión de vapor más alta, tendrá el punto de ebullición más bajo. Si eso no es obvio para ti, ¡regresa y lee de nuevo la última sección!

Para mezclas de A y B, quizás habrías esperado que sus puntos de ebullición formaran una línea recta uniendo los dos puntos que ya tenemos. ¡No es así! De hecho, resulta ser una curva.
Para que este diagrama sea realmente útil (y finalmente llegar al diagrama de fases al que nos dirigimos), vamos a agregar otra línea. Esta segunda línea mostrará la composición del vapor sobre la parte superior de cualquier líquido hirviente en particular.
Si hierves una mezcla líquida, esperarías encontrar que la sustancia más volátil se escapa para formar un vapor más fácilmente que la menos volátil. Eso significa que en el caso del que hemos estado hablando, se esperaría encontrar una mayor proporción de B (el componente más volátil) en el vapor que en el líquido. Se puede descubrir esta composición condensando el vapor y analizándolo. Eso te daría un punto en el diagrama.

El diagrama solo muestra lo que sucede si hierve una mezcla particular de A y B. Observe que el vapor sobre la parte superior del líquido hirviendo tiene una composición que es mucho más rica en B, el componente más volátil. Si repites este ejercicio con mezclas líquidas de muchas composiciones diferentes, puedes trazar una segunda curva, una línea de composición de vapor.
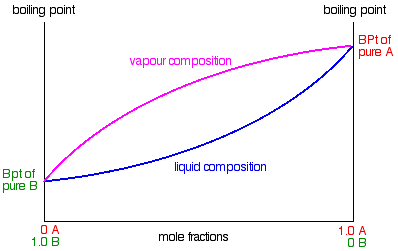
Este es ahora nuestro diagrama de fase final.
Uso del diagrama de fases
El diagrama se usa exactamente de la misma manera en que se construyó. Si hierve una mezcla líquida, puede averiguar la temperatura a la que hierve, y la composición del vapor sobre el líquido hirviendo. Por ejemplo, en el siguiente diagrama, si hierve una mezcla líquida C 1, hervirá a una temperatura T 1 y el vapor sobre la parte superior del líquido hirviendo tendrá la composición C 2.
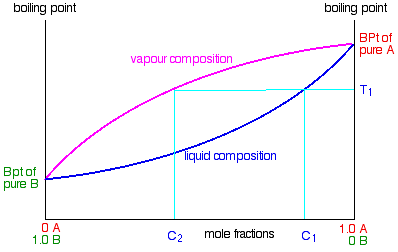
Todo lo que tienes que hacer es usar la curva de composición líquida para encontrar el punto de ebullición del líquido, y luego mirar cuál sería la composición de vapor a esa temperatura. Observe nuevamente que el vapor es mucho más rico en el componente B más volátil que la mezcla líquida original.
Los inicios de la destilación fraccionada
Supongamos que recogiste y condensaste el vapor sobre la parte superior del líquido hirviendo y lo volviste a hervir. Ahora estarías hirviendo un nuevo líquido que tenía una composición C 2. Eso herviría a una nueva temperatura T 2, y el vapor sobre la parte superior del mismo tendría una composición C 3.
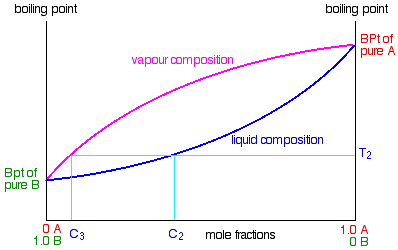
Se puede ver que ahora tenemos un vapor que se está acercando bastante a ser puro B. Si sigues haciendo esto (condensar el vapor, y luego volver a hervir el líquido producido) eventualmente obtendrás B puro Esto es obvio la base para la destilación fraccionada. Sin embargo, hacerlo así sería increíblemente tedioso, y a menos que pudieras hacer arreglos para producir y condensar enormes cantidades de vapor sobre la parte superior del líquido hirviendo, la cantidad de B que obtendrías al final sería muy pequeña. Las columnas de fraccionamiento reales (ya sea en el laboratorio o en la industria) automatizan este proceso de condensación y recalentamiento. Cómo se explorarán estos trabajos en otra página.
Colaboradores
Jim Clark (Chemguide.co.uk)


