1.3: Nueva Mecánica Cuántica
- Page ID
- 80683
La idea de Bohr de que los electrones se encuentran en diferentes orbitales o niveles de energía fue un paso importante en la comprensión de la estructura de un átomo. La relación de ondas de partículas de Louis de Broglie también fue un desarrollo crucial.
Werner Heisenberg y Erwin Schrödinger pudieron tomar estas ideas y desarrollar la mecánica cuántica moderna. El significado principal de la mecánica cuántica es la capacidad de predecir con mucha precisión las propiedades físicas utilizando principios matemáticos básicos. Heisenberg y Schrödinger utilizaron diferentes tipos de matemáticas para explicar la estructura atómica, pero finalmente alcanzaron resultados similares.
El enfoque clave de Schrödinger fue reconocer los factores que influyen en la energía de un electrón en un átomo. Vio que habría contribuciones de la ley de Coulomb, debido a fuerzas atractivas entre el electrón y el núcleo así como factores repulsivos entre los diferentes electrones. Además, Schrödinger reconoció que habría un componente de energía cinética relacionado con la longitud de onda del electrón. Schrödinger combinó estos factores en “la ecuación de onda de Schrödinger”.
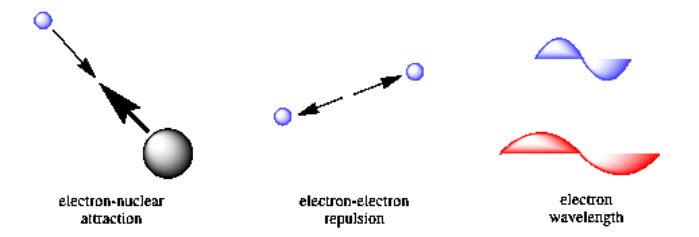
Resolver la ecuación de onda es muy útil. Una solución a la ecuación, que se llama función de onda, puede indicar la energía de un electrón en un átomo. La solución también se puede combinar con otras relaciones matemáticas que darán predicciones específicas de diferentes propiedades de átomos y moléculas.
- La ecuación de onda de Schrödinger es un enfoque para describir un electrón.
- La solución a la ecuación de onda se llama función de onda.
Si no estás familiarizado con cómo se comportan las olas, podrías empezar por mirar aquí.
- ¿Qué sucede con la energía de un electrón cuando su longitud de onda se acorta?
- ¿Qué sucede con la energía de un electrón cuando su longitud de onda se alarga?
- Si un electrón está confinado en un espacio pequeño, ¿qué pasará con la longitud de onda del electrón?
- Si se permite que un electrón se expanda a un gran volumen, ¿qué pasará con la longitud de onda del electrón?
- Respuesta a:
-
La energía del electrón se hace mayor.
- Respuesta b:
-
La energía del electrón disminuye.
- Respuesta c:
-
La longitud de onda se acorta.
- Respuesta d:
-
La longitud de onda se alarga.
Aparte de mostrarnos la energía del electrón, la función de onda lleva otra información. Un elemento adicional es la idea de fase. Esta idea se ilustra con una onda sinusoidal (aunque una función de onda de un electrón es una onda tridimensional más compleja).
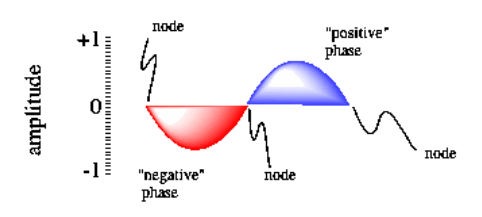
Una de las consecuencias del comportamiento de las olas es la presencia de nodos a lo largo de una ola. Un nodo es un lugar donde la onda cambia de fase; en una onda sinusoidal, la onda pasa de un “valle” o valle o fase negativa a un “pico” o colina o fase positiva. Un nodo también es lugar donde la amplitud de la onda es cero. Para un electrón, la amplitud de la onda está relacionada con la posibilidad de que se encuentre un electrón en esa posición (verá más sobre eso a continuación). No encontraríamos un electrón en un nodo, pero podría estar en una de las otras posiciones a lo largo de la onda.
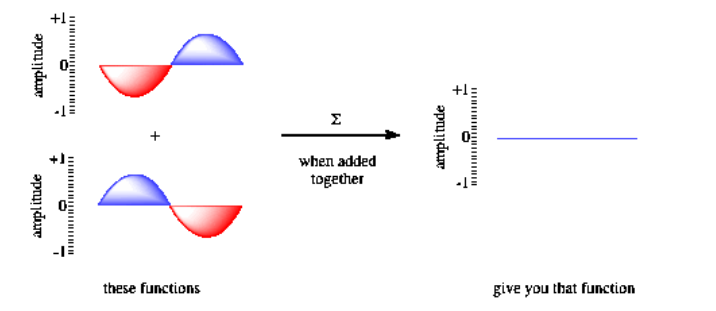
Otras consecuencias importantes de las propiedades de onda en los electrones incluyen el comportamiento de interferencia. Si se envían dos electrones a través de rendijas paralelas, resulta un patrón de difracción, como ondas de dos piedras diferentes que se superponen en un estanque. Eso es porque las formas de onda de los dos electrones interfieren entre sí. Cuando las dos ondas se superponen, interactúan entre sí de diferentes maneras, dependiendo de si están en fase o fuera de fase.
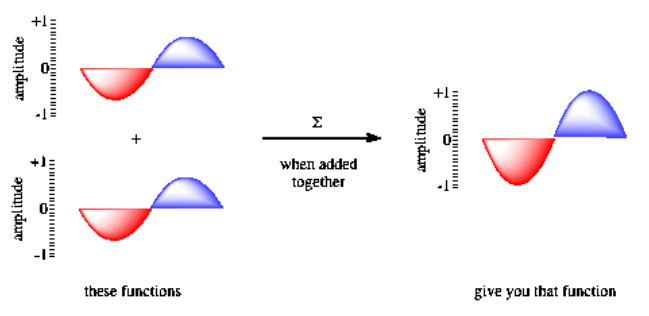
Si las ondas están en fase entre sí, se produce interferencia constructiva y se produce una onda más alta. El pico de una onda se suma al pico de otra, y el canal de una ola cae en el canal de otra. Sin embargo, si las dos ondas están desfasadas entre sí, el pico de una cae en el canal de la otra, y la ola desaparece. A ese fenómeno se le llama interferencia destructiva.
Una de las consecuencias divertidas de la mecánica cuántica es que no se necesitan dos electrones diferentes para provocar un patrón de interferencia. Un solo electrón se puede enviar a través de un par de ranuras paralelas y dar como resultado un patrón de interferencia. El electrón pasa a través de ambas rendijas al mismo tiempo. A veces un electrón no se comporta en absoluto como una partícula sólida.
- Las propiedades de onda de los electrones conducen a patrones de interferencia.
Las propiedades de onda de los electrones también se vuelven importantes al considerar la unión entre átomos. A medida que los átomos se juntan para compartir electrones, la constructuve y la interferencia destructiva entre electrones lleva a diferentes consecuencias en diferentes situaciones. Analizaremos estos factores en un capítulo posterior.
Mencionamos que las operaciones matemáticas a veces se realizan en la función de onda para predecir otras propiedades. Por ejemplo, si quieres hacerte una idea de dónde está un electrón, tienes que cuadrar la función de onda. Se toma la función de onda y la multiplica por sí misma.
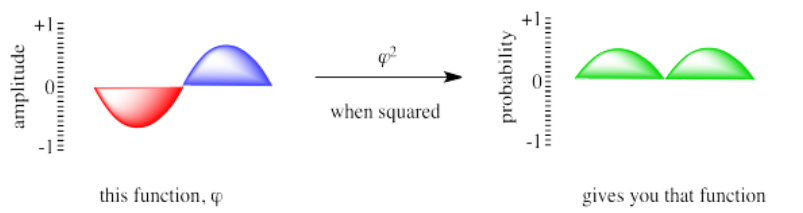
Perdemos algo de información cuando realizamos matemáticas en la función de onda. Ya no tenemos “amplitud”; en cambio tenemos una probabilidad. La curva que vemos es una distribución estadística que nos indica dónde es más probable que se encuentre el electrón (el punto más alto de la curva) así como muchos otros lugares donde también podría encontrarse el electrón (el resto de la curva). Tampoco tenemos información de fase; cuando la porción negativa de la onda se multiplicó por sí misma, dio un número positivo.
- La función de onda se puede utilizar para reducir la ubicación probable de un electrón.
¿Cuál es la probabilidad de encontrar un electrón en un nodo?
- Contestar
-
La probabilidad de encontrar un electrón en un nodo es cero.
Es útil tener en cuenta la idea de la dualidad partícula-onda, por varias razones. Cuando pensamos en un electrón como una partícula, como una pelota de tenis, es fácil esperar que se comporte como una pelota de tenis real. Después de todo, sabemos dónde está la pelota de tenis; se puede ver, ahí mismo. Pero si un electrón es una ola, como una ola en el océano, en realidad no se restringe a un solo lugar. En primer lugar, se extiende (tal vez a lo largo de muchos kilómetros, en el caso de algunas olas). En segundo lugar, no se queda quieto el tiempo suficiente para que decidas que es exactamente aquí o allá. Eso es un poco más como un electrón. Además, si tuvieras dos agujeros en una pared, solo podrías lanzar una pelota de tenis a través de un hoyo a la vez. Sin embargo, si una ola salpicara contra la pared, podría pasar a través de ambos agujeros a la vez.
Entonces, en lugar de pensar en un electrón como una bola, tal vez deberíamos pensarlo como una taza de agua. Hay un viento fuerte que sopla, así que hay olas en la superficie del agua. Además, no hay gravedad, así que podemos quitarle la copa y el agua se mantendrá unida ahí, con sus olas. Por supuesto, el electrón no es más líquido que un sólido, pero a menudo necesitamos analogías familiares para recordarnos estos diferentes aspectos de algo que realmente no podemos ver.
Cuando Schrödinger elaboró soluciones para su ecuación, volvió a encontrar evidencia de cuantificación. Bohr había encontrado que la distancia entre el electrón y el núcleo estaba cuantificada. Sin embargo, Schrödinger encontró cuatro propiedades electrónicas diferentes que fueron cuantificadas. Una de estas propiedades de un electrón, llamada el número cuántico principal, corresponde aproximadamente a la distancia cuantificada de Bohr desde el núcleo.
Dos de las otras propiedades tienen que ver con la dirección del electrón desde el núcleo. Como sucede, un electrón específico podría encontrarse en cualquier dirección desde el núcleo. Alternativamente, podría encontrarse solamente en una dirección u otra.
Pensando en sólo dos dimensiones, supongamos que tienes tres pelotas de tenis: una amarilla, una roja y otra azul. Imagina que eres el núcleo de un átomo y las pelotas de tenis son electrones. En el modelo de Bohr, las pelotas de tenis pueden encontrarse a diferentes distancias de ti. Tal vez uno está a cinco pies de distancia, uno está a diez pies de distancia, y uno a doce pies de distancia. No se pueden encontrar a tres pies de ti, ni a nueve pies de distancia u once pies de distancia. Se tienen que encontrar a esas distancias exactas. No obstante, se pueden encontrar en cualquier dirección: frente a ti, detrás de ti, a la izquierda o a la derecha. Todos podrían estar acostados en la misma dirección o todos en direcciones diferentes.
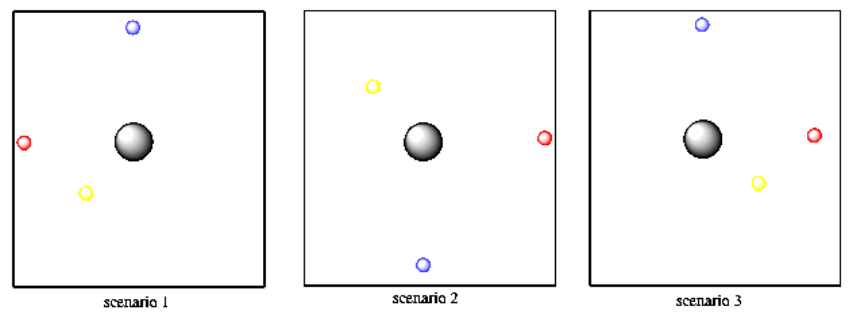
Lo que parecía estar diciendo las matemáticas de Schrödinger era que había una restricción adicional sobre dónde podían encontrarse los electrones. Además de una distancia específica, el electrón podría encontrarse sólo en ciertas direcciones desde el núcleo. Esa dirección se basó en esas otras dos propiedades cuantificadas, llamadas los números cuánticos magnéticos y acimutales. Para un conjunto de valores, el electrón se pudo encontrar en cualquier dirección en absoluto. Para otro conjunto de valores, sin embargo, el electrón se restringió a extenderse a lo largo de un eje particular.
- Según la solución de Schrödinger, un electrón en un átomo es descrito por un grupo de “números cuánticos”.
- Los números cuánticos limitan un electrón a una distancia general del núcleo (como la concha en el modelo Bohr).
- Otros números cuánticos limitan el electrón a ciertas regiones del espacio alrededor del átomo.
En este modelo, a lo mejor la pelota de tenis amarilla tiene que estar a cinco pies de camino, pero puede ser en cualquier dirección. Pero a lo mejor la pelota de tenis azul tiene diferentes números cuánticos. Está a diez pies de distancia y solo puede estar directamente frente a ti o directamente detrás de ti, pero no puede estar a tu izquierda ni a tu derecha. La pelota de tenis roja, por otro lado, solo se puede encontrar a tu izquierda o derecha, pero nunca delante de ti o detrás de ti.
También hay un cuarto número cuántico, y se llama spin. El giro no se puede describir muy bien porque no tiene una propiedad análoga del gran mundo como la distancia o la dirección. Sin embargo, es una propiedad inherente de un electrón que puede tener cualquiera de dos valores. Estos valores a veces se denominan alfa y beta, o a veces +1/2 y -1/2.
A pesar de la naturaleza abstracta del giro, sí tiene una verdadera cualidad física asociada a él: si colocas un electrón en un campo magnético, interactuará de manera diferente con el campo magnético, dependiendo del valor de su espín. De ahí que el espín esté estrechamente asociado con las propiedades magnéticas de los materiales.
Una de las reglas básicas de la mecánica cuántica es que no hay dos electrones en un mismo átomo que puedan tener los mismos dos números cuánticos. Necesitarás algunas pelotas de tenis adicionales para ver cómo funciona eso. Supongamos que tiene dos bolas rojas, dos amarillas y dos azules. La primera bola amarilla se encuentra a cinco pies de ti, en cualquier dirección. La segunda pelota de tenis amarilla también se encuentra a cinco pies de ti y en cualquier dirección. Hasta el momento, las pelotas de tenis amarillas tienen las mismas propiedades, por lo que deben tener un giro diferente. Por supuesto, no se puede decir que tienen giros diferentes a menos que los pongas en un campo magnético muy fuerte, pero sabes que son diferentes porque tienes fe en que Schrödinger hizo sus matemáticas correctamente.
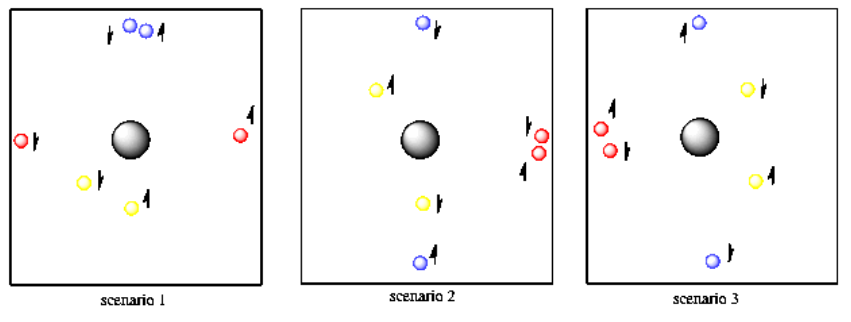
Las dos bolas azules están a diez pies de ti y solo se pueden encontrar frente a ti o detrás de ti. No importa cuál. Ambos podrían estar frente a ti o ambos detrás de ti o uno en cualquier dirección. También tienen dos giros diferentes.
Por último, las dos bolas rojas también están a diez pies de ti, pero se encuentran a tu derecha o izquierda (o a ambas). No tienen que estar a una distancia diferente de ti que las azules porque ya tienen una propiedad direccional diferente, por lo que podemos repetir la propiedad de distancia. Las bolas rojas también tienen dos giros diferentes, pero estás teniendo problemas para saber cuál es cuál.
- El giro es otra propiedad mecánica cuántica de los electrones.
- Dos electrones en un mismo átomo con todos los demás números cuánticos iguales deben tener un giro diferente.
- Spin no tiene analogía real del “gran mundo”. Sin embargo, dos electrones con diferente espín interactúan de manera diferente con un fuerte campo magnético.
Una cosa más. El mundo cuántico es un poco más sutil que eso. El mundo cuántico también involucra conceptos como el principio de incertidumbre. El principio de incertidumbre dice que es difícil encontrar la ubicación exacta de un electrón. En cambio, trabajamos con probabilidad. En lugar de estar a cinco pies de distancia exactamente, solo sabemos que el balón amarillo tiene muy buenas posibilidades de estar a cinco pies de distancia. Hay una ligera posibilidad de que esté a cuatro pies y medio de distancia, y una posibilidad muy pequeña está a solo cuatro pies de distancia.
De igual manera, la pelota de tenis roja puede no estar exactamente frente a ti, aunque probablemente no esté a más de unos pocos pies a la izquierda o a la derecha. Las pelotas de tenis azules también pueden estar a unos metros de su eje en algún lugar. No podemos predecir exactamente dónde estarán.
Hagamos un ejercicio de puntillismo. Necesitarás un lápiz, una regla y bolígrafos de cuatro colores diferentes. Los bolígrafos de gel funcionan mejor que los bolígrafos. En caso de apuro, podrías usar crayones, lápices de colores o marcadores de colores.
- Dibuja una línea a lápiz de 6 cm de largo. Marque el punto medio de la línea.
- Dibuja una segunda línea de 6 cm de largo y perpendicular a la primera línea, para que los puntos medios de las dos líneas se crucen. Deberías tener una bonita X o cruz con brazos de 3 cm de largo.
- Dibuje ligeramente en líneas discontinuas, de 10 cm de largo, a medio camino entre las líneas prmeables, para que los puntos medios de todas las líneas se crucen. Debes tener una X nueva o cruz con brazos de 5 cm de largo, superpuesta sobre la vieja cruz pero girada 45 grados.
- Elija una de las líneas sólidas en las que trabajar. Coloca dos marcas a lo largo de esa línea, a 1 cm del punto medio en cada dirección. Usando el primer bolígrafo, comienza a poner puntos en el papel, centrados en uno de esos puntos de 1 cm. Sigue agregando puntos a medida que te alejas de ese punto de 1 cm en todas las direcciones, pero debería haber cada vez menos puntos a medida que salgas. Expande tus puntos a la misma distancia en todas las direcciones. Trate de no cruzar las líneas discontinuas, sin embargo. Apunta a unos cien puntos (o 50 si no eres muy paciente o si estás usando un marcador). Debes terminar con una masa de puntos aproximadamente circular, centrada a 1 cm del punto medio; la masa debe desmayarse a lo largo de sus bordes y más pesada y oscura hacia su centro.
- Ahora haz lo mismo, usando la misma pluma, en el otro punto de 1 cm a lo largo de la misma línea.
- Ahora haz lo mismo, con una segunda pluma, a 1 cm del punto medio en ambas direcciones a lo largo de la segunda línea sólida.
- Ahora haz lo mismo, con una tercera pluma, a 3 cm del punto medio en ambas direcciones a lo largo de la primera línea sólida.
- Ahora haz lo mismo, con una cuarta pluma, a 3 cm del punto medio en ambas direcciones a lo largo de la segunda línea sólida. Deberías terminar con cuatro pares de manchas de colores. Cada punto debe tener un valor más alto (más pesado y más oscuro) en el centro y debe desvanecerse a un valor más bajo lejos de su centro.
- Contestar
-
Tu dibujo es hermoso. Deberías ponértelo en tu refrigerador, o bien envíaselo a tu madre.
Lo que has producido es un mapa de probabilidad electrónica bidimensional simplificado. Cada color corresponde a un “orbital” diferente, descrito por un conjunto de números cuánticos de principio, acimutales y magnéticos. Supongamos que sus cuatro colores describen la probabilidad de encontrar un electrón 2p x, 2p y, 3p x y 3p y. Con cada punto, encontraste exitosamente el electrón. La colección de puntos te indica dónde es más probable que se encuentre un electrón en particular; el valor más alto corresponde a la probabilidad más alta de localizar un electrón.
Compara y contrasta tus conjuntos de puntos entre sí.
Construir otro mapa de probabilidad de electrones puntillista, mostrando un corte bidimensional a través de un orbital 2s y 3s en dos colores diferentes. Comienza con la misma cruz dibujada a lápiz, pero esta vez cuando bajas puntos con el primer bolígrafo, centrado a 1 cm del punto medio de la cruz, no los restrinjas a lo largo de una línea. Que sean cualquier dirección desde el punto medio. Usa cien puntos. Agrega un segundo conjunto de puntos con el segundo bolígrafo, centrado a 3 cm del punto medio de la cruz, y en cualquier dirección desde el punto medio. Compara y contrasta los dos conjuntos de puntos entre sí, y con tu mapa anterior.
¿Por qué los electrones se ordenan de esta manera? Uno de los factores que afectan a los electrones es la repulsión electrostática. Se repelen entre sí. Para minimizar esa repulsión, el primer par de electrones podría estar a cierta distancia del núcleo. Un segundo par puede estar un poco más lejos, así que no están demasiado cerca de los dos primeros. Una vez que alcanzamos cierta distancia del núcleo, los electrones pueden estar suficientemente dispersos como para que se pueda encontrar más de un par a esa distancia. Aún así, lo mejor es mantenerlos un poco más alejados el uno del otro. Un par puede estar a lo largo de un eje, y otro par puede estar a lo largo de un eje perpendicular. Por supuesto, hay cierta repulsión entre dos electrones dentro del mismo par, pero la repulsión en realidad se disminuye un poco al tener giros opuestos (esto se llama emparejamiento de espines).

