1.4: Números cuánticos
- Page ID
- 80686
En la muy, muy pequeña escala del universo, las cosas no se comportan exactamente como estamos acostumbrados. Los electrones son un ejemplo. No son objetos sólidos. Son olas. ¿O lo son? En la nanoescala, las cosas pueden ser tanto partículas como ondas. Una partícula individual como un electrón tiene masa, pero está extendida, no ubicada en una posición, y tiene una longitud de onda.
El reconocimiento de las propiedades de onda del electrón proporcionó un gran avance en la comprensión de sus propiedades. La ecuación de onda de Schrödinger permitió a los científicos hacer predicciones sobre la estructura electrónica de los átomos. ¿Dónde se encuentran los electrones? ¿Cuál es su energía?
La función de onda es una expresión matemática que describe al electrón. Se puede trazar, como una gráfica, aunque es una gráfica en tres dimensiones en lugar de dos. La gráfica tridimensional de la función ondulada a veces se denomina orbital. A menudo, a los químicos les resulta útil mirar imágenes de orbitales para obtener alguna idea de dónde pueden estar los electrones y cómo pueden comportarse. Los orbitales son algo así como la forma de onda del electrón.
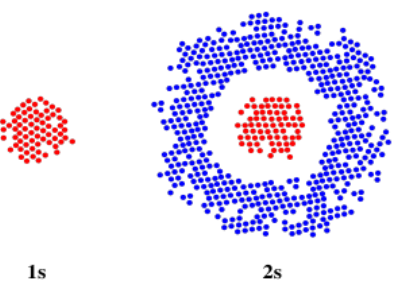
En otro sentido, los orbitales están relacionados con mapas de probabilidad: la función de onda al cuadrado revela la probabilidad de que un electrón se ubique en una posición particular en el espacio. Podría ser útil imaginarlos de esa manera. Supongamos que podrías tomar una serie de imágenes de un electrón y superponer todas esas imágenes, como la fotografía de lapso de tiempo. El resultado podría parecerse al dibujo de abajo, en el que cada punto representa dónde aparecía el electrón en una de nuestras imágenes. Es imposible predecir exactamente dónde aparecería el electrón en la siguiente imagen, pero sería una suposición bastante buena que aparecería en algún lugar del mismo círculo áspero que lo hizo todas las otras veces.

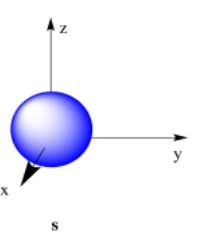
Por supuesto, en el espacio tridimensional, estaríamos mirando una esfera en lugar de un círculo. A lo mejor nuestro cuadro es sólo una delgada porción a través de la mitad de esa esfera. En el mismo centro de la esfera, encontraríamos el núcleo del átomo. Entonces este electrón se encuentra a cierta distancia del núcleo, pero se puede encontrar en cualquier dirección. Llamamos a un electrón que se comporta de esta manera un electrón s.
El dibujo anterior está etiquetado como 1s, específicamente. Un átomo puede tener muchos s electrones, pero este es el que está más cerca del núcleo. Es el primer electrón s que encontraríamos si empezáramos en el núcleo y nos moviéramos hacia afuera a través del átomo.
Otros electrones tienen diferentes distribuciones sobre el átomo. Es más probable que se localicen en diferentes lugares. Al resolver la ecuación de onda de Schrödinger, resulta que existen cuatro variables que deben restringirse a ciertos valores si la ecuación va a tener una solución sensata. Los valores de estas variables determinan dónde es probable que se encuentre el electrón alrededor del átomo, y aproximadamente cuánta energía tendrá.
A los cuatro números cuánticos se les dan los símbolos n, m, l y s. Si es necesario, tal vez lo recuerde a través de la palabra ANIMALES. Cada número cuántico te dice algo diferente sobre el electrón que describe. El primero, n, te habla de distancia. Este número tiene que ser un entero, por lo que podría ser 1, 2, 3, 4,... ¿A qué distancia está el electrón del núcleo? Si n = 1, el electrón está tan cerca del núcleo como podría estar; si n = 4, está más lejos.
A veces pensamos en n como describiendo el “caparazón” del átomo. Piense en el viejo modelo Bohr del átomo, encontrándose electrones a diferentes distancias del núcleo. Es como si el átomo fuera un conjunto de muñecas rusas anidadas, con una concha fuera de otra. El primer caparazón (n = 1) está cerca del núcleo, el segundo (n = 2) está más alejado, y así sucesivamente.
El segundo número, m, te habla de la distribución espacial, o forma. A lo mejor sabemos lo cerca que está el electrón del núcleo, pero ¿se puede encontrar en algún lugar dentro de cierta distancia, o sólo en ciertas direcciones? Este número tiene que ser un número entero, y tiene que ser menor que n. Si n = 1, m = 0. Si m = 0, no hay preferencia de “forma”, y el orbital es esférico. Estos números describen nuestro orbital 1s, arriba.
El tercer número, l, puede ser un número entero positivo o negativo. Puede ser en cualquier lugar de + m a - m. Si n = 1, y m = 0, entonces l = 0, también. El número l se correlaciona aproximadamente con la orientación: ¿en qué dirección se orienta la órbita? Si sólo hay un valor posible de l, entonces sólo debe haber una orientación posible. Eso es cierto para algo esférico; no importa en qué dirección lo mires, porque siempre se verá igual.
El número final es s. Ese es el número cuántico de giro y puede tener sólo dos valores, independientemente de los valores de los otros números cuánticos. Es +1/2 o -1/2. El giro no tiene una explicación muy tangible en el mundo macroscópico, pero si los electrones tienen valores de espín opuestos entonces pueden ocupar el mismo orbital. Así, un par de electrones puede ser descrito por cada orbital.
Cada electrón en un átomo debe tener un conjunto único de número cuántico. Si n, m y l son iguales para dos electrones, entonces s debe ser diferente.
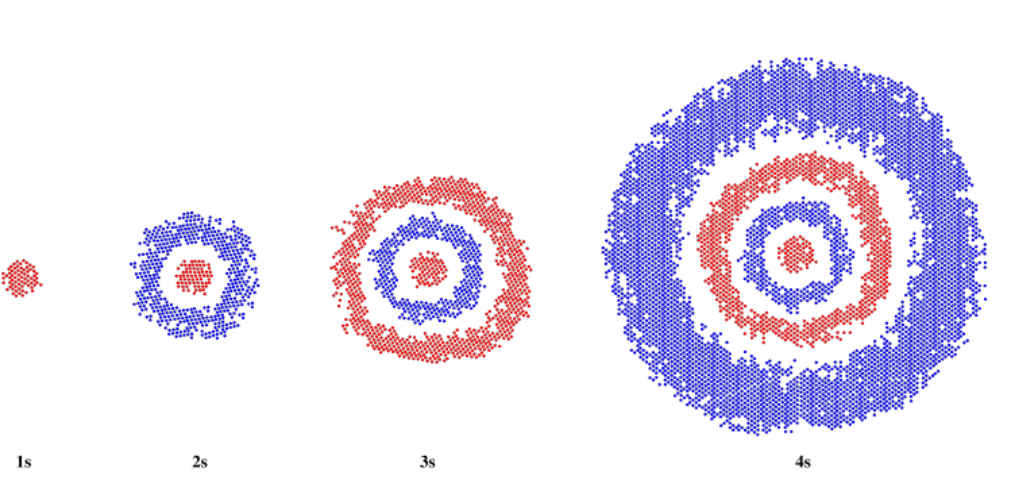
¿Qué pasa cuando n = 2? En ese caso, el electrón podría estar más lejos del núcleo. El orbital será más grande. En este caso, m podría ser igual de nuevo a 0, o podría igualar a 1. Si m = 0, como en el caso del orbital 1s, el orbital será esférico. Será un orbital de 2s. Por supuesto, l = 0, también, porque l sólo puede ir de + m a - m. Este orbital también será esférico, porque m = 0. Se verá igual que un orbital 1s, solo que más grande.
Sin embargo, si pudiéramos mirar un corte delgado a través del orbital, veríamos una diferencia entre un orbital 1s y un 2s. El orbital 1s es uniforme en todas partes, pero el orbital 2s tiene un cambio de fase. Recuerden, es una ola, y tiene picos y valles. Se trata de una onda tridimensional, esférica, pero tiene un canal anidado en su interior y el pico está en el exterior (o viceversa).
Si vamos más lejos del núcleo, podemos encontrarnos con un orbital 3s y un orbital 4s. Estos, también, parecerían orbitales 1s más grandes desde el exterior. Sin embargo, un corte delgado a través del medio revelaría el comportamiento de fase del orbotal, con picos y valles alternando desde el centro hasta el borde.
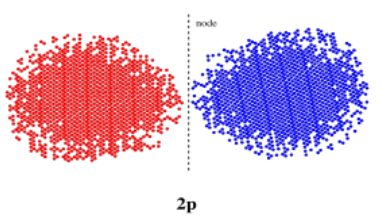
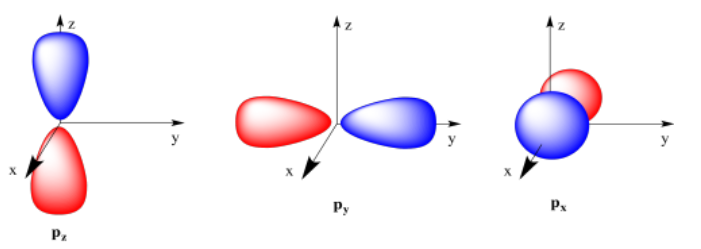
Pero vamos a dar un paso atrás por un momento. Si n = 2, entonces m = 0 o 1, porque m puede ser cualquier entero menor que n. Miramos el caso en el que m = 0; eso es un orbital s. ¿Y si m = 1? El número cuántico m describe el número de planos nodales que atraviesan el centro de una órbita. Si m = 1, tomaríamos el orbital s normal y lo cortaríamos por el medio (o enrollaríamos una cuerda alrededor del centro y la ataríamos apretada) para obtener dos mitades diferentes. Estas mitades estarían fuera de fase entre sí. Este tipo de orbital se denomina orbital p. Tiene dos lóbulos. En el lóbulo está en un lado del núcleo y el otro lóbulo está en el otro lado del núcleo.
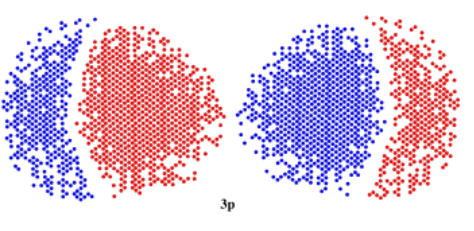
Si m = 1, entonces l = 1, 0 o -1. Eso significa que esta p orbital podría estar orientada en cualquiera de tres direcciones. Ya que realmente estamos hablando de tres electrones diferentes, y se repelerían entre sí, entonces llegarán lo más lejos posible el uno del otro. La forma más fácil de hacerlo, si puedes imaginar los ejes x, y y z que se encuentran en el núcleo, es tener un orbital p apuntando a lo largo del eje x, uno a lo largo del eje y y uno a lo largo del eje z. Estos tres orbitales p se denominan 2p x, 2p y y 2p z.
Al igual que con la órbita s, también podríamos tener p orbitales más alejados del núcleo. No podemos tener uno más cerca del núcleo; no hay suficiente espacio más cerca del núcleo, y las reglas cuánticas impiden un orbital p a nivel de energía n = 1. Un orbital de 3p se vería igual que un orbital de 2p, y podría estar en tres direcciones diferentes. Sin embargo, si pudiéramos tomar una porción delgada por su centro y sacarla, podríamos ver los mismos cambios de fase interna que vimos en los orbitales 2s, 3s y 4s.
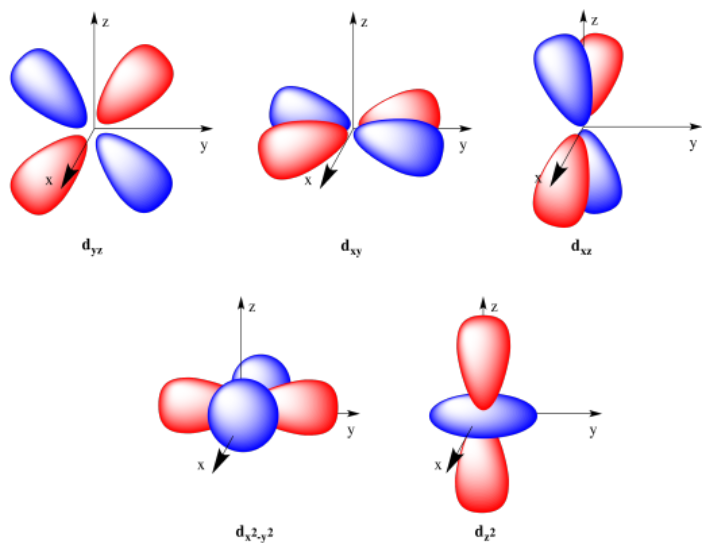
Entonces podemos tener una órbita s esférica a nivel de energía 1, otra orbital esférica s en el nivel de energía dos, y tres orbitales p en forma de hélice o en forma de mancuerna en el nivel de energía 2. ¿Qué pasa con el nivel de energía 3? Si n = 3, entonces m = 0, 1 o 2. Eso significa que hay una tercera forma posible en este nivel. Para ver la forma, tomaríamos una p orbital y la pellizcaríamos por la mitad otra vez, pero en una dirección perpendicular a la que elegimos la primera vez. Esto daría como resultado una forma de hoja de trébol. A esto se le llama d orbital. Habría cinco orientaciones diferentes de un orbital d, porque l = 2, 1, 0, -1 o -2.
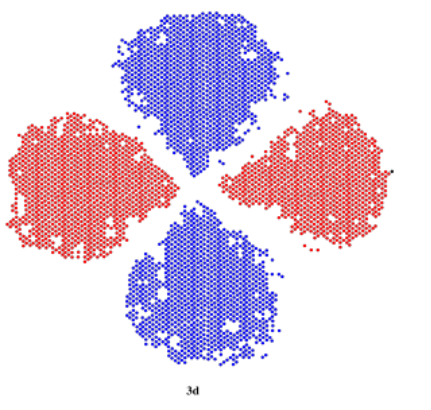
Los d orbitales pueden apuntar sus lóbulos entre los ejes: el d xy tiene lóbulos en el plano xy pero entre los ejes x e y; el d yz está en el plano yz con lóbulos entre los ejes y y z; el d xz está en el plano xz y sus lóbulos apuntan entre los ejes x y z. Los dos d orbitales restantes apuntan a lo largo de los ejes. El orbital d x 2 -y 2 apunta los lóbulos de su hoja de trébol a lo largo de los ejes x e y. El orbital d z 2 no es una forma de trébol como los demás; parece un orbital p que emerge de una rosquilla. Los dos lóbulos se extienden a lo largo del eje z, y la rosquilla (generalmente llamada toroide) se asienta en el plano xy.
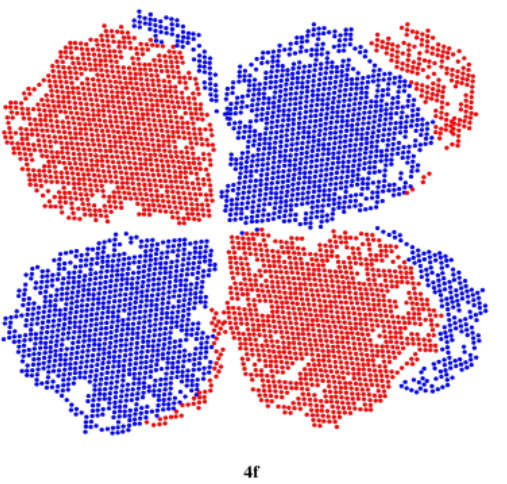
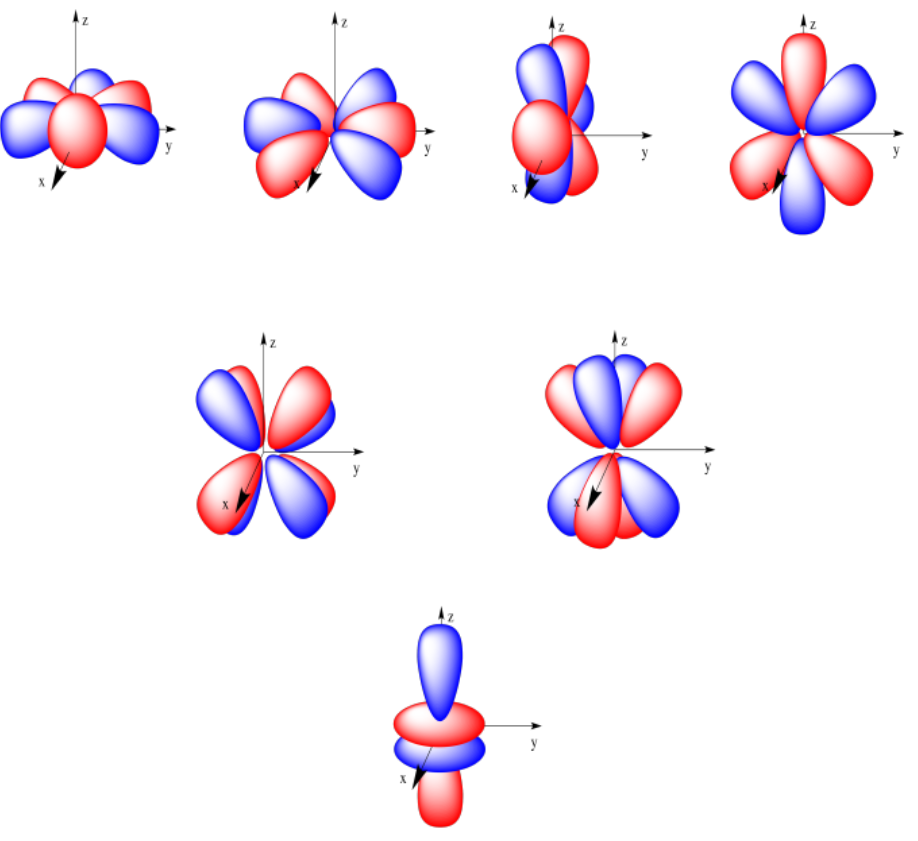
Podríamos ir un paso más allá, aunque no es probable que te encuentres con el siguiente nivel (muchos estudiantes solo necesitan trabajar con orbitales s y p). Si n = 4, podríamos tener orbitales s, p o d para los valores de m que hemos visto antes, pero si m = 3, entonces tendremos que cortar nuevamente la forma orbital d en lóbulos adicionales, produciendo una orbital f funky. En realidad hay varias formas en que esto sucede, produciendo varias formas diferentes; solo una se ilustra a continuación. Un orbital f puede tener siete orientaciones posibles.
Más comúnmente, las formas generales de estos orbitales se representan en forma de “caricatura”. Por ejemplo, una órbita s generalmente solo se muestra como una bola o esfera.
Aquí se muestran los orbitales de las tres p. Cada una es una forma de mancuerna apuntando en una dirección diferente a lo largo de las coordenadas cartesianas (x, y, z).
Hay cinco orbitales d. Cuatro de ellos son formas de trébol, pero el quinto contiene un toroide (o forma de rosquilla).
A continuación se muestran los siete orbitales f. Cuatro de ellos parecen segmentos anaranjados, acostados en un plano. Dos de ellos se parecen a los orbitales de hoja de trébol d que se han dividido en dos capas. El último es como el orbital d z 2, solo que tiene dos toroides en lugar de uno.
Podemos resumir los números cuánticos de un par de maneras. Recuerde, los números cuánticos son solo variables en la ecuación de onda de Schrödinger que tienen que tomar ciertos valores para que la ecuación tenga una solución sensata. Estos valores suelen ser enteros, y dependen unos de otros. Hay algo diferente en los números cuánticos que describen cada electrón en un átomo; en parte, eso ayuda a mantener los electrones alejados unos de otros.
- Los números cuánticos están limitados a valores específicos.
- Cada electrón en un átomo tiene un conjunto único de números cuánticos.
| número | n | m | l | s |
| reglas | entero | menos de n | -m a +m | 1/2 o -1/2 |
Por ejemplo, los electrones 1s en un átomo de helio tienen que ser diferentes entre sí de alguna manera. Tienen los mismos valores de n, m y l, así que s es diferente.
| número | n | m | l | s |
| reglas | entero | menos de n | - m a + m | 1/2 o -1/2 |
| 1er set (1s) | 1 | 0 | 0 | 1/2 |
| 1 | 0 | 0 | -1/2 |
A medida que avanzamos hacia la segunda “capa” de electrones alrededor del átomo, m puede variar, y también l. Eso significa que obtenemos diferentes formas y orientaciones de las ondas permitidas para el electrón. Ignoraremos s en la siguiente tabla; en cada caso, hay dos posibilidades, s = 1/2 y s = -1/2; dos electrones pueden ser descritos por cada orbital.
| número | n | m | l | descripción orbital |
| reglas | entero | menos de n | - m a + m | |
| 1er set (1s) | 1 | 0 | 0 | esférico |
| 2do set (2s) | 2 | 0 | 0 | esférico |
| 3er set (2p) | 2 | 1 | -1 | mancuerna (direcciones ortogonales) |
| 2 | 1 | 0 | ||
| 2 | 1 | -1 |
Cuando llegamos al 3er caparazón, hay aún más variaciones.
| número | n | m | l | descripción orbital |
| reglas | entero | menos de n | -m a +m | |
| 4º set (3s) | 3 | 0 | 0 | esférico |
| 5º set (3p) | 3 | 1 | -1 | mancuerna |
| 3 | 1 | 0 | ||
| 3 | 1 | 1 | ||
| 6º set (3d) | 3 | 2 | -2 | hoja de trébol |
| 3 | 2 | -1 | ||
| 3 | 2 | 0 | ||
| 3 | 2 | 1 | ||
| 3 | 2 | 2 |
En general, el número cuántico n indica la concha en la que se encuentra un electrón. Es decir, indica distancia desde el núcleo.
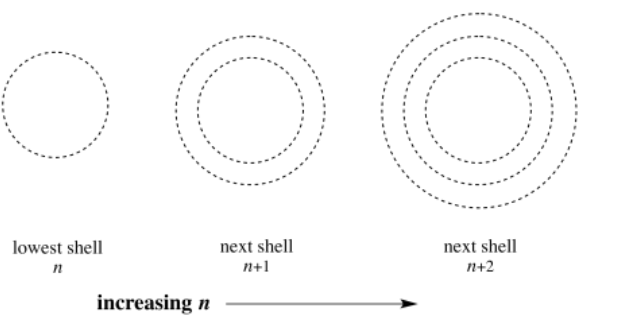
Además, n también puede indicar el número de nodos esféricos en una órbita. Como vimos en la progresión de los orbitales s, cada tipo de orbital (s, p, d, f) se “anida” cuando nos movemos a niveles superiores; un orbital 2s es como un orbital 1s anidado dentro de una concha esférica más grande, con un nodo esférico entre las dos partes. Un orbital 3s contiene un nodo esférico más (dos en total), y así sucesivamente.
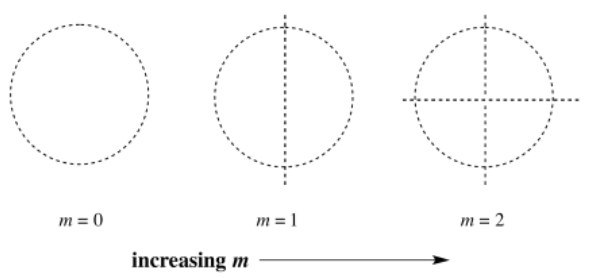
El número cuántico m indica la forma de la órbita. ¿La órbita está dividida en diferentes lóbulos? Descrito de otra manera, indica cuántos nodos o planos nodales hay entre estos lóbulos. Un s orbital es completamente esférico, sin lóbulos. Un orbital p tiene un plano nodal cortándolo por la mitad, formando dos lóbulos. Un orbital d tiene dos planos nodales, generalmente dando como resultado cuatro lóbulos, y así sucesivamente.
Si el orbital tiene una forma no esférica, l corresponde a diferentes direcciones en las que puede orientarse. Por supuesto, s es el giro, y dos electrones en un mismo orbital tienen que tener espines opuestos.
Proporcione etiquetas (por ejemplo, 1s, 3p, etc.) para las siguientes descripciones orbitales.
- un orbital esférico en la segunda capa del átomo.
- un orbital en forma de mancuerna en el tercer caparazón del átomo.
- un orbital en forma de hoja de trébol en la tercera capa del átomo.
- un orbital en forma de rebanada de naranja en la quinta capa del átomo.
- un orbital que parece una bola anidada dentro de una segunda bola metida dentro de una tercera bola
- Respuesta a:
-
2s
- Respuesta b:
-
3p
- Respuesta c:
-
3d
- Respuesta d:
-
5f
- Respuesta e:
-
4s
Dibuja caricaturas de los siguientes orbitales.
- un orbital 4p.
- un orbital 4d
- un orbital 5d
- a 6f orbital
- Contestar
-
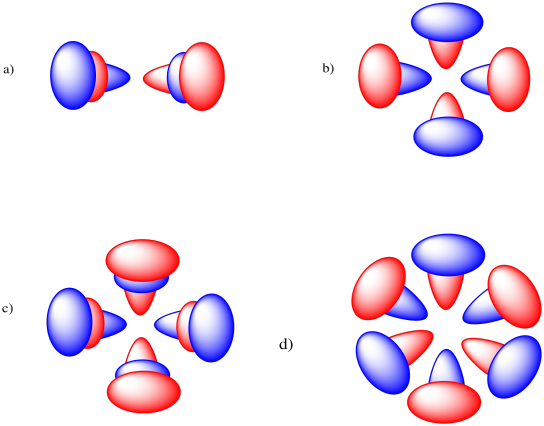
A medida que vamos a conchas superiores en el átomo, comenzamos a ver nodos esféricos adicionales en los orbitales. Haga un boceto de cada orbital debajo, y superponga una onda sinusoidal repetitiva sobre el dibujo de tal manera que los nodos en la onda sinusoidal correspondan a los nodos en la órbita.
- un orbital 2p
- un orbital 3p
- un orbital 4p
- Contestar
-
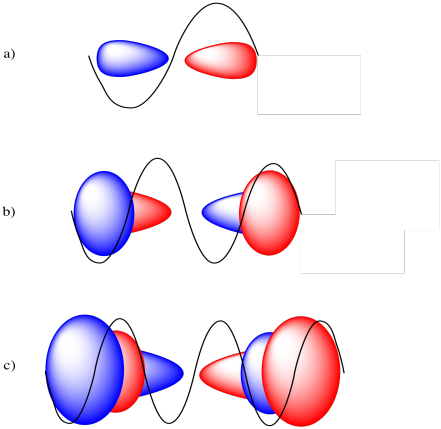
De un extremo de la órbita a otro, el orbital 2p cubre una onda sinusoidal completa, una orbital 3p cubre dos ondas sinusoidales completas y una orbital 4p cubre tres ondas sinusoidales completas.
¿Qué pasa con el número de longitudes de onda sinusoidales a medida que avanzamos de un caparazón a otro?

