1.5: El Proceso Aufbau
- Page ID
- 80684
El modelo mecánico cuántico nos permite tomar un átomo y hacer predicciones sobre sus propiedades. Todo lo que necesitamos saber es cuántos protones tiene (y cuántos electrones, que es lo mismo que el número de protones para un átomo neutro). Podemos predecir las propiedades del átomo con base en nuestra vaga idea de dónde están sus electrones y, lo que es más importante, la energía de esos electrones.
Cómo los electrones llenan sus posiciones alrededor de un átomo se llama Proceso Aufbau (alemán: proceso de “acumulación”). El Proceso Aufbau se trata de mantener los electrones a su menor energía posible.
Un corolario de la ley de Coulomb es que la energía de un electrón se ve afectada por fuerzas atractivas y repulsivas. Cuanto más cerca esté un electrón al núcleo, menor será su energía. Cuanto más cerca esté un electrón de otro electrón, mayor será su energía.
Por supuesto, un principio básico de la termodinámica es que un sistema procederá a la menor energía posible. Eso quiere decir, si un átomo tiene un solo electrón, el electrón tendrá números cuánticos que lo coloquen en la energía más baja posible. Estará lo más cerca posible del núcleo positivo.
Si un átomo tiene un segundo electrón, también estará lo más cerca posible del núcleo. Podría tener los mismos números cuánticos que el primer electrón, a excepción del espín. Hay una compensación, por supuesto, porque esos dos electrones estarán lo suficientemente cerca como para repelerse el uno al otro. No obstante, si se trata de una elección entre eso y tomar una posición mucho más alejada del núcleo, el segundo electrón seguirá adelante y se emparejará. Estos dos electrones a veces se describen como “en el mismo orbital”; sus tres primeros números cuánticos son los mismos, por lo que probablemente se encuentran en algún lugar de la misma región del espacio. Este primer orbital, que no tiene restricciones direccionales, se llama orbital 1s.

Sólo hay espacio para una órbita a esta distancia del núcleo. Un tercer electrón tiene que ocupar otro orbital más alejado, el orbital 2s. Nuevamente, este es un orbital esférico: el electrón se puede encontrar en cualquier dirección. El 2 en 2s significa que el número cuántico principal es dos (correspondiente al segundo nivel de energía general). La s es un código para otros números cuánticos; significa que el electrón se puede encontrar en cualquier dirección, al igual que los electrones 1s.
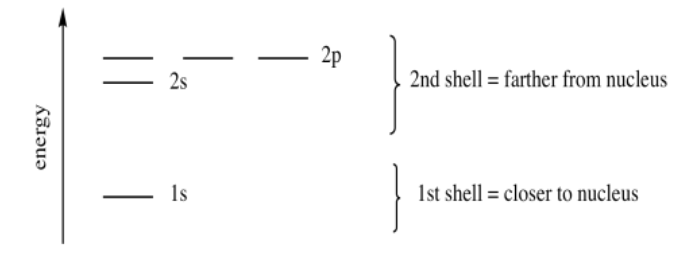
El segundo nivel de energía es lo suficientemente grande como para acomodar orbitales adicionales, pero están un poco más lejos del núcleo. A estos se les llama los orbitales 2p. Son regiones de espacio a lo largo de los ejes x, y y z. Hay tres orbitales de este tipo, y solo se les llama p x, p y p z para recordarnos que son ortogonales entre sí.
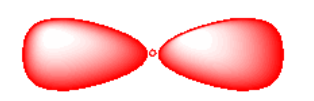
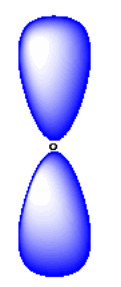
Expresado de una manera diferente, un electrón con el número cuántico principal 2 puede tener cuatro combinaciones diferentes de sus otros números cuánticos. Estas combinaciones se denotan 2s, 2p x, 2p y y 2p z. Las tres combinaciones 2p son un poco más altas en energía que la orbital 2s.

¿Por qué el nivel 2p es superior al nivel 2s? Eso está relacionado con el comportamiento de las olas que vimos antes. Con un nodo en el medio, el orbital 2p se comporta como una onda de mayor frecuencia que la orbital 2s. Una onda de mayor frecuencia tiene mayor energía. Entonces, un orbital p, con un nodo, es siempre mayor en energía que un orbital s, sin nodo.
Una vez más, tenemos varios niveles de energía disponibles para un electrón, pero ellos rodearán al átomo de una manera que disminuya la energía. Un segundo electrón permanece en el orbital 1s de menor energía.
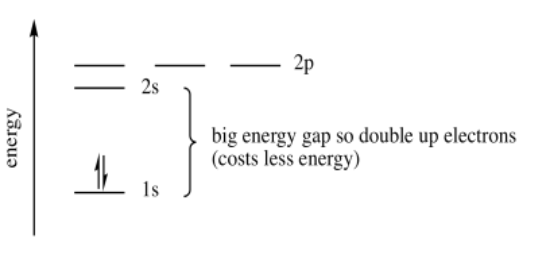
Un tercer electrón entrará en el orbital 2s. Es la más baja en energía. ¿Y un cuarto? ¿Entra en los 2s o en un 2p? Una vez más la energía de emparejamiento no es tan grande como el salto de energía hasta el orbital 2p. El cuarto electrón se empareja hacia arriba en el orbital 2s.
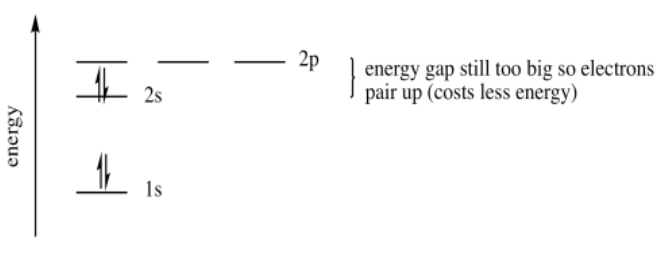
Un quinto electrón entra en uno de los orbitales 2p. No importa cuál. Diremos que es la p x, arbitrariamente. Un sexto electrón nuevamente podría emparejarse en el p x, o podría entrar en el p y. Pero el nivel p y es realmente el mismo que el p x, solo en una dirección diferente. La energía es la misma. Eso significa que un sexto electrón entrará en el p y en lugar de emparejarse en el p x, donde experimentaría repulsión extra.
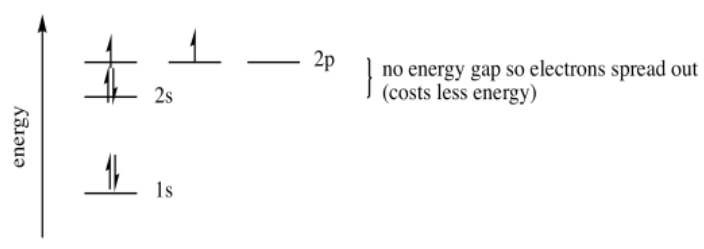
Tenga en cuenta que los orbitales p a menudo se dibujan de manera un poco diferente. Por ejemplo, los orbitales p suelen dibujarse de una manera que demuestre que tienen fase. O los dos lóbulos están coloreados de manera diferente para mostrar que están desfasados entre sí, o se muestran con un lóbulo sombreado y el otro dejado en blanco.
Este patrón de “relleno” de electrones se sigue generalmente para todos los elementos. El recuento de cuántos electrones se encuentran en cada orbital se llama configuración electrónica. Por ejemplo, el hidrógeno tiene sólo un electrón. Su configuración de estado fundamental (es decir, asumiendo que el electrón no ha sido excitado a otro orbital a través de la adición de energía) es 1s 1.
Por otra parte, un átomo con seis electrones, como el elemento carbono, tiene la configuración 1s 2 2s 2 2p x 1 2p y 1. Hay un electrón en cada uno de los dos orbitales p para evitar la repulsión, lo que sucedería si estuvieran en el mismo.
Escriba configuraciones de electrones para los siguientes elementos.
- oxígeno, O
- azufre, S
- silicio, Si
- nitrógeno, N
- argón, Ar
- neón, Ne
- Respuesta a:
-
O: 1s 2 2s 2 2p x 2 2p y 1 2p z 1
- Respuesta b:
-
S: 1s 2 2s 2 2p 6 3s 2 3p x 2 3p x 2 3p y 1 3p z 1
- Respuesta c:
-
Si: 1s 2 2s 2 2p 6 3s 2 3p x 2 3p x 1 3p y 1
- Respuesta d:
-
N: 1s 2 2s 2 2p x 1 2p y 1 2p z 1
- Respuesta e:
-
Ar: 1s 2 2s 2 2p 6 3s 2 3p 6
- Respuesta f:
-
Ne: 1s 2 2s 2 2p 6
Configuración electrónica y tabla periódica
Puede que ya sepas que la configuración electrónica es la razón por la que la tabla periódica funciona de la manera que lo hace. Mendeleev y otros notaron que ciertos elementos tenían propiedades muy similares, y eso se debe a que tienen configuraciones de electrones muy similares. El litio tiene configuración 1s 2 2s 1 y su álcali hermana, sodio, tiene configuración 1s 2 2s 2 2p x 2 2p y 2 2p z 2 3s 1. En ambos casos, el último electrón agregado es un electrón s desapareado. El último electrón, o los últimos electrones, añadidos a un átomo generalmente juegan un papel fuerte en la forma en que se comporta el átomo. Este electrón “fronterizo” es el que se encuentra en los límites exteriores del átomo. Si el átomo va a interactuar con algo, el electrón fronterizo se encontrará con la cosa primero. En contraste, los electrones “centrales” más cercanos al núcleo están más protegidos del exterior.
- El orden de los electrones en un átomo, de menor a mayor energía, es:
- 1s
- 2s
- 2p
Hay algunos atajos que tomamos con configuraciones de electrones. Tendemos a abreviar “conchas llenas” (es decir, todos los orbitales posibles con un número cuántico de principio dado están llenos de electrones) y “subconchas” rellenas (como 2s o 2p). En primer lugar, en el caso de los orbitales p, si se llenan todos los orbitales p, podríamos simplemente escribir 2p 6 en lugar de 2p x 2 2p y 2 2p z 2, porque solo hay una manera de llenar todos los orbitales. Sin embargo, no necesariamente escribiríamos 2p 2 en lugar de 2p x 1 2p y 1, porque tal vez desearíamos dejar claro que la configuración no involucra dos electrones en un orbital p en ese punto, como en 2p x 2 2p y 0.
Además, prescindimos de etiquetas orbitales por completo para ignorar los electrones centrales en una carcasa llena. Por ejemplo, en lugar de escribir 1s 2 2s 1 para litio, podemos escribir [He] 2s 1. En lugar de escribir 1s 2 2s 2 2p x 2 2p y 2 2p z 2 3s 1 para sodio, escribimos [Ne] 3s 1. El [Él] significa todos los electrones que se encuentran en un átomo de helio, que es un gas noble. El [Ne] significa todos los electrones que se encuentran en un átomo de neón. Un gas noble es un elemento no reactivo con una concha llena: helio, neón, argón, kriptón, xenón o radón.
[Él] = 1s 2 así que [Él] 2s 1 = 1s 2 2s 1
[Ne] = 1s 2 2s 2 2p 6 entonces [Ne] 3s 1 = 1s 2 2s 2 2p 6 3s 1
Los electrones más allá de la capa de gas noble se llaman electrones de valencia.
Escriba configuraciones de electrones abreviadas para los siguientes elementos.
- cloro, Cl
- calcio, Ca
- aluminio, Al
- fósforo, P
- Respuesta a:
-
Cl: [Ne] 3s 2 3p x 2 3p y 2 3p z 1
- Respuesta b:
-
Ca: [Ar] 4s 2
- Respuesta c:
-
Al: [Ne] 3s 2 3p x 1
- Respuesta d:
-
P: [Ne] 3s 2 3p x 1 3p y 1 3p z 1
Principio cuántico número 3 en realidad permite un tercer conjunto de orbitales. Estos se llaman los orbitales d. Los orbitales d son un poco como orbitales p, pero son bidimensionales en lugar de unidimensionales. Un electrón d, por ejemplo, podría extenderse a lo largo del eje x y del eje y, pero no entre los ejes.
Los orbitales d tienen cinco orientaciones permitidas. Se pueden encontrar a lo largo de los ejes x e y (llamados d xy), a lo largo de los ejes x e y (llamados d xz), o a lo largo de los ejes y y z (llamados d yz). Alternativamente, se pueden encontrar entre los ejes en su lugar, girados 45 grados lejos de uno de los otros d orbitales. Uno de ellos, llamado orbital d x 2 -y 2, se encuentra entre los ejes x e y. De la misma manera, se podría imaginar un orbital entre los ejes x y z y entre los ejes y y z, pero eso haría seis orientaciones diferentes. Las reglas mecánicas cuánticas no lo permiten. Como resultado, dos de las posibles combinaciones colapsan en una suma matemática, haciendo solo una orbital. A ésta la llamamos orbital d z 2.
Si miramos la tercera fila en la tabla periódica, vemos esos tres sub-shells (el s, luego el p, luego el d). Nuevamente, el subshell 3s se llena primero. Con menos nodos, este orbital es menor en energía que ya sea el 3p o el 3d. El orbital 3d tiene más nodos que el 3p, por lo que es incluso mayor en energía que el 3p. De hecho, es incluso un poco más alto en energía que el orbital 4s, el primer subcaparazón del siguiente caparazón.
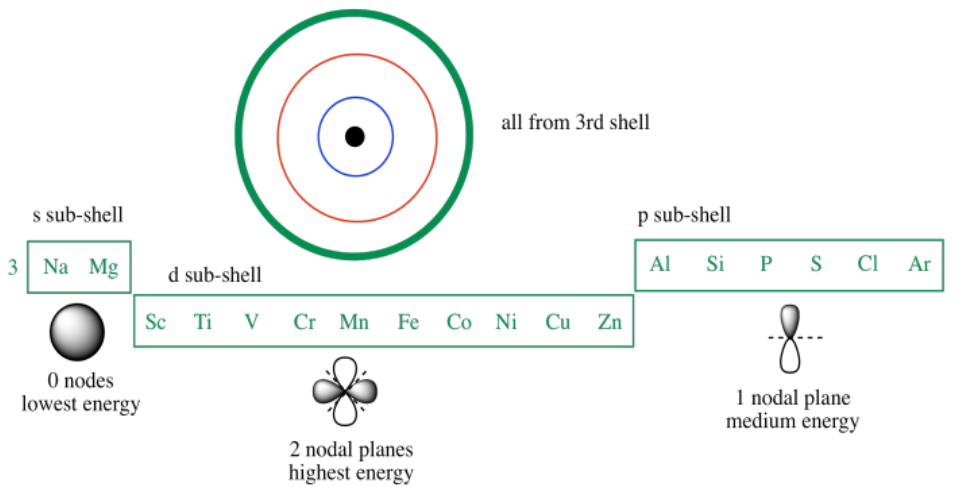
Entonces, los orbitales 3d son más altos en energía que los orbitales 3p. El nivel 3d es muy similar en energía al nivel 4s. Por esa razón, los últimos electrones del calcio entran en un orbital 4s, no en un orbital 3d. El calcio se comporta de manera muy parecida al magnesio como resultado.
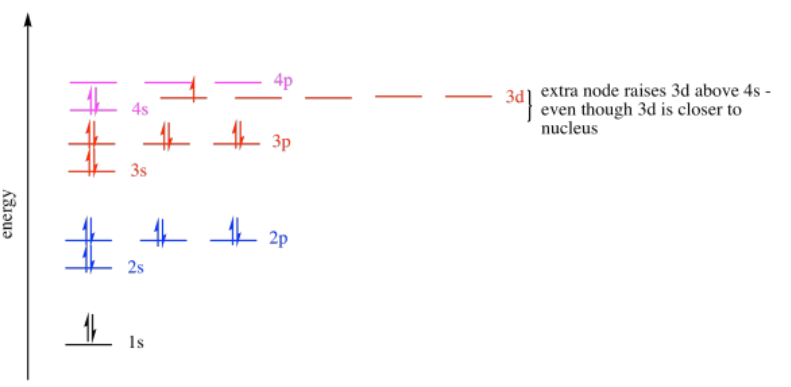
- El orden de los electrones en un átomo, de menor a mayor energía, es:
- 1s
- 2s
- 2p
- 3s
- 3p
- 4s
- 3d
- 4p
- Como consecuencia, todos los metales alcalinos (Li, Na, K, Rb, Cs, Fr) tienen propiedades similares, debido a que tienen configuraciones electrónicas similares [Noble] s 1
- Todos los metales alcalinotérreos (Be, Mg, Ca, Sr, Ba, Ra) tienen propiedades similares, ya que tienen configuraciones de electrones similares [Noble] s 2
Escriba configuraciones de electrones abreviadas para los siguientes elementos.
- hierro, Fe
- níquel, Ni
- mercurio, Hg
- plomo, Pb
- arsénico, As
- titanio, Ti
- Respuesta a:
-
hierro, Fe: [Ar] 4s 2 3d 6
- Respuesta b:
-
níquel, Ni: [Ar] 4s 2 3d 8
- Respuesta c:
-
mercurio, Hg: [Xe] 6s 2 4f 14 5d 10
- Respuesta d:
-
plomo, Pb: [Xe] 6s 2 4f 14 5d 10 6p 2
- Respuesta e:
-
arsénico, As: [Ar] 4s 2 3d 10 4p 3
- Respuesta f:
-
titanio, Ti: [Ar] 4s 2 3d 2
Complicaciones en metales de transición
Algunas variaciones sutiles se encuentran a través de los metales de transición. Llenar los orbitales d no es tan sencillo como los orbitales s y p. Por ejemplo, en la primera fila de los metales de transición, todos menos dos elementos tienen configuraciones [Ar] 4s 2 3d x. Sin embargo, el cromo tiene configuración [Ar] 4s 1 3d 5, y el cobre tiene configuración [Ar] 4s 1 3d 10. De igual manera, dos elementos en la tercera fila de los metales de transición no tienen la configuración [Xe] 6s 2 5d x. El platino tiene configuración [Xe] 6s 1 5d 9, y el oro tiene configuración [Xe] 6s 1 5d 10. Las cosas son aún peores en la segunda fila de metales de transición, en la que la mitad de los elementos no siguen el orden “correcto” de llenado. El niobio es [Kr] 5s 1 4d 4, el molibdeno es [Kr] 5s 1 4d 5, el rutenio es [Kr] 5s 1 4d 7, la plata es [Kr] 5s 1 4d 10, y el paladio no tiene electrones en absoluto en su capa exterior: es [Kr] 4d 10 .
Sc = [Ar] 4s 2 3d 1 y Ti = [Ar] 4s 2 3d 2 y V = [Ar] 4s 2 3d 3 pero Cr = [Ar] 4s 1 3d 5
¿Qué está pasando? La razón principal por la que las cosas son complicadas aquí es que los niveles 4s y 3d están bastante cerca uno del otro en energía (como son 5s y 4d, y 6s y 5d). Como resultado, ligeros cambios están haciendo que la configuración electrónica varíe de un elemento a otro. La energía de apareamiento es sin duda un culpable; esa es la cantidad de energía que cuesta poner dos electrones en un mismo orbital. Si la configuración electrónica es [Ar] 4s 2 3d x, entonces dos electrones siempre están siendo forzados a ocupar el mismo espacio, el orbital 4s. Eso cuesta energía, porque los electrones se repelen entre sí. La energía de emparejamiento cambia de un elemento a otro, pero para cuando alcanzamos el cromo, la energía de emparejamiento es evidentemente lo suficientemente alta (o la diferencia de energía entre los niveles 4s y 3d es lo suficientemente baja) como para que la energía sea menor si los electrones simplemente se propagan.
Entonces, hay que lograr un equilibrio entre la energía de emparejamiento y la energía orbital. Ambos están cambiando a medida que pasamos de un elemento al siguiente. A veces la energía de emparejamiento del orbital s es pequeña comparada con la energía que salta al orbital d, por lo que dos electrones entran en un orbital s. A veces la energía de emparejamiento del orbital s es grande en comparación con el salto de energía al orbital d, por lo que el electrón va en un orbital d. Por supuesto, la energía de emparejamiento de los orbitales d también juega un papel en algunos casos, y también varía de un elemento a otro.
Bueno, ¿qué se supone que tienes que hacer con esa información? Por lo general, se espera que conozcas la regla más general (como relleno como [Ar] 4s 2 3d x). Veintiuno de cada treinta metales de transición tienen dos electrones s y algún número de electrones d. A veces, se espera que conozcas las excepciones más comunes; esas son el cromo y el cobre (hay mucho más cromo y cobre en el mundo que niobio), y son relativamente fáciles de recordar porque una tiene una cáscara d medio llena y la otra tiene una cáscara d completamente llena.
- La mayoría de los metales de transición tienen dos electrones s y algunos electrones d.
- El cobre y el cromo tienen solo un electrón s; el otro es “promovido” a un orbital d.
- Puedes hacer un seguimiento de esas dos excepciones si recuerdas que el cobre tiene un electrón en cada orbital d y el cobre tiene un par de electrones en cada orbital d (“d medio llena” y “d llena” es una buena regla para recordar).
Una cosa más importante a saber es que estos casos describen solo los metales de transición en su estado elemental. No se aplican a compuestos, en los que el metal de transición se encuentra unido con átomos de diferentes tipos para formar sales u otros materiales. Los átomos en un pedazo de metal plateado tienen la configuración electrónica [Kr] 5s 1 4d 10, pero los átomos en un ion plata, que tienen un electrón menos, tienen configuración [Kr] 4d 10. El electrón faltante se pierde del orbital s, no del d. En general, los compuestos e iones de los metales de transición no tienen electrones s en las conchas de valencia. Por ejemplo, los átomos en molibdeno puro metal pueden tener configuración [Kr] 5s 1 4d 5, pero los átomos de molibdeno en los compuestos, si aún tienen todos sus electrones, tienen configuración [Kr] 4d 6.
- La mayoría de las veces, los metales de transición en iones y compuestos tienen solo d electrones en su caparazón de valencia.
¿Por qué serían diferentes los compuestos? La diferencia es más fácil de ver en el caso de los iones, en los que el metal pierde uno o más electrones. Debido a que ya no tiene la misma cantidad de electrones que los protones, se carga positivamente (tiene más protones positivos que electrones negativos). La carga positiva hace que los electrones se vuelvan más atraídos por el núcleo; ese átomo se contrae o se contrae.
Diferentes orbitales pueden tener diferentes respuestas a este cambio en el átomo metálico. Debido a que el orbital d está un nivel por debajo del orbital s de energía similar (es un orbital 3d, por ejemplo, comparado con un orbital 4s), está más cerca del núcleo. Se experimenta esa carga positiva con más fuerza y se contrae más que la órbita s. Como resultado, su energía se reduce aún más que la energía orbital por esta interacción electrostática más fuerte con el núcleo.
Como resultado de la carga cuando un átomo de metal de transición se convierte en un ion, el nivel 3d cae por debajo del nivel 4s. Recuerden, estos dos orbitales están muy cerca en energía para empezar, por lo que pequeños cambios pueden revertir su orden. De manera similar, el nivel 3d generalmente cae por debajo del nivel 4s cada vez que un metal de transición se une a otros átomos para formar parte de un compuesto.
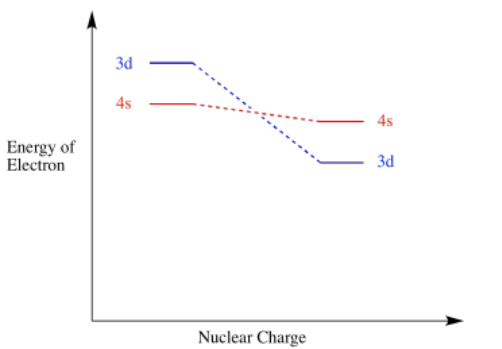
La forma en que los electrones 3d caen en energía al aumentar la carga es uno de los factores que complican las configuraciones de electrones de los metales de transición.
- En iones y compuestos, el orbital d es menor en energía que el orbital s del siguiente nivel, no al revés.
Dibuje un diagrama de llenado orbital (flechas y niveles de energía) para:
Recordatorio: Los diagramas de llenado para metales de transición e iones/complejos de metales de transición difieren.
A. Ni
B. Co +2
C. Fe +3
D. Ti +4
E. V
F. Co
G. Mn +2
H. Zn +2
I. Zn
- Contestar
-
Toques Finales
Anteriormente, vimos que los electrones tienden a entrar en orbitales sin llenar antes de emparejarse en el mismo, siempre que otros orbitales estén disponibles al mismo nivel de energía.
Esta idea es parte de la regla de Hund. La regla de Hund dice, en parte, que si tienes dos electrones, y hay dos orbitales disponibles al mismo nivel de energía, entonces un electrón entrará en cada orbital. En parte se trata de evitar la repulsión electrón-electrón que ocurriría si pones dos electrones en el mismo orbital —es decir, en la misma región exacta del espacio.
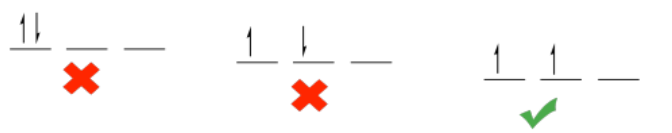
Sin embargo, en parte es otra cosa, y eso es un sesgo mecánico cuántico hacia una alta multiplicidad. Multiplicidad se refiere al número de electrones desapareados que hay en un átomo o molécula. Por emparejado, nos referimos a dos electrones que tienen giro opuesto. Recuerde, el espín es una propiedad mecánica cuántica fundamental de un electrón. Sólo puede tener dos valores, y los valores numéricos parecen arbitrarios pero es importante saber que las dos opciones posibles son números opuestos: pueden ser +1/2 o -1/2. Los electrones desapareados serían aquellos que no tienen pareja en alguna parte con un valor de giro opuesto.
Para ilustrar esa idea, considere el siguiente dibujo. Muestra tres formas diferentes en que un conjunto de cinco electrones podría llenar un grupo de cinco orbitales (tal vez el nivel 3d; supongamos que estos son los electrones de valencia en un átomo de vanadio). A menudo, los electrones en los diagramas orbitales se indican con flechas, con la dirección de la flecha indicando el giro. Una flecha hacia arriba significa giro = 1/2; una flecha hacia abajo significa giro = -1/2.
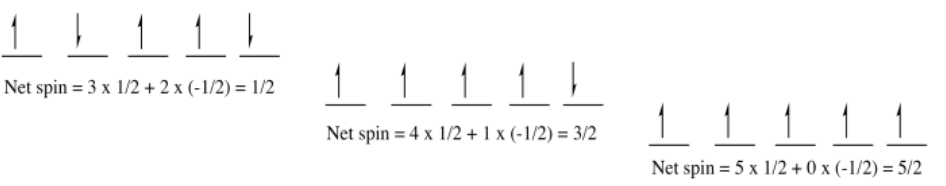
En dos casos, algunos de los electrones están emparejados; tienen un compañero en algún lugar con giro opuesto. La multiplicidad es básicamente un recuento de cuántos electrones desapareados quedan; se obtiene la multiplicidad sumando el valor de giro de todos los electrones. Un caso tiene todos los electrones desapareados. Todos los electrones tienen el mismo giro. La multiplicidad se maximiza en este caso. La regla de Hund dice que este caso tiene la energía más baja.
¿Y si dos electrones ocupan el mismo orbital? Aún podríamos maximizar la multiplicidad manteniendo sus giros “paralelos”; es decir, ambos podrían tener spin = 1/2 o ambos spin = -1/2. Eso no sucede, sin embargo. Recuerde la regla cuántica de que no se pueden describir dos electrones en un mismo átomo por el mismo conjunto de números cuánticos. En otras palabras, cada electrón sobre el átomo debe tener una identidad única. Esta regla también tiene nombre: el principio de exclusión Pauli.
- Los electrones siempre ocupan el orbital de menor energía disponible.
- Se maximiza la multiplicidad; a los electrones se les dan los mismos giros cuando es posible.
- Sin embargo, cuando se encuentran en el mismo orbital, dos electrones deben tener espín opuesto.

