4.3: Estructuras de Lewis y unión múltiple
- Page ID
- 80584
Los Fundamentos
Repasemos algunas de las cosas principales que debes considerar si quieres dibujar estructuras de Lewis. Las estructuras de Lewis serán la principal forma en que comunique ideas sobre moléculas en este curso, por lo que es mejor practicar con ellas lo antes posible.
Esto es lo que debes hacer:
- contar los electrones de valencia en los átomos que se unirán entre sí.
- colocar los átomos uno al lado del otro en papel.
- organizar los electrones dados alrededor de los átomos para que cada átomo tenga un octeto.
- estos electrones pueden ser compartidos entre los átomos (estos se llaman pares de enlace) o mantenidos por un átomo u otro (estos se llaman pares no enlazantes o “pares solitarios”)
Ocasionalmente, necesitarás compartir más de un par de electrones entre dos átomos para que todos los átomos puedan obtener un octeto. Eso es lo que sucede en la estructura del monóxido de carbono, el CO.
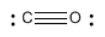
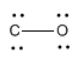
El carbono tiene 4 electrones de valencia y el oxígeno tiene 6, para un total de 10 electrones. Eso son 5 pares. Si el carbono y el oxígeno comparten un par de electrones, quedarán cuatro pares. Podrías poner tres pares en el oxígeno y un par en el carbono. El oxígeno tiene cuatro pares, incluyendo el par solitario y los pares compartidos. El carbono solo tiene dos pares. Eso no es un octeto, y si es posible la molécula evitará esa situación.
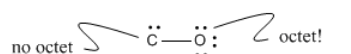
Podría haber un enlace, y dos pares solitarios en cada átomo. Eso no es mucho mejor. Ahora ninguno de los átomos tiene octeto.

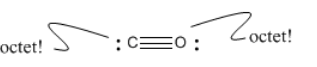
Eso significa que solo podemos tener tres enlaces entre el carbono y el oxígeno, un total de seis electrones. Los otros cuatro electrones podrían convertirse en pares solitarios, uno sobre carbono y otro en oxígeno. Ahora ambos átomos tienen un octeto.

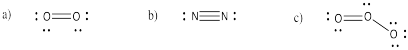
Intente dibujar estructuras de Lewis para las siguientes moléculas:
a) O 2 b) N 2 c) O 3
- Contestar
-
Consecuencias de la unión múltiple: distancias de unión
¿Realmente hay tres enlaces entre el carbono y el oxígeno en el monóxido de carbono? ¿Cómo podríamos decirlo?
Los vínculos múltiples tienen consecuencias importantes. Un enlace es un par de electrones compartidos por dos átomos. Dado que ambos átomos necesitan el par de electrones para completar un octeto, los átomos deben permanecer cerca del par de electrones y cerca uno del otro para ser estables. De ahí que un enlace sea también una fuerza atractiva entre los átomos. Esa idea significa que los enlaces adicionales entre dos átomos conducen a una atracción adicional entre los átomos. Dos átomos con múltiples enlaces deben estar más estrechamente unidos entre sí que dos átomos con menos enlaces.
- un doble enlace entre dos átomos es más corto que un enlace sencillo entre los mismos dos átomos
- un triple enlace entre dos átomos es más corto que un doble enlace entre los mismos dos átomos
- un enlace cuádruple entre dos átomos es más corto que un triple enlace entre los mismos dos átomos
Los datos experimentales sugieren que esto es cierto. La espectroscopia de microondas es una técnica que se puede utilizar para medir distancias de enlace (la distancia de un átomo al siguiente) en moléculas en la fase gaseosa. Los datos sobre monóxido de carbono indican que la distancia C-O es de aproximadamente 1.13 A (1 A = 10 -10 m). En dióxido de carbono, CO 2, la distancia es de 1.16 A. La distancia más corta en monóxido de carbono sugiere que el carbono y el oxígeno se mantienen un poco más unidos que en el dióxido de carbono, en el que la estructura de Lewis muestra solo un doble enlace.
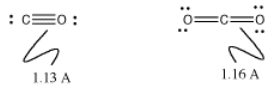
El enlace adicional entre un par de átomos a menudo se llama enlace pi (pronuncia enlace “pie”). El primer enlace entre un par de átomos a veces se llama enlace sigma. El monóxido de carbono tiene un enlace sigma y dos enlaces pi.
Dibujar estructuras para las siguientes moléculas e iones.
a) NO + b) C 2 2 - c) PN
- Contestar
-
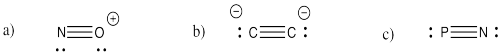
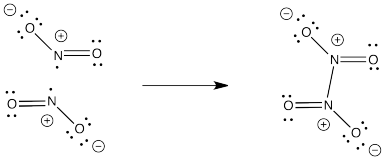
NO 2 es un gas marrón (connectength O-N-O) que proviene de los escapes de automóviles. Es en parte responsable del smog en las grandes ciudades. NO 2 dimeriza a baja temperatura para formar N 2 O 4, un gas incoloro. La dimerización se refiere a dos moléculas que se unen para formar una estructura más grande. Mostrar por qué ocurre este fenómeno con el NO 2, con la ayuda de estructuras.
- Contestar
-
¿Esperas que el anión NO 2 - dimerize? Explique.

