4.4: Estructuras de Lewis y Moléculas Poliatómicas
- Page ID
- 80577
Conectividad
Pensar en cómo se disponen los átomos y los electrones en una molécula se vuelve más difícil cuando hay más de dos átomos. A menudo es necesario decidir cómo están dispuestos los átomos antes de escribir la estructura de Lewis.
Dibujemos la estructura para el ácido carbónico, H 2 CO 3. Primero necesitamos saber qué átomos están conectados entre sí. Eso nos dirá qué átomos están compartiendo electrones.
Podríamos poner un átomo en medio de la estructura y disponer a todos los demás a su alrededor. Eso puede funcionar a veces, pero muchas veces le da al átomo central demasiados enlaces. Un átomo de segunda fila no puede tener más de ocho electrones en su caparazón de valencia. En consecuencia, un carbono no puede tener más de cuatro enlaces, porque no hay espacio para más electrones.
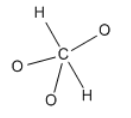
Podríamos tratar de unir todos los átomos en una cadena. Largas cadenas de átomos como esta no son muy comunes. Puede haber varias razones por las que este tipo de arreglo no es muy estable. Primero, cuando consideremos la carga formal un poco más tarde, verá que colocar todos los átomos en una fila puede provocar una separación innecesaria de carga. Segundo, algunos átomos como el oxígeno no son muy estables cuando están unidos a otros átomos del mismo tipo. La repulsión entre pares solitarios puede contribuir a esta inestabilidad. Debido a que el carbono a menudo no tiene pares solitarios, es una excepción y puede unirse consigo mismo.
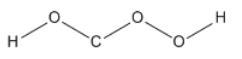
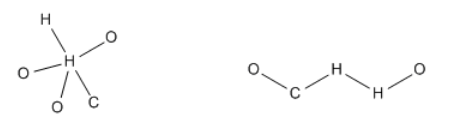
Tenga en cuenta que cuando tratamos de organizar los átomos de cualquier manera, probablemente evitaríamos poner un hidrógeno en el medio. Eso es porque el octeto del hidrógeno es solo dos electrones, por lo que generalmente solo puede hacer un enlace. Conocer el número de enlaces que suelen formar otros átomos también puede ser útil.
Valence
La valencia es el número de enlaces que suele formar un elemento -por ejemplo, la valencia del carbono es cuatro, el nitrógeno es tres, el oxígeno es dos, el flúor y el hidrógeno son uno. La valencia suele corresponder al número de electrones necesarios para formar un octeto. Sin embargo, hay excepciones: el boro necesitaría 5 electrones para formar un octeto, pero como solo tiene tres electrones para compartir, solo puede formar tres enlaces covalentes.
Cuadro Valencias\(\PageIndex{1}\) típicas (número de enlaces formados) para varios átomos de la segunda fila.
| átomo | B | C | N | O | F |
|---|---|---|---|---|---|
| valencia | 3 | 4 | 3 | 2 | 1 |
Tener en mente la valencia puede ayudar a las estructuras de Lewis a ir más fácilmente. En el caso del ácido carbónico, el carbono podría ir en el medio, ya que debe formar la mayor cantidad de enlaces para obtener un octeto. Además, tener dos de los oxígenos conectados a hidrógenos así como al carbono les ayuda a alcanzar su valencia normal también.
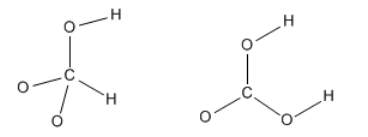
Una vez que se ha llenado la conectividad, tenemos una estructura esquelética del compuesto. Ahora solo necesitamos rellenar los electrones extra. Seis de cada oxígeno son 18; cuatro de carbono hacen 22; uno de cada hidrógeno hace 24 electrones totales.
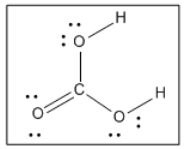
Llegar a una estructura de Lewis requiere una serie de pasos, pero por lo general sigue un patrón familiar.
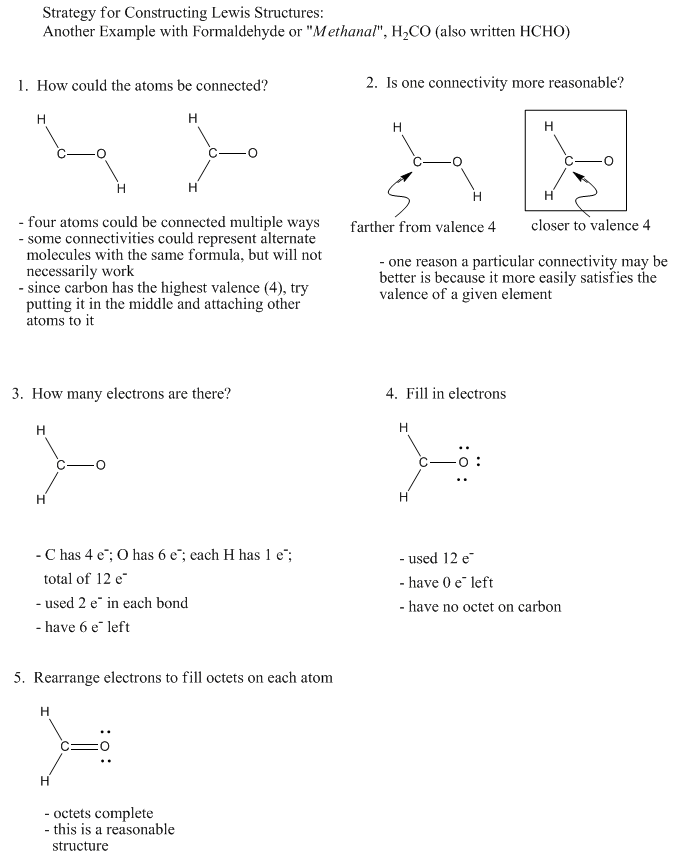
Utilice la idea de valencia para construir estructuras de Lewis de los siguientes compuestos:
a) hidroxilamina, H 3 NO b) eteno, C 2 H 4 c) etano, C 2 H 6
- Contestar
-
Los elementos de la tercera fila de la tabla periódica a menudo se comportan de manera similar a los elementos de la segunda fila. Utilice la idea de valencia para construir estructuras de Lewis de los siguientes compuestos:
a) PH 3 b) CS 2 c) SiH 4 d) PCl 3
- Contestar
-
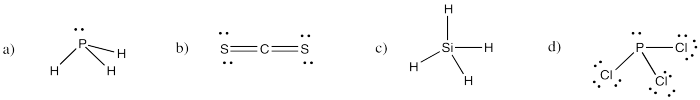
A veces habrá más de una forma “correcta” de dibujar una estructura de Lewis para un conjunto dado de átomos. A modo de ejemplo, hay dos estructuras diferentes en la naturaleza con la fórmula C 2 H 6 O. Estos compuestos, el éter metílico y el etanol, se denominan isómeros, es decir, se forman a partir de las mismas (iso) cosas (mer).
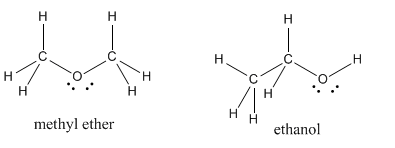
Para ayudar a distinguir entre isómeros, las fórmulas a veces se escriben con abreviaturas estructurales. En lugar de escribir C 2 H 6 O para ambos compuestos, escribiríamos CH 3 OCH 3 para éter metílico, sugiriendo que el primer carbono está conectado a tres hidrógenos y un oxígeno, el oxígeno está conectado al segundo carbono, y el segundo carbono está conectado a otro tres hidrógenos.
De manera similar, el etanol se abreviaría como CH 3 CH 2 OH.
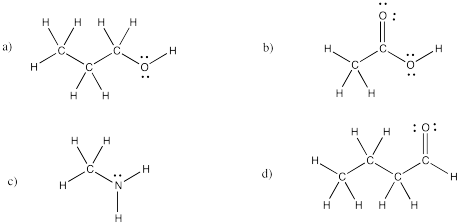
Dibuje estructuras de Lewis o Kekule para los siguientes compuestos:
a) propanol, CH 3 CH 2 CH 2 OH b) ácido acético (o ácido etanoico), CH 3 CO 2 H
c) metilamina, CH 3 NH 2 d) butanal, CH 3 CH 2 CH 2 CHO
- Contestar
-
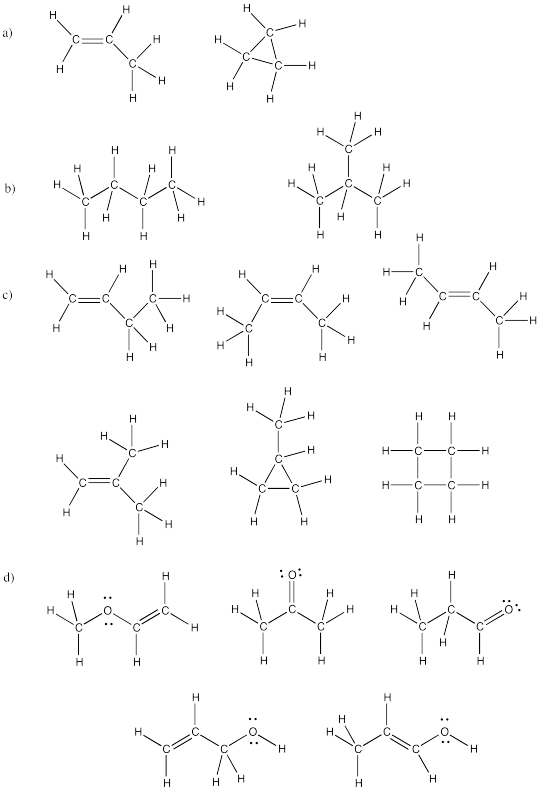
Dibuje al menos dos isómeros para cada una de las siguientes fórmulas:
a) C 3 H 6 b) C 4 H 10 c) C 4 H 8 d) C 3 H 6 O
- Contestar
-
En ocasiones, la decisión sobre la conectividad implica factores adicionales, distintos a la valencia. Aquí hay un conjunto más detallado de instrucciones:
Pasos para adivinar la conectividad
SI no se proporciona la conectividad y necesita dibujar una estructura de Lewis,
A. El primer átomo enumerado en la fórmula suele estar en el centro de la estructura.
B. La mayoría de las estructuras simples, especialmente para especies inorgánicas, tienen un átomo en el medio con varios átomos conectados y ramificados desde este central (a diferencia de una cadena lineal de átomos). Por lo tanto, elige el átomo medio para ser
1. El átomo en la fila más baja de la tabla periódica (lo más probable es que pueda usar d orbitales para formar más de 2 enlaces según sea necesario para estructuras de “ramificación”)
2. El átomo más en el centro de la tabla periódica (grupo 4, luego 3 o 5, etc) -tiene mayor valencia (valencia = número de enlaces formados)
3. El átomo menos EN suele estar en el medio.
C. Muchas estructuras simples son simétricas. ¡Esto no es una ley de la naturaleza sino una simple observación!
X-M-X a menudo favorecido sobre X-X-M
D. Los oxiácidos suelen tener H en O; por ejemplo, HClO 4 tiene la conectividad H-O-ciclo 3. El cloro está unido a cuatro átomos de oxígeno diferentes, pero un átomo de oxígeno también está unido a un hidrógeno.
E. Evite los anillos de tres y cuatro miembros, no son comunes, especialmente entre las especies inorgánicas.
F. Evitar enlaces entre átomos electronegativos (F-F, O-O, O-F, etc.). Tales enlaces son débiles y tienden a hacer que las moléculas sean inestables, si no inexistentes. Obviamente la situación no se puede evitar en moléculas como O 2, DE 2, F 2, etc.
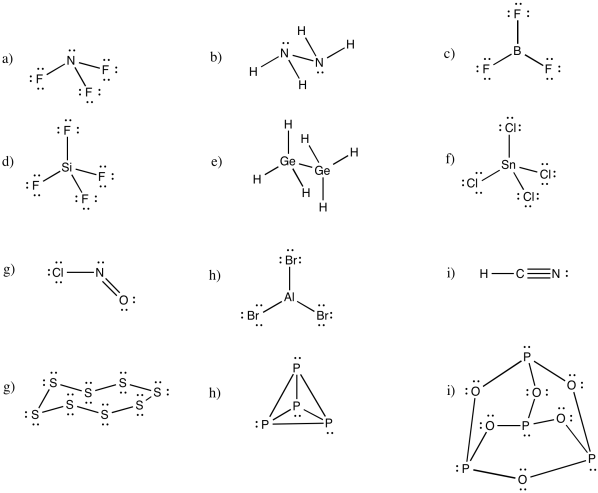
Proporcionar estructuras para los siguientes compuestos. Recuerda pensar en valencias comunes.
a) NF 3 b) N 2 H 4 c) BF 3
d) SiF 4 e) Ge 2 H 6 f) SnCl 4
g) ClnO h) AlBr 3 i) HCN
j) S 8 k) P 4 l) P 4 O 6
- Contestar
-