4.10: Otras geometrías
- Page ID
- 80569
Anteriormente, observamos algunas geometrías comunes de átomos de carbono en las moléculas. El carbono suele tener cuatro átomos vecinos en la molécula, y en ese caso es tetraédrico. Sin embargo, a veces solo hay dos o tres átomos vecinos, por lo que las geometrías planas lineales o trigonales también son bastante comunes.
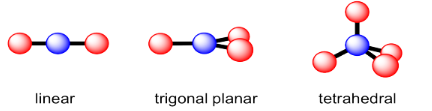
Estas geometrías se encuentran a lo largo de la tabla periódica para átomos que tienen 2, 3 o 4 átomos vecinos dentro de una molécula. Sin embargo, también hay algunas otras geometrías moleculares que son bastante comunes.
Anteriormente, miramos los ambientes de átomos o iones dentro de estructuras sólidas y consideramos el “número de coordinación” del átomo o ion. Recuerde, el número de coordinación es solo el número de átomos en estrecho contacto con un átomo central. Podemos pensar en la geometría alrededor de un átomo particular en una molécula de la misma manera.
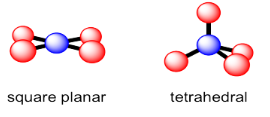
Coordinación número 4
En realidad hay dos opciones geométricas diferentes que ocurren con cierta regularidad para la coordinación número 4. La geometría tetraédrica, que hemos visto, maximiza las distancias entre vecinos. Eso podría ser ventajoso porque minimiza el hacinamiento. De hecho, la geometría tetraédrica es la geometría más común para el número de coordinación tjis. Sin embargo, una segunda geometría está disponible para un número limitado de compuestos. En geometría plana cuadrada, los cuatro vecinos se encuentran en el mismo plano y están separados aproximadamente 90 grados entre sí. Esta geometría se observa con mayor frecuencia para ciertos compuestos de paladio y platino, así como algunos otros metales de transición.
Coordinación número 5
En el caso de cinco átomos vecinos, hay dos geometrías que son aproximadamente igualmente prevalentes. En una estructura bipiramidal trigonal, el átomo central está rodeado por tres vecinos que forman un plano trigonal a su alrededor. Los dos últimos vecinos están por encima y por debajo de este avión. Estos dos vecinos son aproximadamente colineales con el átomo central. Las posiciones planas trigonales se denominan “ecuatoriales”; las otras dos posiciones se denominan “axiales”.
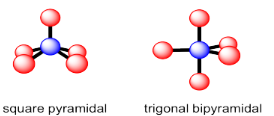
La otra geometría común de cinco coordenadas es piramidal cuadrada. En este caso, el átomo central se asienta sobre una base de cuatro vecinos; esas cuatro posiciones forman un plano cuadrado juntas. Un quinto átomo ocupa el espacio por encima del átomo central.
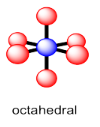
Coordinación número 6
Casi todos los ejemplos de átomos con coordinación número seis pueden describirse como que tienen una geometría octaédrica. Cuatro de los vecinos forman un plano cuadrado alrededor del átomo central, con un átomo por encima de este plano y otro debajo de él. Al igual que con la bipirámide trigonal, estas posiciones pueden describirse como ecuatoriales y axiales, respectivamente.
Geometría electrónica vs. molecular
Existe una notable diferencia entre las geometrías alrededor de los metales de transición, en el centro de la tabla periódica, en comparación con los elementos del bloque p del grupo principal, en la parte derecha de la tabla periódica. La geometría alrededor de un metal de transición se basa simplemente en el número de átomos unidos a él. Cada átomo circundante ocupa algo de espacio y por lo tanto se adopta una geometría para dar a esos átomos aproximadamente el mismo espacio alrededor del átomo central.
En el bloque p, las cosas son generalmente bastante diferentes. No son solo los átomos vecinos los que ocupan el espacio; los electrones de valencia en el átomo central también tienen que ser acomodados. Así, en amoníaco, NH 3, necesitamos considerar no solo los tres átomos de hidrógeno que están unidos al nitrógeno, sino también el propio par solitario del nitrógeno, para determinar la geometría. Eso son cuatro objetos para caber alrededor del átomo de nitrógeno. La geometría normal para cuatro cosas es tetraédrica. Así, el amoníaco adquiere una forma tetraédrica. No es plano trigonal.
A eso se le llama a veces la geometría electrónica general. Es la geometría de todo, incluidos los electrones de par solitario. Para ver la relación entre los átomos —el nitrógeno y sus tres hidrógenos de la oscuridad— simplemente ignore el par de electrones por un minuto. El nitrógeno se asienta sobre una base trigonal de tres átomos de hidrógeno. La geometría molecular —esa forma formada por el nitrógeno y los tres hidrógenos— es piramidal.
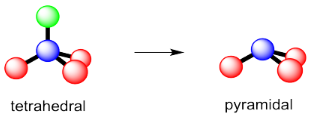
Este fenómeno, en el que la relación geométrica entre los átomos está influenciada por dónde están los electrones en un átomo central, es bastante común alrededor de calcógenos y pnictógenos —es decir, el oxígeno y los demás átomos en su columna de la tabla periódica, así como el nitrógeno y los demás átomos de su grupo. En esos casos, los pares solitarios parecen forzar a los átomos circundantes un poco más cerca entre sí.
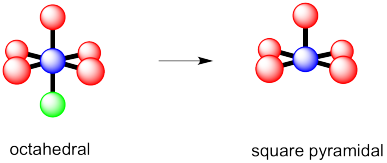
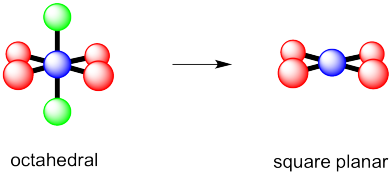
Supongamos que un compuesto tenía un átomo central rodeado por seis grupos, incluyendo enlaces a otros átomos así como sus propios pares solitarios.
- ¿Cuál es su geometría general “electrónica”?
- ¿Cuál sería su geometría molecular si tuviera un par solitario?
- ¿Cuál sería su geometría molecular si tuviera dos pares solitarios?
- Responder a
-
octaédrico
- Respuesta b
-
- Respuesta c
-
Supongamos que un compuesto tenía un átomo central rodeado por cinco grupos, incluyendo enlaces a otros átomos así como sus propios pares solitarios.
- ¿Cuál es su geometría general “electrónica”?
- ¿Cuál sería su geometría molecular si tuviera un par solitario?
- ¿Cuál sería su geometría molecular si tuviera dos pares solitarios?
- Responder a
-
bipiramidal trigonal
- Respuesta b
-
Esta vez podría haber dos respuestas distintas.
Si el par solitario ocupa una de las posiciones axiales, estaría bastante cerca de otros tres átomos.
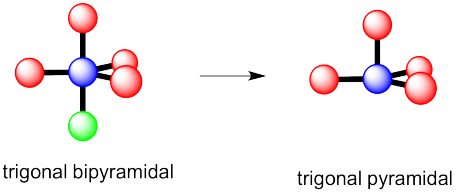
Si el par solitario ocupa una de las posiciones ecuatoriales, estaría bastante cerca de sólo otros dos átomos. Los otros átomos ecuatoriales están bastante lejos.

Ejercicio 4.10.2, respuesta a b, mostrando eliminación del grupo lateral de densidad electrónica para formar una disposición diferente a la anterior. La regla es que la pareja solitaria va en la posición menos abarrotada, por lo que esta molécula tendría forma de sierra.
- Respuesta c
-
Nuevamente, hay dos geometrías posibles. Uno de ellos sería plano trigonal, una geometría bastante común.
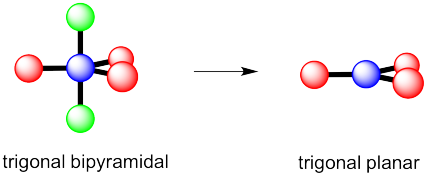
Ejercicio 4.10.2, respuesta a c, mostrando la eliminación de los dos grupos verticales para formar otro arreglo. No obstante, eso coloca a las parejas solistas en las posiciones más abarrotadas. En cambio, la molécula va a tener forma de T.
Ejercicio 4.10.2, respuesta a c, mostrando la eliminación de los dos grupos horizontales para formar una disposición diferente a la anterior.
Dibujar estructuras para los siguientes compuestos.
a) H 2 O b) (CH 3) 3 O + c) PCl 3 d) SF 4 e) CLf 3 f) PCl 5
g) SF 6 h) CLf 5 i) xeF 4
- Responder
-
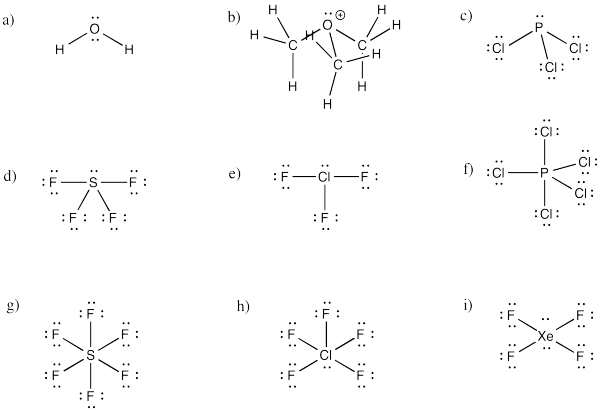
¿Cuál es la geometría molecular de cada uno de los compuestos en problema Ejercicio\(\PageIndex{3}\)?
- Responder a
-
doblado
- Respuesta b
-
piramidal en O, aunque tetraédrico en C
- Respuesta c
-
piramidal
- Respuesta d
-
sierras
- Respuesta e
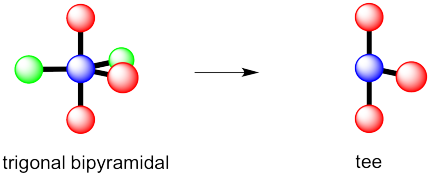
-
tee
- Respuesta f
-
bipiramidal trigonal
- Respuesta g
-
octaédrico
- Respuesta h
-
cuadrado piramidal
- Respuesta i
-
plano cuadrado
Algunas geometrías comunes se resumen en la siguiente tabla.
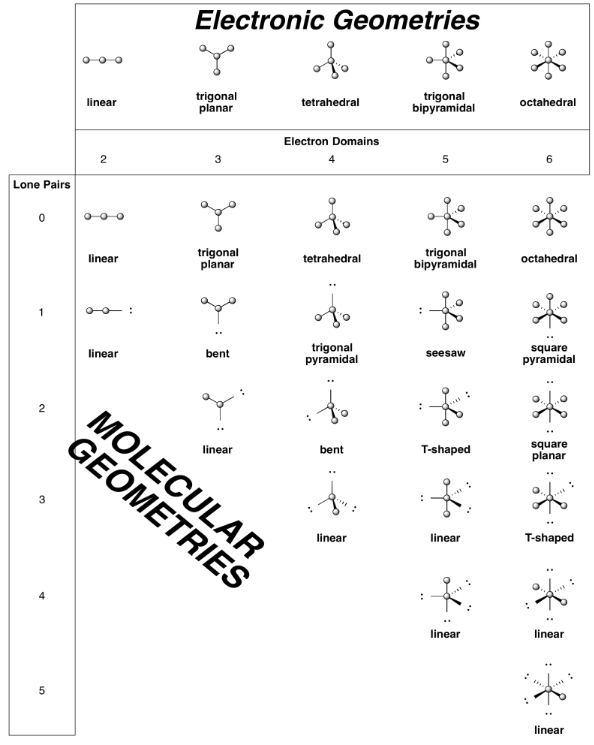
En los casos en que la geometría molecular es diferente de la geometría electrónica, a veces necesitamos tomar decisiones sobre qué posición es más probable que ocupe un par solitario. La regla general es que las parejas solitarios ocupan el sitio menos concurrido. Es como si el par solitario ocupara más espacio que un enlace a un átomo. Eso puede parecer sorprendente, porque deja los átomos de la molécula abarrotados juntos. Aunque estos casos no son muy comunes, se observan en una serie de compuestos del bloque p. Algunos ejemplos se resumen en la siguiente tabla.

Dibujar estructuras para los siguientes compuestos.
a) iBr b) iCl 3 c) ClF 5 d) BrF 3 e) SeF 4 f) IOF 3 g) ArF 4
- Responder
-
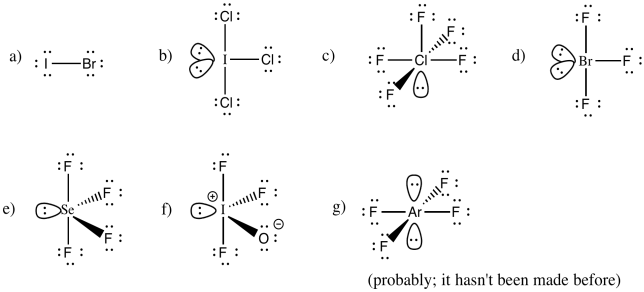
Respuestas al Ejercicio 4.10.5, de la a a la g. Debajo de g se encuentra la nota “(probablemente; no se ha hecho antes)”.
Ocasionalmente, los átomos pueden tener un número aún mayor de enlaces del que hemos visto hasta ahora. Predecir una geometría razonable para heptafluoruro de yodo, IF 7.
- Responder
-
Es posible que puedas imaginar algunas otras posibilidades para este número de vecinos, pero IF 7 adopta una forma bipiramidal pentagonal.

