4.11: Estructuras polémicas de Lewis
- Page ID
- 80563
A veces hay controversia en la ciencia. El argumento puede ser una parte importante de cómo llegamos a una mejor comprensión de las cosas. En el contexto de las moléculas y estructuras, ha habido controversias de larga duración sobre cómo dibujar ciertos compuestos de fósforo y azufre. Una mirada a esa controversia puede decirnos algunas cosas sobre cómo piensan los diferentes químicos sobre la vinculación.
La polémica se refiere a cómo dibujar, y pensar en, la unión en una serie de compuestos de azufre y fósforo “alto-valentes”, en los que el átomo de azufre o fósforo está unido a más que el número habitual de vecinos.
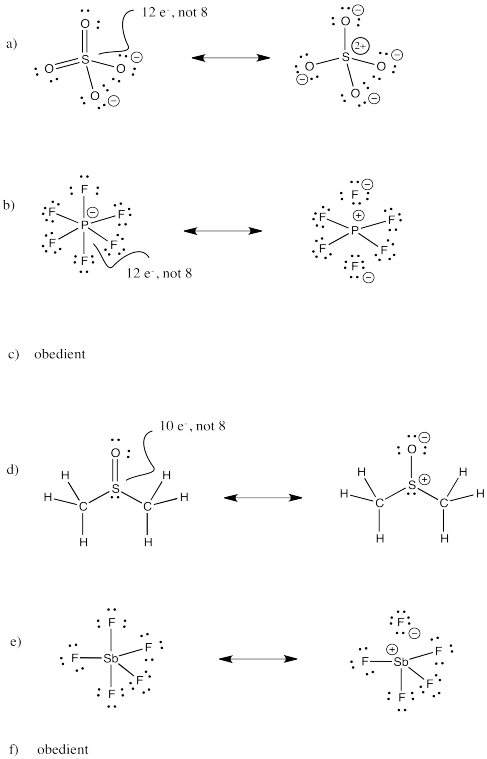
El ion sulfato, SO 4 2 -, es un ejemplo de un compuesto de azufre de alta valencia. El azufre, al igual que el oxígeno, frecuentemente forma dos enlaces. En sulfato, el azufre está unido a cuatro átomos diferentes.
Podríamos dibujar esa estructura de dos maneras. Una estructura que obedezca a la regla del octeto tendría un enlace sencillo a cada oxígeno. Eso satisfacería el octeto de azufre. Para rellenar el número correcto de electrones para este grupo de átomos, cada oxígeno tendrá una carga formal negativa. El azufre tendrá una carga de más dos.
Una forma diferente de dibujar la estructura incluiría dobles enlaces entre el azufre y dos de los átomos de oxígeno. Esa estructura tendría menos separación de carga que la otra estructura. Sin embargo, el azufre tendría doce electrones en su caparazón de valencia, no ocho. Superaría su octeto.
¿Puede un átomo tener más de ocho electrones en su caparazón de valencia? Muchos de ellos pueden, si están más abajo en la tabla periódica. Si el azufre y el fósforo pueden es mucho menos claro. Frecuentemente, el hecho de que estos sean átomos de la 3ª fila se considera significativo. Después de todo, los d electrones comienzan en la tercera fila. Quizás el azufre y el fósforo puedan acomodar electrones adicionales porque tienen d orbitales. Los orbitales d no tienen electrones en ellos, sin embargo, así que tal vez puedan aceptar algunos de otros aroms a través de enlaces.
Muchos químicos teóricos (entre ellos expertos en química de azufre y fósforo) están convencidos de que este escenario simplemente no es posible. El nivel d en estos átomos es simplemente demasiado alto en energía. Otros átomos no pueden posiblemente donar electrones al azufre y al fósforo de esta manera.
Y, sin embargo, muchos químicos (incluidos los expertos en química de azufre y fósforo) todavía extraen sulfato con dobles enlaces. ¿Por qué cometerían tal error ante la razón?
En parte, tiene que ver con evidencias experimentales. Recuerde, “experimental” suena descabellado y tentativo para los no científicos, pero para un químico el término realmente significa “basado en la realidad”. Una de las razones por las que la gente dibuja dobles enlaces en muchos compuestos de azufre y fósforo es que los enlaces simplemente se comportan como dobles enlaces. Es decir, son más fuertes y más cortos que los bonos simples. Tal vez no pensemos en esos enlaces exactamente de la manera en que pensamos sobre los dobles enlaces en otras situaciones, pero la evidencia experimental dice que hay alguna atracción adicional entre los átomos de azufre y oxígeno en estos casos.
Existe evidencia adicional de que el azufre y el fósforo pueden “superar el octeto” o formar estructuras “desobedientes de Lewis”. Los compuestos como el pentafluoruro de fósforo (PF 5) requieren claramente más de cuatro enlaces al azufre. Sin cinco enlaces, necesitaríamos dibujar uno de los fluoruros como anión. Ciertamente es posible que esta sea la verdadera estructura, pero hay evidencia de la cristalografía de rayos X de que todos los fluorinos están unidos al fósforo en PF 5, así como en el anión PF 6 relacionado (hexafluorofosfato, un ion molecular muy común en los rayos X estudios cristalográficos).
Entonces, el azufre y el fósforo realmente pueden formar enlaces adicionales. La única controversia verdadera sobre la regla del octeto en la química del azufre y el fósforo es un poco demasiado sutil para explorarla muy profundamente en este punto: es si el azufre puede formar un doble enlace en estos casos. El tema tiene que ver con ideas de la teoría orbital molecular, que es un capítulo posterior, y qué tan bien los orbitales d pueden formar “enlaces pi” con el orbital p sobre el oxígeno.
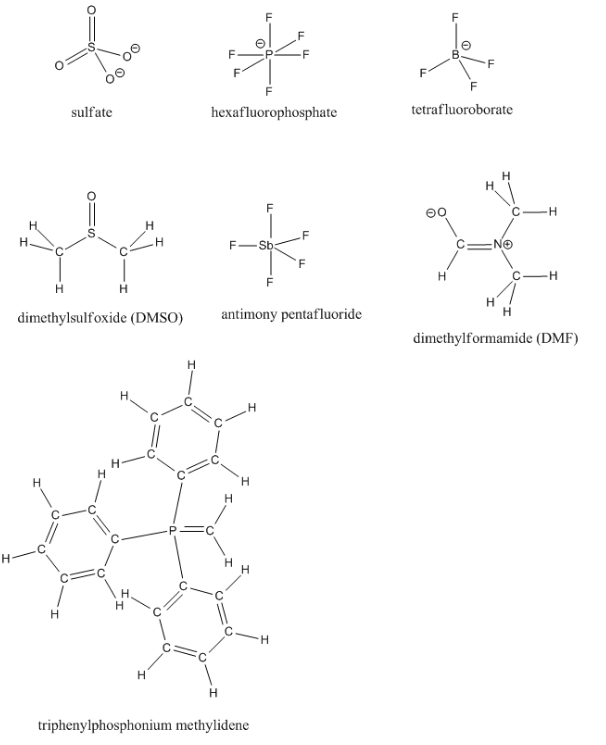
Rellene los pares solitarios faltantes en las siguientes estructuras.
- Responder
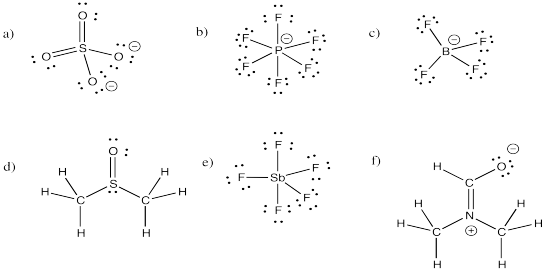
Indicar si cada una de las estructuras en el Ejercicio\(\PageIndex{1}\) (IM11.1) obedece a la regla del octeto. Si no, proporcionar una estructura de resonancia que obedezca a la regla del octeto.
- Responder
-