4.13: Biomoléculas comunes
- Page ID
- 80568
Hemos visto una serie de “grupos funcionales” comunes de la química orgánica. Los grupos funcionales son solo colecciones de átomos que vemos frecuentemente, por lo que resulta útil reconocerlos. Los compuestos orgánicos, por definición, son compuestos a base de carbono, generalmente derivados de seres vivos. Sin embargo, hay algunas clases específicas de moléculas orgánicas que son tan comunes en biología que se denominan “biomoléculas”. Aquí les vamos a echar un vistazo.
Un grupo común de biomoléculas se llama “lípidos”. Los lípidos realmente pueden tener muchas estructuras diferentes. Sin embargo, el tipo de lípido más común es un éster. Un éster contiene una unidad O-C=O. A veces ese grupo se denomina “enlace éster”. Podemos pensar en ese vínculo como que se forma cuando un ácido carboxílico se junta con un alcohol. El ácido carboxílico se muestra a continuación, en rojo; el alcohol está en azul.

Este ácido carboxílico es un tipo particular llamado ácido graso. Tiene una larga cadena de carbono. Cuando el oxígeno del alcohol se conecta al carbono carbonilo en el ácido graso, el ácido graso pierde su grupo OH. El alcohol también pierde el hidrógeno, o protón, de su grupo OH. Esa combinación de cosas perdidas, H + OH, suma a una molécula de agua. Entonces, cada vez que un ácido graso se combina con una molécula de alcohol para formar un enlace éster, se elabora una molécula de agua.
Esa formación de una molécula de agua dio lugar a un nombre antiguo para esta reacción y otras similares. Se le llamó reacción de condensación. Ese término, “condensación”, se refería al agua o humedad que se formó durante la reacción, como la condensación en el espejo del baño cuando te das una ducha.
En realidad, exactamente cómo estas dos moléculas se unen para formar una molécula es un poco más complicado que lo que estamos viendo aquí. En este punto, sin embargo, esto es todo lo que necesitas saber.
El tipo de lípido más común en biología es un tipo específico de éster llamado “glicérido”. Se forma un glicerido entre un acido graso y una unidad de glicerol. La unidad de glicerol, en azul, tiene tres grupos hidroxi (la parte OH). Estos grupos hidroxi son capaces cada uno de ellos de unirse al carbono carbonilo en un ácido graso.
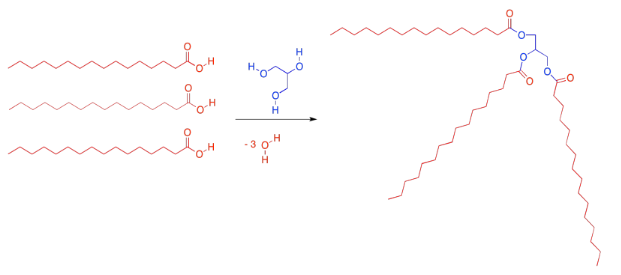
Cuando el oxígeno del glicerol se conecta al carbono carbonilo en el ácido graso, el ácido graso pierde su grupo OH, y se pierde un protón del glicerol. Por lo que cada vez que un ácido graso se combina con una molécula de glicerol, se elabora una molécula de agua, además del lípido. Eso son tres moléculas de agua perdidas, en total, del glicerol y los ácidos grasos originales.
Los enlaces éster son importantes en parte porque son reversibles. Los ácidos grasos pueden almacenarse convenientemente como glicéridos uniéndolos a glicerol con enlaces éster. Sin embargo, los enlaces éster pueden romperse de nuevo si se agrega agua. Los triglicéridos pueden volver a ser glicerol y ácidos grasos nuevamente. Esos ácidos grasos pueden ser utilizados como combustible para las celdas. La formación y ruptura de enlaces éster permite controlar estos procesos, dependiendo de si se necesita energía en este momento o se debe almacenar para más adelante.
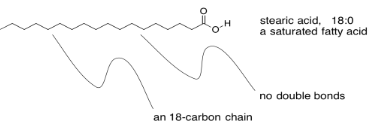
Por cierto, hay una variedad de ácidos grasos que pueden formar triglicéridos, lo que lleva a una diversidad de lípidos con propiedades ligeramente diferentes. Existen ácidos grasos que contienen cadenas carbonadas de diversas longitudes. Hay ácidos grasos con uno, dos o tres dobles enlaces C=C en algún lugar de sus cadenas, y otros sin ninguno. A los que no tienen dobles enlaces se les llama ácidos grasos saturados. Las grasas saturadas a veces se describen mediante una notación taquigráfica que indica la longitud de la cadena, seguida de dos puntos, seguida de un cero, lo que indica que no hay dobles enlaces C=C.
Las grasas insaturadas a veces se describen usando una notación taquigráfica similar, pero con un número después del colon que indica cuántos dobles enlaces están presentes. A eso le sigue el símbolo Δ, la letra griega delta, con un número supercsript que indica qué tan lejos está el doble enlace del final de la cadena.
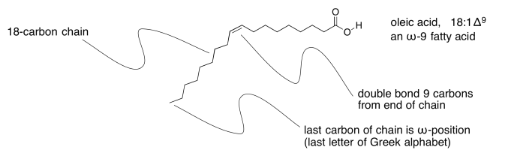
En ocasiones oirás hablar de los ácidos grasos omega-3 u omega-6, o alguna otra variación. Esa es la letra griega, ω, que es la última letra del alfabeto griego. Representa el último carbono de la cadena, y el número posterior te dice qué tan lejos está el doble enlace del final de la cadena.
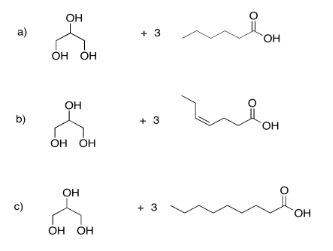
Dibujar los triglicéridos que resultarían en cada uno de los siguientes casos.
- Contestar
Los fosfolípidos son importantes en la formación de membranas celulares. En un fosfolípido, un fosfato reemplaza a uno de los alcoholes que de otra manera produciría un triglicérido. Dibuja el pjospholipid que resultaría en el siguiente caso.
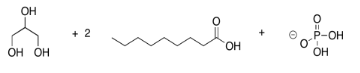
- Contestar
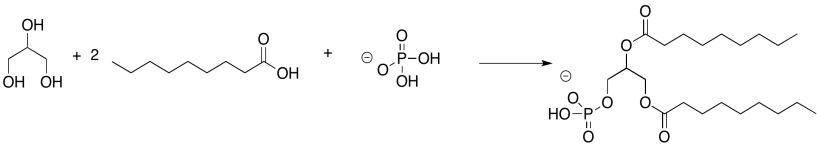
RespuestaEjercicio 4.13.2. Ecuación química: glicerol más dos moles de ácido nonanoico más dihidrógeno fosfito.
Dibuja los siguientes ácidos grasos, con base en la notación dada.
- ácido linolénico, 18:3 Δ 3 ,6,9
- ácido linoleico, 18:2 Δ 6 ,9
- ácido estearidónico, 18:4 Δ 3 ,6,9,12
- ácido mirístico, 14:0
- ácido palmitoleico, 16:1 Δ 7
- ácido adrenico, 22:4 Δ 6 ,9,12,15
- ácido araquidónico, 20:4 Δ 6 ,9,12,15
- ácido palmítico, 16:0
- Contestar
-
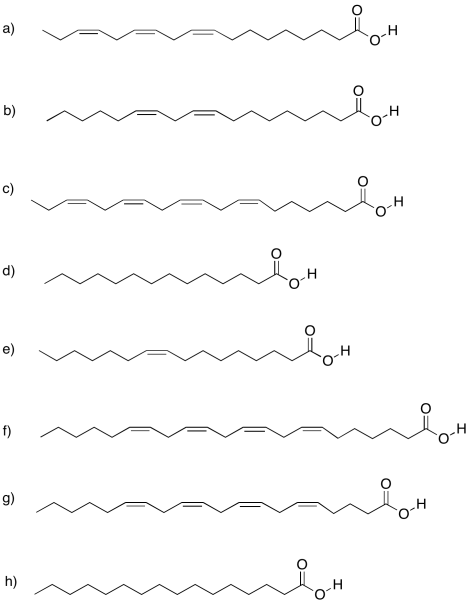
Los carbohidratos son una forma aún más crucial de almacenamiento de combustible para las celdas. Los carbohidratos son moléculas basadas en carbono que contienen muchos grupos OH. La glucosa es un ejemplo. Los dibujos a continuación son solo un recordatorio de que solemos trabajar con estructuras lineales esqueléticas, como la de la derecha, en lugar de las estructuras con etiquetas atómicas, como la de la izquierda, porque las cosas se desordenan bastante rápido en los dibujos más explícitos. No obstante, si necesitas volver a dibujar cosas con átomos para hacer un seguimiento de dónde está todo, no tengas miedo de hacerlo.
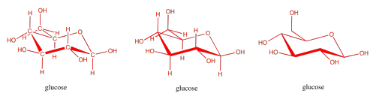
Los carbohidratos, al igual que los ácidos grasos, se almacenan en una forma en la que se unen entre sí. Cuando sea necesario, pueden desvincularse y las unidades individuales, como la glucosa, pueden enviarse a reacciones generadoras de energía.
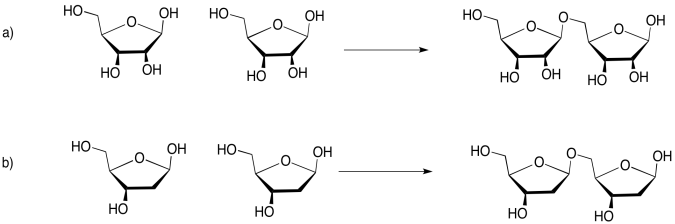
Los carbohidratos (o azúcares) están conectados por “enlaces éter”. Un éter es solo una unidad C-O-C. Al formar un enlace éter, dos carbohidratos podrían unirse, uniendo un oxígeno en un carbohidrato a un carbono en el siguiente, y liberando una molécula de agua. Es otra reacción de condensación, como la que forma éster. Esta vez, se forma un par de dos carbohidratos, llamado “disacárido”. Los carbohidratos individuales se llaman “monosacáridos”.
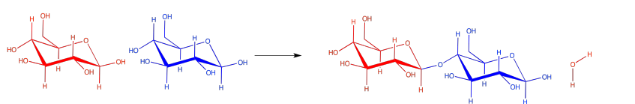
Hay muchos carbonos a los que el átomo de oxígeno de un carbohidrato vecino podría unirse, pero siempre se usa el mismo. Es el carbono que ya tiene dos oxígenos adheridos a él. El carbono en la esquina derecha de las moléculas rojas de glucosa es un ejemplo. Como resultado, el tipo particular de enlace éter entre los carbohidratos siempre se parece más a C-O-C-O-C. Puedes ver ese patrón si comienzas desde la esquina izquierda de la glucosa azul en el disacárido, y te mueves hacia la izquierda a través del hueco hacia la glucosa roja.
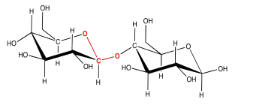
Este tipo de enlace doble éter se denomina “enlace glucósido” en bioquímica. No lo confundas con el triglicérido elaborado a partir de un ácido graso más glicerol. En química orgánica, esta unidad C-O-C-O-C se denomina “acetal”.
Estos enlaces se pueden utilizar para conectar muchos carbohidratos juntos. Dos monosacáridos se pueden unir para hacer un disacárido. Un tercero haría un trisacárido. Muchos de ellos conectados en una cadena se llamarían polisacárido. Otras moléculas pequeñas también pueden estar conectadas en cadenas, aunque no siempre por enlaces glucósidos o acetales. Cuando muchas moléculas pequeñas se han conectado en una molécula grande, llamamos a esa molécula un “polímero”. Esa palabra solo significa que está hecha de muchas cosas, todas juntas. Un polisacárido como la celulosa (a continuación) es un ejemplo de un polímero biológico.
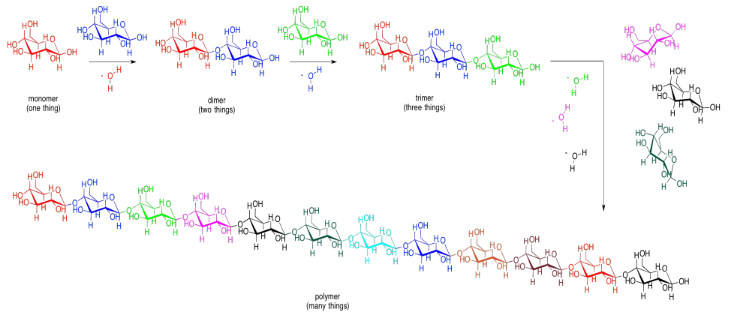
Dibujar los disacáridos que resultarían en cada uno de los siguientes casos. Asegúrese de usar el carbono acetal (glucósido) en una molécula; puede vincularse al alcohol primario (el grupo -CH 2 -OH) en la otra.
- Contestar
Los aminoácidos son una tercera clase general de moléculas biológicas. Los aminoácidos son importantes porque se recogen juntos en polímeros llamados proteínas. Las proteínas funcionan como máquinas; realizan la mayoría de las tareas necesarias para mantener vivo a un organismo.
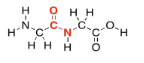
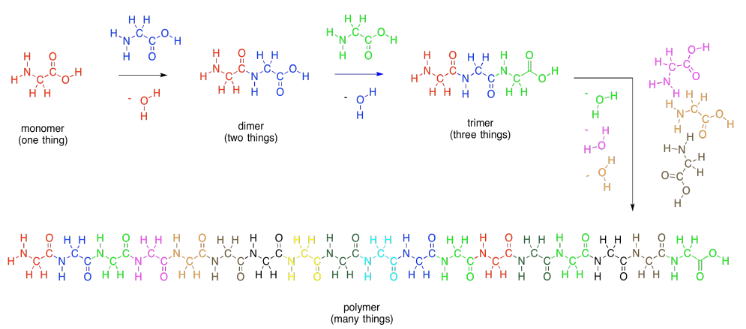
Los aminoácidos obtienen su nombre por el hecho de que contienen dos grupos funcionales orgánicos diferentes: una amina (NH 2) y un ácido carboxílico (CO 2 H). Para elaborar proteínas, el nitrógeno amínico en un aminoácido se conecta al carbono carbonilo (en el grupo C=O) del siguiente. Una vez más, se pierde un OH de una molécula y un protón de la otra, para hacer agua.

Al igual que en los lípidos, exactamente cómo estas dos moléculas eventualmente se unen es un poco más complicado que eso, pero esta imagen es lo suficientemente buena por ahora. Dos aminoácidos (dos monómeros) se conectan entre sí para formar una molécula más grande (un dímero) y una molécula de agua. Ese dímero suele llamarse un “dipéptido”. El enlace que se ha formado entre el nitrógeno y el carbonilo se denomina enlace “amida” en química orgánica, ya que el grupo funcional formado se denomina amida. En bioquímica, este enlace a menudo se llama un “enlace peptídico”. Es lo que mantiene unidas las dos piezas en un dipéptido.
Al igual que con los carbohidratos, los aminoácidos se pueden unir en cadenas largas. Pueden hacer polímeros. Un polímero de aminoácidos se llama polipéptido. Una proteína es solo un polipéptido extremadamente grande, en el que cientos de aminoácidos están conectados entre sí en una cadena larga.
Los lípidos y carbohidratos se utilizan para el almacenamiento, entre otras cosas, y así es útil para poder deshacer enlaces éster y enlaces acetales, para obtener nuevamente ácidos grasos e hidratos de carbono individuales cuando necesitamos consumir energía. Si nos desesperamos, también podríamos descomponer nuestras proteínas y polipéptidos y obtener energía de ellos, pero no solemos usar polipéptidos para el almacenamiento de energía, porque tienen muchos papeles más valiosos que desempeñar.
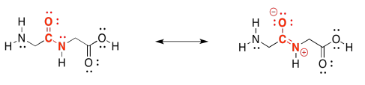
De hecho, los enlaces peptídicos son un poco más fuertes y más difíciles de romper que los enlaces éster o los enlaces acetal (glicosídicos). Eso es por un contribuyente de resonancia a la estructura. Observe que el oxígeno es más electronegativo que el nitrógeno. Ese oxígeno es capaz de acercar el par solitario del nitrógeno cercano, formando un enlace N=C π que hace que la amida sea más fuerte y estable. Todavía tenemos enzimas especiales que pueden descomponer las proteínas en nuestros alimentos, pero no es fácil.
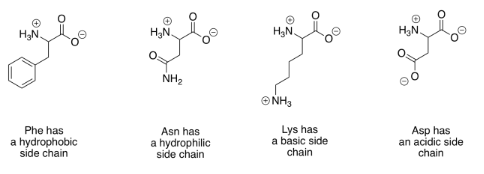
Hay una gran variedad de proteínas que pueden resultar de unir aminoácidos juntos de esta manera. Esa diversidad se debe en gran medida al hecho de que muchos compuestos diferentes tienen la misma estructura básica de aminoácidos, pero con grupos modificados llamados “cadenas laterales”. A continuación se muestran algunos ejemplos.
En realidad hay veinte aminoácidos comunes en biología. Para ayudar a organizar estos compuestos, las personas normalmente utilizan cuatro categorías diferentes que corresponden a las propiedades de las cadenas laterales. Dos grupos de aminoácidos comúnmente tienen cadenas laterales cargadas bajo condiciones de pH biológico. Las cadenas laterales ácidas ceden fácilmente un protón (H +) y se cargan negativamente como resultado; hay dos de ellas, aspartato y glutamato. (Aspartato es solo la palabra para la forma cargada negativamente del ácido aspártico; ese nombre se usa a menudo porque es más corto que “ácido aspártico”). Las cadenas laterales básicas recogen los protones fácilmente y se cargan positivamente como consecuencia. Hay tres de ellos, aunque solo dos suelen estar protonados a pH neutro; el otro se protonó en condiciones ligeramente más ácidas (pH inferior).
Los aminoácidos polares (o “hidrófilos”) son aquellos que interaccionarían fácilmente con las moléculas polares de agua en la célula. Por lo general, los puedes detectar por la presencia de dipolos fuertes en las cadenas laterales. Los dipolos fuertes son separaciones de carga entre dos átomos diferentes que tienen valores de electronegatividad muy diferentes. Por ejemplo, los enlaces C-O y O-H son polares. En contraste, los aminoácidos no polares (o “hidrófobos”) tienen cadenas laterales que carecen de dipolos fuertes. Por ejemplo, los enlaces C-C y C-H no son muy polares, porque las diferencias de electronegatividad entre los átomos son pequeñas.
Aquí están todos los aminoácidos comunes, dispuestos de acuerdo a la categoría, como aparecerían cuando se unen en una cadena peptídica.
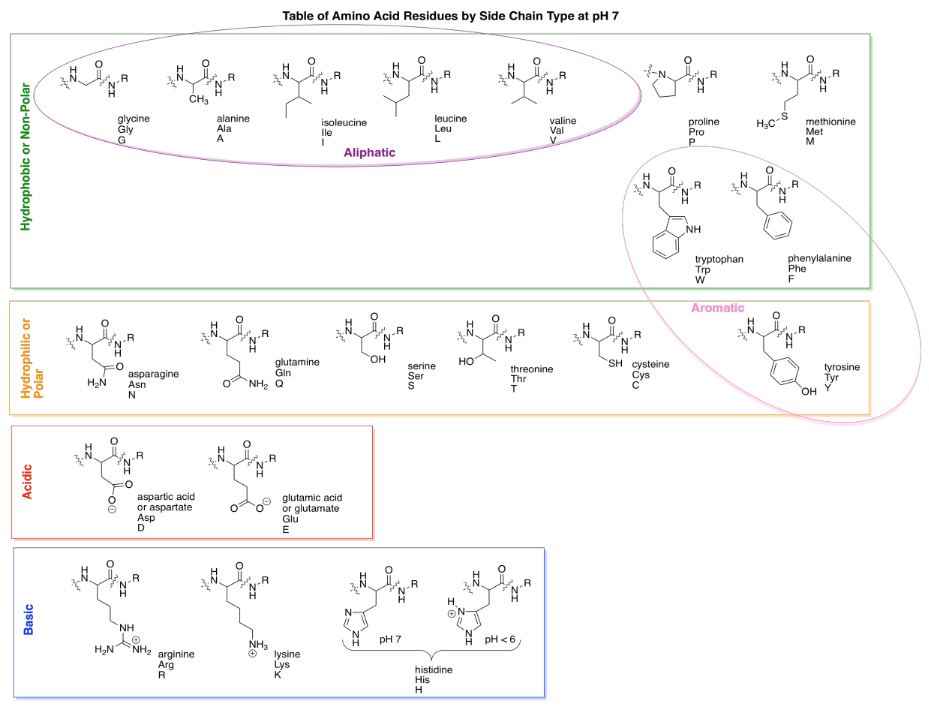
Un par de las cadenas laterales de aminoácidos están algo así al borde en términos de polaridad, y algunos libros de texto las colocarán en una categoría diferente. Por ejemplo, la tirosina tiene un enlace O-H y así es capaz de formar enlaces de hidrógeno con el agua. Eso lo hace bastante hidrofílico. Sin embargo, la mayoría de la cadena lateral contiene enlaces C-C y C-H no polares, por lo que a veces la verás agrupada con cadenas laterales hidrófobas.
Un par más de subgrupos que a veces verás son los aminoácidos aromáticos y alifáticos. Los alifáticos contienen cadenas carbonadas, pero no otros grupos funcionales, mientras que los aromáticos contienen “anillos aromáticos” como el benceno. Los aromáticos suelen ser anillos de seis miembros con dobles enlaces que se alternan en todos los sentidos. Son grupos planos que pueden apilar uno encima del otro y a veces esa propiedad puede ser importante.
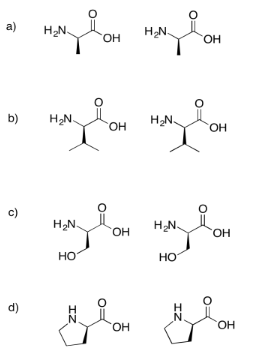
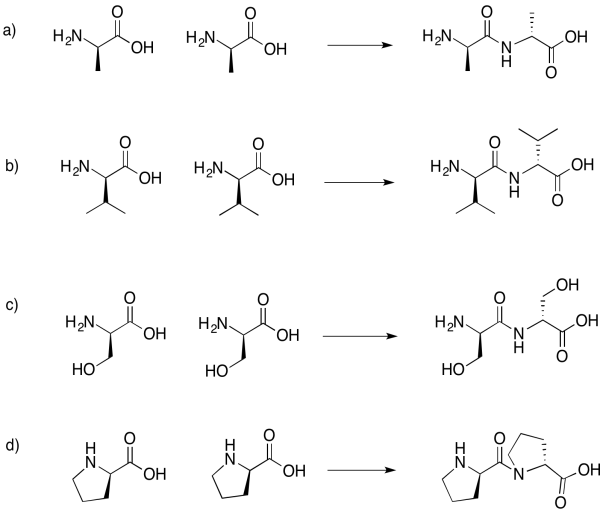
Dibujar los dipéptidos que resultarían en cada uno de los siguientes casos.
Si no sabes lo que significan las líneas acuñadas y discontinuas en el dibujo, no te preocupes por ello. Simplemente representan diferentes orientaciones en el espacio. Aprenderás sobre estas representaciones en un tema posterior llamado “estereoquímica”.
- Contestar
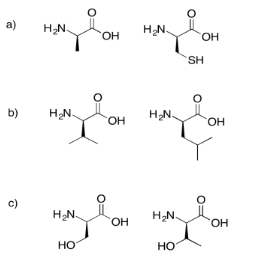
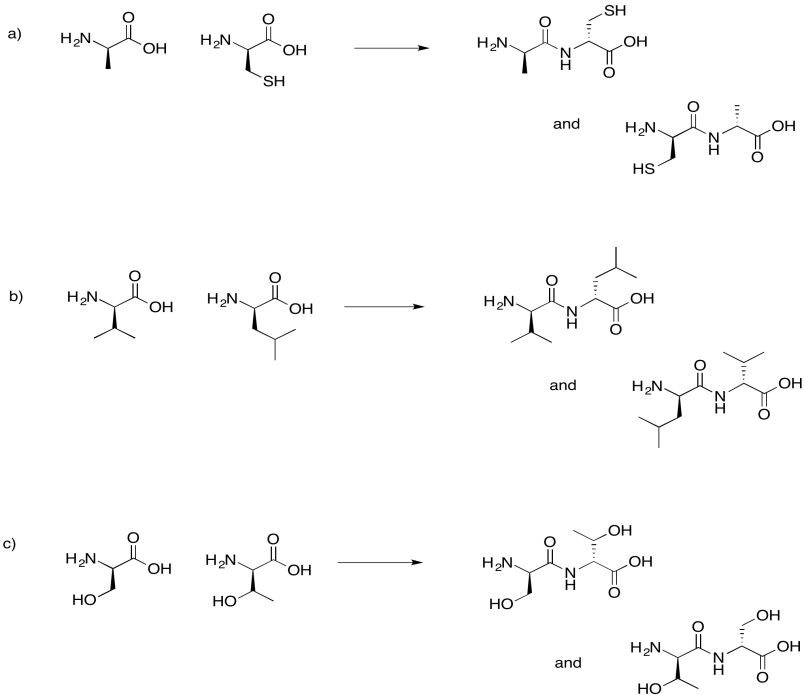
Dibujar los posibles dipéptidos que resultarían en cada uno de los siguientes casos.
- Contestar
Dibujar los posibles tripéptidos que resultarían en cada uno de los siguientes casos.
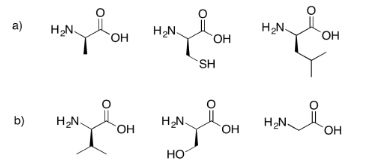
- Contestar
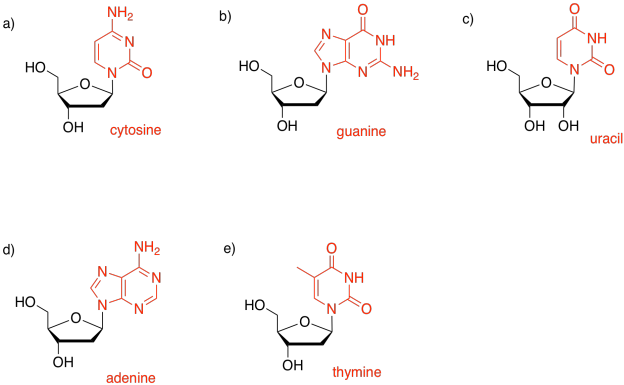
Posiblemente las biomoléculas más conocidas son los ácidos nucleicos, ADN y ARN. Estos compuestos son ejemplos de co-polímeros. Al igual que los carbohidratos complejos, están compuestos por moléculas individuales que se han unido covalentemente entre sí para formar cadenas poliméricas. Sin embargo, el ADN y el ARN siempre contienen tres tipos diferentes de monómeros: bases, azúcares y fosfatos.
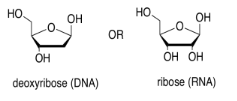
El azúcar es la parte que da origen a la D en el ADN o la R en el ARN. La ribosa, que se encuentra en el ARN, es un anillo de cinco miembros con oxígenos en cada carbono, principalmente como grupos OH. La desoxirribosa, que se encuentra en el ADN, es casi idéntica, pero le falta un grupo OH.
Una de las cuatro bases diferentes se puede unir a este azúcar en el ADN, y una de cuatro bases diferentes se puede unir a este azúcar en el ARN. Tres de esas bases se pueden encontrar en cualquiera de las moléculas: adenina, citosina y guanina. El cuarto es único para ADN (timina) o ARN (uracilo).
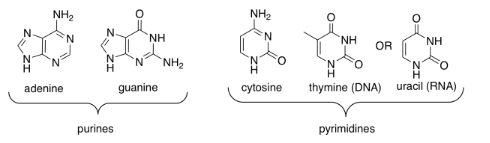
Estas cinco bases (llamadas así porque, al igual que las cadenas laterales de aminoácidos básicos, pueden captar protones) se dividen en dos categorías. Las pirimidinas (Peer-im-ID-Eens) contienen cada una un anillo de seis miembros. Las purinas (PURE-EENS) contienen un anillo de seis miembros y uno de cinco miembros. Estas categorías son importantes debido al “emparejamiento de bases”; ahí es cuando una hebra de ADN puede unirse a una cadena complementaria a través de enlaces de hidrógeno entre una base en una hebra y otra base en otra. En el emparejamiento de bases, una purina siempre se une a un compañero de pirimidina: guanina a citosina y adenina a timina (en ADN) o uracilo (en ARN).
Las bases están unidas covalentemente a azúcares en la posición de glucósido, ese mismo lugar donde los azúcares se unen entre sí en carbohidratos. El nuevo enlace se denomina enlace N-glucósido. El nuevo compuesto se llama nucleósido.
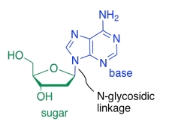
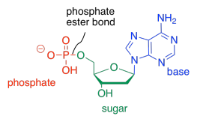
El tercer tipo de molécula que se une para formar el copolímero de ácido nucleico es un fosfato. Se une covalentemente al grupo alcohol primario en el otro extremo del anillo desde la base. El enlace entre el fosfato y el azúcar se llama enlace éster fosfato. El nuevo compuesto se llama nucleótido.
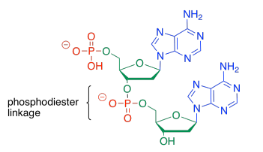
Para formar un copolímero, se forma otro enlace éster fosfato con el azúcar de otro nucleótido. El fosfato entre los dos azúcares a veces se llama enlace fosfodiéster, lo que significa que el fosfato está formando dos ésteres a la vez para unir los dos azúcares.
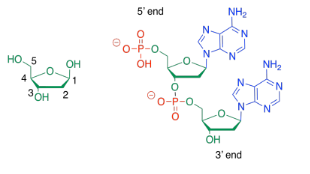
En ocasiones, las personas se refieren al extremo 3' o al extremo 5' de una cadena de ácido nucleico. Esos números se refieren a un sistema de numeración de los carbonos en los azúcares. Si estás hablando del final de la cadena de ADN que está más cerca del carbono número 3 del azúcar más cercano, estás hablando del extremo 3'.
Identificar la base en cada uno de los siguientes nucleósidos.
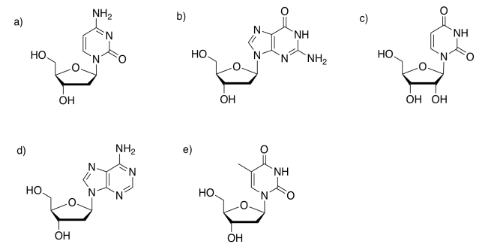
- Contestar