6.4: El Conjunto de Bases
- Page ID
- 80705
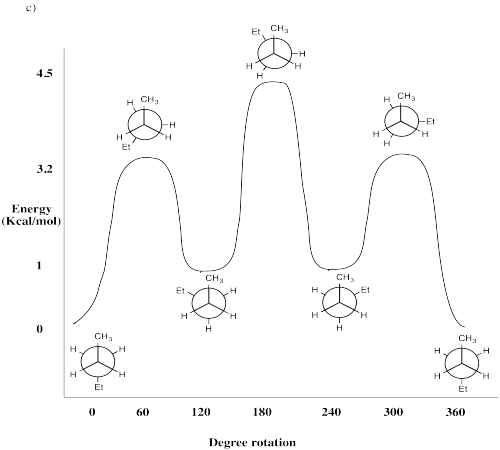
Usando información sobre la barrera rotacional del butano, que es de aproximadamente 4.5 kcal/mol, podemos agregar más información a nuestro conjunto base. También utilizaremos información de otras fuentes para construir una imagen más completa.
- En etano, no hay cepa estérica, porque los hidrógenos están demasiado separados para aglomerarse entre sí.
- En propano (CH 3 CH 2 CH 3), los hidrógenos del primer y tercer carbono están cerca uno del otro, pero apenas causan aglomeración.
- En el anti confórmero de butano, no hay cepa estérica, porque los grupos metilo están muy separados.
- En el conformador eclipsado menos estable del butano, con los metilos eclipsados, hay alrededor de 1.5 kcal/mol de cepa estérica. Los esteros de 1.5 kcal más 3 kcal de torsión equivalen a la barrera rotacional.
- En el conformador gauche del butano, no hay torsión, pero la cantidad de esterinos parece ser sólo un poco menor que cuando los metilos son eclipsados.
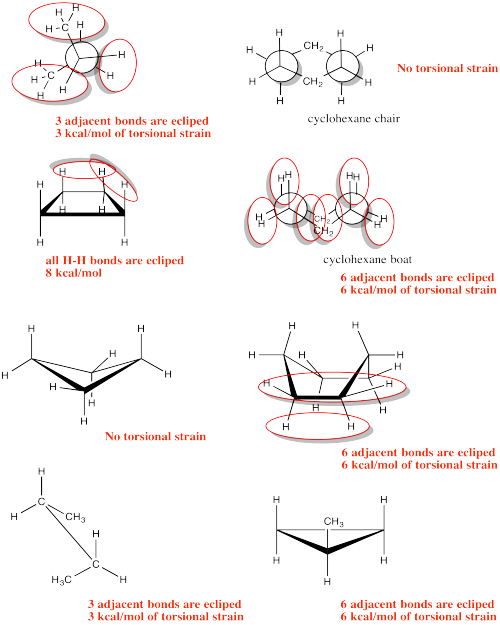
Un método sencillo para evaluar la cepa estérica, sin memorizar una gran tabla de información, es usar un método de conteo de átomos. Contar desde un hidrógeno, hasta el siguiente átomo, y así sucesivamente hasta el otro hidrógeno que parece probable que interactúe con el primero. En etano, esta distancia es de cuatro átomos (H-C-C-H). En propano son cinco. En butano son seis. Por consiguiente, la interacción estérica potencial en butano se denomina interacción de seis átomos. El conjunto de bases utilizado en este método se da en la siguiente tabla.
Mesa\(\PageIndex{1}\). Conjunto de bases de conteo de átomos para estimar la energía de tensión
| Tipo de cepa | Energía de deformación (kcal/mol) |
| torsión (tres pares de enlaces adyacentes eclipsados) | 3 |
| Estéricos de 4 átomos | 0 |
| Estéricos de 5 átomos | 0.1 |
| Estéricos de 6 átomos, gauche | 1 |
| Estéricos de 6 átomos, eclipsados | 1.5 |
| Estéricos de 7 átomos, gauche | 3 |
Tenga en cuenta que un grupo metilo (CH 3) siempre puede rotar, por lo que múltiples hidrógenos en un grupo metilo podrían interactuar potencialmente con múltiples hidrógenos en otro, pero no a la vez. Solo necesitamos tomar en cuenta las interacciones completas que podrían ocurrir simultáneamente.
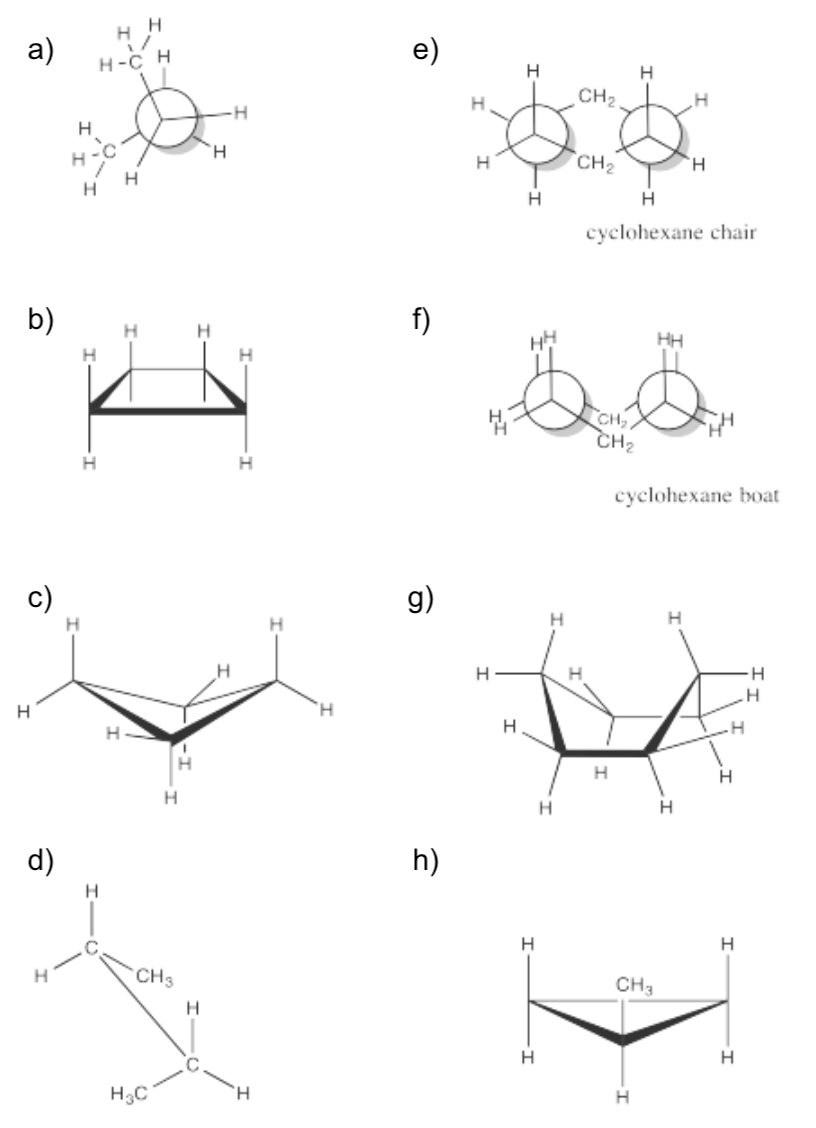
Ejercicio\(\PageIndex{1}\)
Calcular la deformación torsional en los siguientes casos.
- Contestar
-
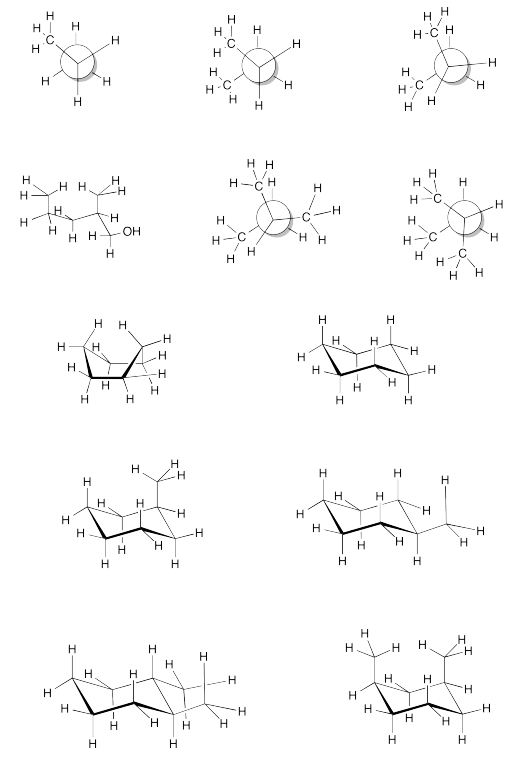
Ejercicio\(\PageIndex{2}\)
Encuentre todas las interacciones de 6 átomos en las siguientes imágenes.
- Contestar
-
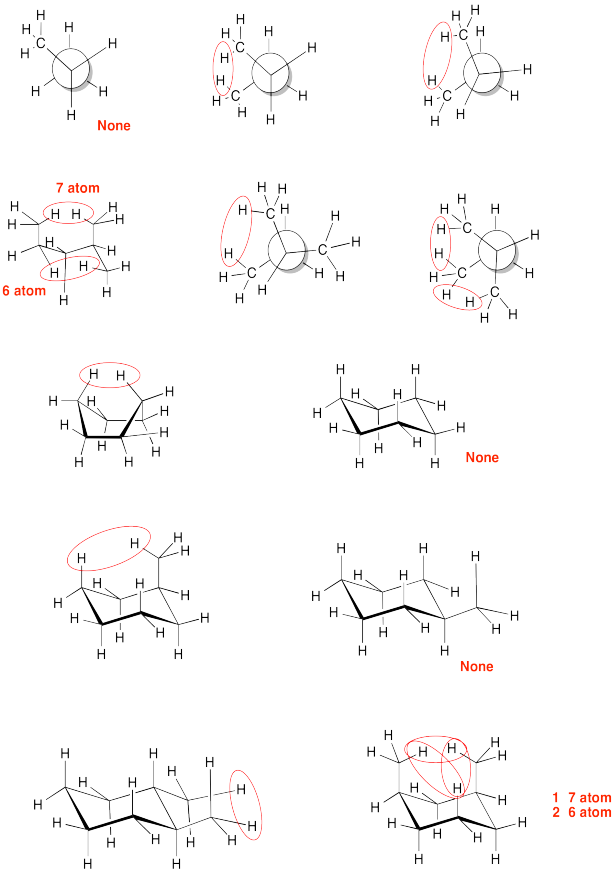
Ejercicio\(\PageIndex{3}\)
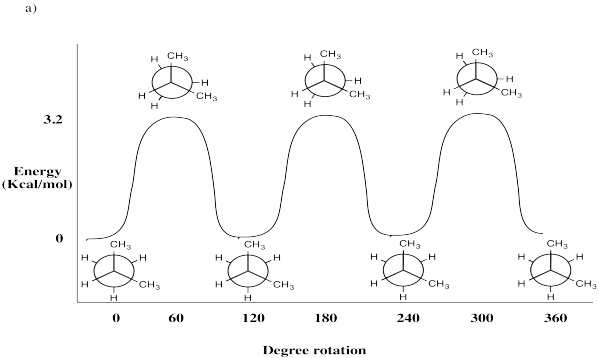
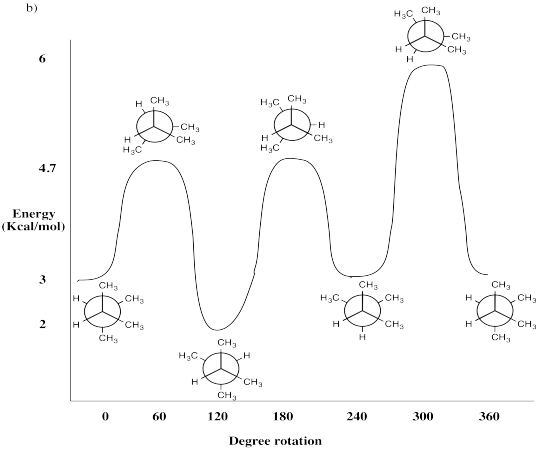
Dibuje Proyecciones Newman cada 60° para las siguientes moléculas. Evaluar la energía de deformación para cada Proyección Newman encontrada al rotar alrededor del enlace C2-C3. Utilice el conjunto de bases en la Tabla CA1. Trazar energía de deformación vs. ángulo diedro y etiqueta
- 2-metilpropano (CH 3 CH (CH 3) CH 3)
- 2,3-dimetilbutano (CH 3 CH (CH 3) CH (CH 3) CH 3)
- pentano (CH 3 CH 2 CH 2 CH 2 CH 3)
- Respuesta a:
-
- Respuesta b:
-
- Respuesta c:
-