7.5: Interacciones dipolo
- Page ID
- 80711
Cuando dos tipos diferentes de átomos están conectados entre sí, los electrones entre ellos normalmente no se comparten de manera uniforme. Eso es porque en la mayoría de los casos, dos átomos diferentes tendrían dos valores de electronegatividad diferentes. Un átomo sería más electronegativo que el otro. Tendría una atracción más fuerte por los electrones en el enlace compartido, y los electrones estarían un poco más atraídos por ese átomo que el otro.
Recuerde, la electronegatividad es una tendencia periódica. A medida que avanzamos hacia la derecha en la tabla periódica, cada vez se agregan más protones al núcleo, y así los átomos de la derecha atraen electrones con mayor fuerza que hacen los átomos de la izquierda. Además, a medida que nos movemos de arriba a abajo de la tabla periódica, las conchas de valencia de los átomos se hacen más grandes; eso significa que los electrones de valencia se están alejando del núcleo, por lo que están menos apretados. Esos dos factores, distancia y cantidad de carga, controlan la fuerza de interacción entre las partículas cargadas.
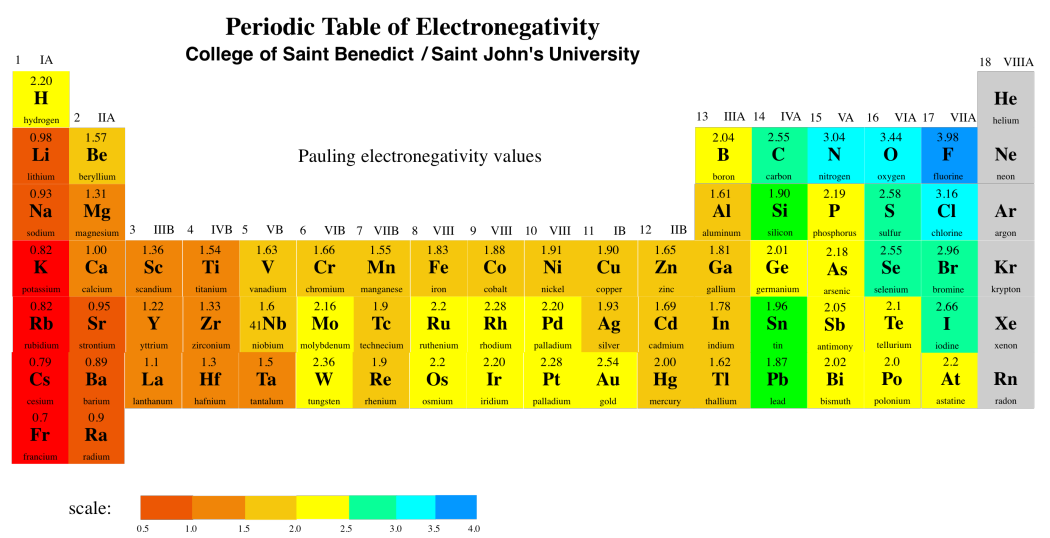
La tabla periódica anterior muestra los valores de electronegatividad de Pauling. Existen diferentes formas de calcular la electronegatividad, pero la escala de Pauling es muy utilizada. El cálculo de la escala Pauling depende de poder observar compuestos, por lo que a los gases nobles no se les suele dar un valor en esta escala, ya que normalmente no forman ningún compuesto.
Por ejemplo, cuando un átomo de carbono está unido a un átomo de flúor, existe una diferencia de electronegatividad entre los dos átomos. Hay una diferencia en los valores de electronegatividad de casi 1.5 unidades entre estos dos átomos. El flúor es más electronegativo que el carbono porque tiene más protones en el núcleo que carbono. Los electrones se acercan más al flúor que al carbono. Un enlace carbono-flúor se polariza hacia el flúor. Una molécula como el fluorometano, CH 3 F, tiene un dipolo permanente.
Tenga en cuenta que también hay dipolos en los enlaces C-H, pero son mucho más pequeños que los del enlace C-F que no importan. El dipolo general tiene una acumulación de carga negativa en el flúor.
Se puede imaginar que las moléculas con dipolos permanentes interactuarían entre sí mucho más fuertemente que las moléculas que dependen de dipolos temporales para poder pegarse entre sí. Las moléculas sin dipolo natural se pegarán solo sin apretar, pero las moléculas con dipolos permanentes se pegarán entre sí fácilmente.
El etano, C 2 H 6 (a veces escrito CH 3 CH 3, lo que sugiere que dos carbonos están conectados cada uno a tres hidrógenos, y también entre sí), y el formaldehído, CH 2 O, tienen diferentes fórmulas pero el mismo peso molecular. Basado solo en el peso, se necesitaría aproximadamente la misma cantidad de energía para mover una molécula de etano y una molécula de formaldehído.
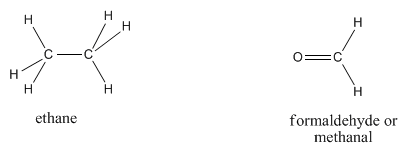
Las dos moléculas también tienen formas algo similares, a diferencia del neopentano y el pentano. A temperatura ambiente, el etano y el formaldehído son ambos gases. Sin embargo, los dos compuestos tienen puntos de ebullición muy diferentes; el formaldehído se vuelve líquido alrededor de -20 o C, lo que sería un día de invierno muy frío en, digamos, Chicago. El etano no se vuelve líquido a menos que se enfríe a alrededor de -90 o C, un día frío de invierno en Neptuno, momento en el que el formaldehído está casi listo para congelarse sólido.
La diferencia entre estas dos moléculas debe deberse al átomo de oxígeno en el formaldehído. El oxígeno, el segundo elemento más electronegativo de la tabla periódica, puede formar algunos enlaces muy polares. La diferencia entre carbono y oxígeno es de 0.89 unidades, casi una unidad de electronegatividad completa. El dipolo permanente que resulta entre el oxígeno y el carbono hace que las moléculas de formaldehído sean mucho más pegajosas que las moléculas de etano, que dependen de interacciones fugaces de Londres si van a aferrarse entre sí.
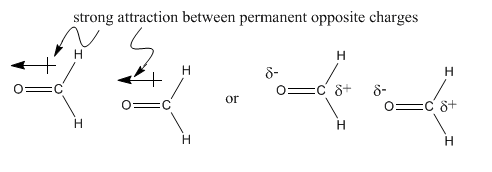
En contraste, la diferencia en electronegatividad entre carbono e hidrógeno es en realidad bastante pequeña (alrededor de 0.35 unidades, basado en la escala de Pauling). El dipolo diminuto en el enlace C-H es mucho más pequeño que el del enlace C=O que realmente no es un factor aquí.
Llevando esa historia un poco más allá, los hidrocarburos (moléculas compuestas por hidrógeno y carbono) son el ejemplo más común de compuestos no polares, porque sus enlaces son o bien enlaces C-C completamente no polares o bien enlaces C-H con muy baja polaridad. Hay un dipolo diminuto en un enlace C-H, pero no es suficiente para que las moléculas se atraigan muy bien entre sí. Además, tienden a haber muchos enlaces C-H en un hidrocarburo apuntando en todo tipo de direcciones; una molécula que se aproxima es poco probable que encuentre un extremo completamente positivo o un extremo completamente negativo de la molécula. Al final, todos esos dipolos pequeños en todos esos bonos C-H terminan cancelándose entre sí.
Hay otras variaciones en las interacciones dipolares que son bastante comunes. Por ejemplo, se podría imaginar que una molécula dipolar interaccionaría bastante fuertemente con un ion. Vamos a echar un vistazo a esa situación en breve cuando pensemos en cómo las mezclas de diferentes compuestos interactúan entre sí. Sin embargo, quizás la variación más importante en la química orgánica es el enlace de hidrógeno.
Ejercicio\(\PageIndex{1}\)
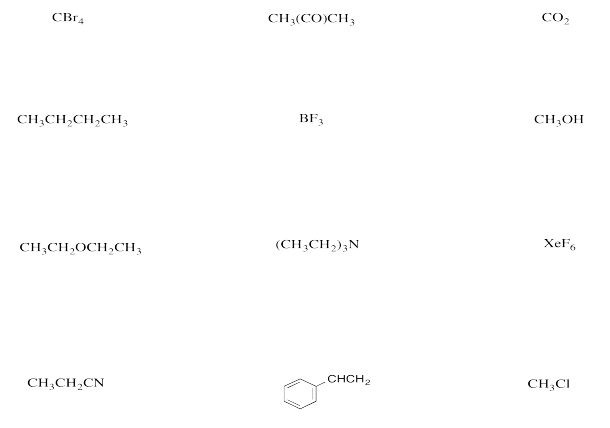
Comente los momentos dipolares en los siguientes compuestos y prediga sus puntos de ebullición relativos.
a) 1-clorobutano vs pentano
b) trietilamina frente a 3-etilpentano
c) éter dietílico frente a pentano
- Contestar
-
Todos estos compuestos contienen muchos enlaces C-C y C-H no polares, que no tendrían dipolos apreciables. Sin embargo, en cada par, hay un compuesto que contiene también enlaces polares mroe: C-Cl, C-N y C-O.
A veces una molécula que contiene enlaces polares no es realmente polar en general. El dióxido de carbono es un buen ejemplo. Las moléculas polares se atraen fuertemente entre sí porque el extremo más negativo de una molécula es atraído hacia el extremo más positivo de la siguiente molécula a través de la electrostática. Los opuestos se atraen. En dióxido de carbono, sin embargo, ambos extremos de la molécula son más negativos. ¿Cómo pueden atraerse el uno al otro?
Hay más que eso. Los dipolos son “cantidades vectoriales”. Eso quiere decir que no es solo la cantidad de separación de carga lo que importa; también es la dirección de separación. En el dióxido de carbono, una molécula lineal, hay dos enlaces polares. Esos enlaces polares apuntan directamente lejos unos de otros. El dipolo de un enlace equilibra el dipolo del otro enlace. En general, la molécula no tiene un dipolo.
El agua, por otro lado, es un caso diferente. Al igual que el dióxido de carbono, el agua tiene dos enlaces polares. Sin embargo, los enlaces en el agua no se encuentran en línea recta como los del dióxido de carbono. En cambio, están en ángulo el uno con el otro. Eso significa que sus dipolos no están apuntando del todo en direcciones opuestas. Como resultado, el agua tiene un momento dipolar general.
En el extremo, un enlace polar puede llegar al punto de que un átomo está tirando de los electrones con tanta fuerza hacia sí mismo que los aleja completamente del otro átomo. El primer átomo se convierte en un anión, y el segundo átomo se convierte en un catión. En este punto, tenemos un enlace iónico, más que uno covalente. ¿Qué tan diferentes deben ser los valores de electronegatividad para tener un enlace iónico? La regla general habitual es una diferencia de aproximadamente 1.6 unidades de electronegatividad. Entonces, por ejemplo, todos los átomos azules en la tabla periódica anterior formarían enlaces iónicos con todos los átomos rojos. Los átomos verdes formarían enlaces iónicos con la mayoría de los átomos de color rojo oscuro, pero no con los de color rojo claro.
Ejercicio\(\PageIndex{2}\)
El momento dipolar de una molécula (esencialmente el tamaño de su dipolo) se puede calcular a partir de la constante dieléctrica de un material, que puede medirse experimentalmente sobre una cantidad masiva del compuesto. El momento dipolar del clorometano, 12.9 D, es mayor que el del diclorometano, 9.08 D, aunque el diclorometano tiene un mayor número de enlaces polares que el clorometano. Explique por qué.
- Contestar
-
Los dipolos son vectores. Si tenemos dos enlaces polares, se sumarán usando la adición de vectores. Cualquier vector puede mostrarse como la suma de otros dos vectores. Abajo, la flecha roja apunta hacia abajo y hacia la izquierda. ¿Qué tan abajo y qué tan lejos a la izquierda? Podemos mostrar hasta qué punto usando las flechas azules. La flecha azul hacia abajo y la flecha azul a la izquierda se suman para dar la flecha roja que baja y hacia la izquierda.

En diclorometano, hay dos enlaces polares. Ambos enlaces están polarizados hacia el cloro más electronegativo. Como se dibuja a continuación, un enlace tiene un dipolo recto a la derecha. El otro enlace tiene un dipolo que baja y hacia la izquierda. Si la molécula tiene un dipolo general, con un extremo positivo de toda la molécula y un extremo negativo de toda la molécula, ¿qué extremo sería positivo y cuál sería negativo?
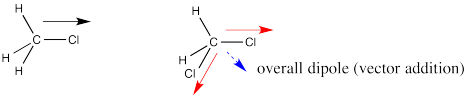
Parece razonable que el final positivo estaría en algún lugar sobre el lado del hidrógeno y el extremo negativo estaría en algún lugar sobre el lado del cloro. El dipolo general, a diferencia de los dipolos de enlace individuales, apuntaría en algún lugar en la dirección de la flecha azul discontinua. Pero, ¿qué tan grande sería? Seguramente es más grande que cualquiera de los dos dipolos individuales, porque se están sumando, ¿verdad?
Echemos una mirada muy cualitativa. La primera flecha roja está justo a la derecha. Romperemos la segunda flecha en una flecha más pequeña hacia abajo y una flecha aún más pequeña hacia la izquierda. La suma de las flechas izquierda/derecha es una flecha muy pequeña a la derecha.
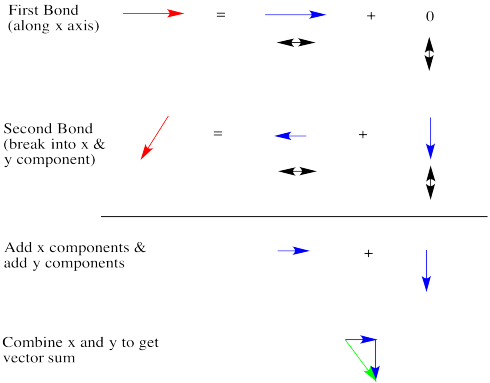
La suma de las flechas arriba/abajo es solo una pequeña flecha hacia abajo. En general, la suma es una flecha verde que va hacia abajo y hacia la derecha. El resultado realmente no parece más grande que un dipolo de enlace individual.
Ejercicio\(\PageIndex{3}\)
Sin embargo, el diclorometano tiene un punto de ebullición mayor (39 °C) que el clorometano (-24 °C). Explique por qué.
- Contestar
-
A pesar de los momentos dipolares relativamente similares, el punto de ebullición del diclorometano es mucho mayor que el del clorometano. La diferencia probablemente radica en la masa mucho mayor de diclorometano.
Ejercicio\(\PageIndex{4}\)
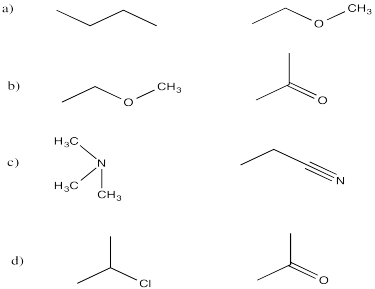
Comente los momentos dipolares en los siguientes compuestos y prediga sus puntos de ebullición relativos.
- butano y éter etílico metílico
- éter etílico metílico y 2-propanona
- trimetilamina y propanitrilo
- 2-propanona y 2-cloropropano
- Contestar
-
En cada caso, el de la derecha tiene un dipolo más grande y un punto de fusión más alto.
Ejercicio\(\PageIndex{5}\)
- Dibuja la estructura de Lewis para cada molécula con la geometría electrónica correcta.
- Dibuja en momentos dipolares.
- Decidir si la molécula es polar.