7.6: Enlace de hidrógeno
- Page ID
- 80707
El metanol, CH 4 O (o CH 3 OH, un grupo CH 3 unido a un OH), es otro ejemplo de una molécula con un peso molecular similar al etano. Al igual que el formaldehído, el metanol se congela en algún lugar alrededor de los 90 o C, pero no se convierte en un gas hasta que se calienta a 65 o C. El metanol es ciertamente similar al formaldehído de alguna manera. Contiene oxígeno y es muy polar. La enorme diferencia en sus puntos de ebullición se debe a los muy fuertes enlaces de hidrógeno en el metanol.
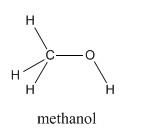
Los enlaces de hidrógeno ocurren cuando hay una cantidad significativa de carga positiva acumulándose en un átomo de hidrógeno. Eso sucede porque el hidrógeno está unido a un átomo que es mucho más electronegativo que el hidrógeno. Como resultado de esa carga positiva, un par solitario en otra molécula interactúa fuertemente con el hidrógeno.
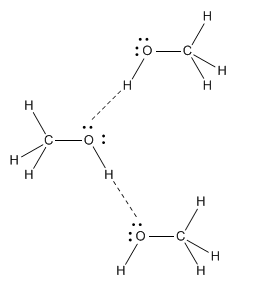
Los enlaces de hidrógeno solo ocurren cuando un hidrógeno está unido a uno de los pocos elementos más electronegativos de la tabla periódica: flúor, oxígeno o nitrógeno. Son estos fuertes enlaces de hidrógeno los responsables del punto de ebullición relativamente alto del metanol; hay tanta carga positiva en el hidrógeno del grupo OH que esencialmente puede formar un enlace real con el par solitario en otra molécula de metanol.

El agua es un ejemplo aún mejor de un compuesto de enlace de hidrógeno; de hecho, las moléculas de agua están tan unidas entre sí que esta molécula muy pequeña se congela a 0 o C y no hierve hasta 100 o C (mucho más caliente que un día de agosto en Las Vegas). Las moléculas de agua son mucho menos capaces de moverse libremente que las moléculas de etano, a pesar de que las moléculas de etano pesan casi el doble.
Para fines prácticos, los enlaces de hidrógeno generalmente involucran compuestos que contienen enlaces N-H y O-H. Eso se debe a que el oxígeno y el nitrógeno son los elementos segundo y tercero más electronegativos de la tabla periódica, respectivamente. Hay muchos, muchos ejemplos de compuestos como ese. También ocurre en HF, claro, porque el flúor suele considerarse el elemento más electronegativo, pero en realidad solo hay un ejemplo de un compuesto con ese enlace, por lo que es mucho menos probable que tengas que preocuparte por ese ejemplo. También se ha demostrado que los enlaces de hidrógeno ligeramente más débiles ocurren involucrando a otras especies, como los enlaces S-H, pero los más significativos involucran enlaces N-H y O-H.
Ejercicio\(\PageIndex{1}\)
¿Cuáles de las siguientes moléculas son capaces de formar fuertes enlaces de hidrógeno?
a) etanal, CH 3 CHO b) etilamina, CH 3 CH 2 NH 2 c) ácido acético o etanoico, CH 3 CO 2 H d) peróxido de dimetilo, CH 3 OOCH 3
- Responder
-
Solo la etilamina y el ácido etanoico tienen los enlaces N-H u O-H que son lo suficientemente polares para el enlace de hidrógeno.
Ejercicio\(\PageIndex{2}\)
Predecir el orden relativo de los puntos de fusión en las siguientes aminas:
hexilamina, CH 3 (CH 2) 4 CH 2 NH 2; trietilamina, (CH 3 CH 2) 3 N; dipropilamina, (CH 3 CH 2 CH 2) N
- Responder
-
hexilamina > dipropilamina > trietilamina
El que tenga mayor potencial de enlaces de hidrógeno tendrá el punto de fusión más alto.
Ejercicio\(\PageIndex{3}\)
Identificar el FMI más fuerte en cada caso.
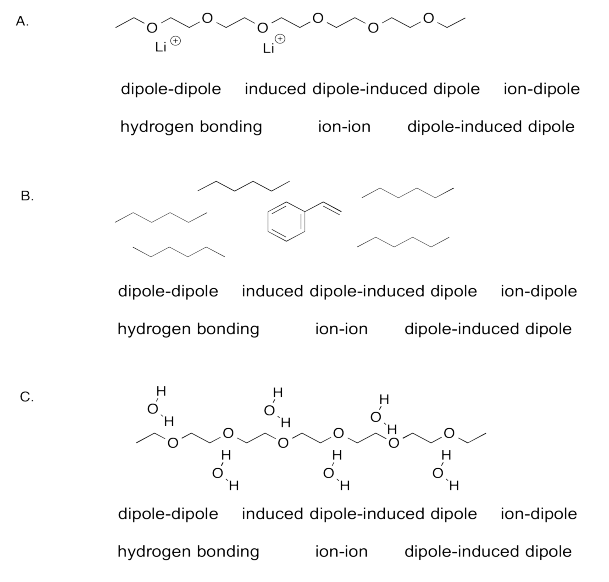
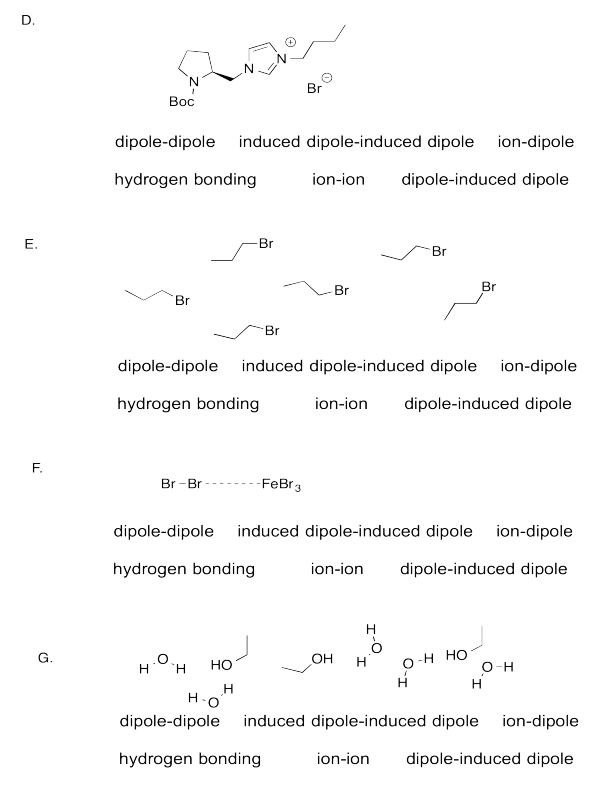
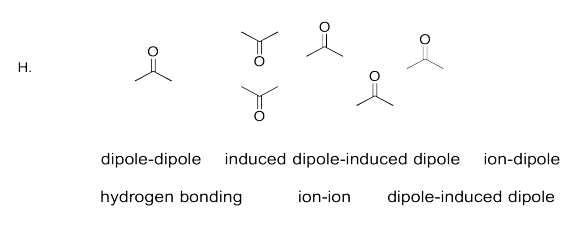
- Responder
-
Moléculas Biológicas e IMF
Debido a que los compuestos que contienen oxígeno y nitrógeno son tan comunes en biología, los enlaces de hidrógeno son una característica bastante común en la química orgánica y biológica.
Los carbohidratos son una de las principales clases de biomoléculas. Los carbohidratos son compuestos que contienen muchos grupos OH, por lo que tienen mucho potencial para formar enlaces de hidrógeno.
Las proteínas y péptidos contienen grupos amida. Las amidas contienen enlaces N-H; los enlaces de hidrógeno que involucran amidas son influencias cruciales en la estructura de las proteínas.
Las moléculas biológicas grandes como las proteínas consisten en 1000 átomos, que interactúan a través de iones “intramoleculares”, dispersión de Londres, dipolo-dipolo y enlaces de hidrógeno para crear una estructura 3D única. Otras moléculas, tanto pequeñas como grandes, pueden unirse a macromoléculas biológicas usando las mismas interacciones intermoleculares. A continuación se muestra un ejemplo de una proteína, la proteína tirosil fosfato bovina de bajo peso molecular, que se une a fosfato inorgánico.
Las pantallas anteriores muestran tres formas diferentes de renderizar la LMW-PTPasa. Reconocerá los modelos de vuelo espacial y estructura metálica, pero tenga en cuenta su complejidad en comparación con las moléculas más pequeñas que ha estudiado hasta ahora. Las moléculas de dibujos animados eliminan gran parte del detalle al eliminar átomos y enlaces, y reemplazarlos con líneas, cintas (que representan hélices alfa) y flechas de bloque (que representan la estructura beta). [No Disponible]
El fosfato inorgánico, inhibidor de esta enzima, se une a la enzima a través de las fuerzas intramoleculares mencionadas anteriormente. Se representa en vuelo espacial con la proteína en los modos de dibujos animados y estructura metálica.
El ADN puede ser el ejemplo más conocido de un compuesto que muestra enlaces de hidrógeno. En el ADN, los “pares de bases” complementarios se unen entre sí para sujetar dos cadenas de ADN juntas.
Enlaces de hidrógeno débiles “secundarios”
Los enlaces de hidrógeno son realmente un caso especial de fuerzas dipolares. Ocurre bajo circunstancias muy particulares: en presencia de enlaces O-H o N-H, que proporcionan tanto un hidrógeno muy positivo como un par solitario, las dos características necesarias para una interacción de enlaces de hidrógeno.
En general, pensamos en un enlace de hidrógeno como la interacción electrostática entre un par de electrones en un átomo y un átomo de hidrógeno que ha acumulado una carga positiva parcial. Hay algunos ejemplos donde eso podría estar sucediendo, pero que preferiríamos mantenernos separados de la idea general de un enlace de hidrógeno. Por ejemplo, un par solitario en un átomo de oxígeno en formaldehído podría ser atraído por un hidrógeno en otro formaldehído, que estaría en el extremo más positivo de la molécula. Existe evidencia de la cristalografía de rayos X de que tales “enlaces de hidrógeno” débiles ocurren en estado sólido en moléculas que contienen grupos aldehído, similares a la del formaldehído.
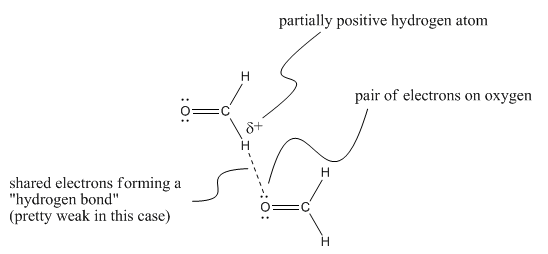
Sin embargo, este tipo de interacciones son realmente muy débiles. No se les debe pensar en la misma categoría que los enlaces regulares de hidrógeno. Por esa razón, les daremos un término separado, enlace de hidrógeno “secundario”. Este tipo de interacción es bastante esotérica y no es tan probable que la veas. Lo estamos viendo aquí realmente para subrayar la idea de que hay algo muy especial en los enlaces de hidrógeno resultantes de compuestos que contienen enlaces O-H y N-H.
Posteriormente, verá que siempre que haya un caso en el que haya una oportunidad de enlaces regulares de hidrógeno, las propiedades de la molécula se ven dramáticamente afectadas. Eso no es cierto de lo contrario. Los enlaces secundarios de hidrógeno pueden ser responsables de algunos efectos muy sutiles en el estado sólido, cuando las moléculas ya están a bastante baja energía y no se mueven mucho. Sin embargo, difícilmente cambian las propiedades de una molécula más allá de lo que esperaríamos en base a simples interacciones dipolo-dipolo.

