7.7: Atracciones Iónicas
- Page ID
- 80720
Hasta el momento, hemos visto que todas las moléculas pueden tener potencialmente débiles atractivos que las hacen aferrarse entre sí. Debido a que los electrones en un átomo o molécula no son estacionarios, sino que siempre están en movimiento, siempre existe la posibilidad de que una molécula se convierta temporalmente en un lado irregular. Sus electrones pueden inclinarse un poco hacia un lado, lo que lleva a una pequeña acumulación de carga negativa en ese lado. La molécula sería ligeramente baja en densidad electrónica en el otro lado, lo que llevaría a una pequeña acumulación de carga positiva allí. Este dipolo temporal puede inducir dipolos temporales en otras moléculas cercanas. Ese lado ligeramente positivo puede jalar los electrones de una molécula cercana. Y así sucesivamente; una cadena de estos eventos puede caer en cascada a través de un grupo de moléculas. Obtenemos una interacción dipolo inducida por dipolo inducido.
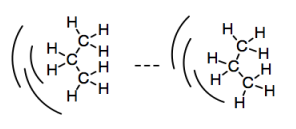
También hemos visto que algunas moléculas tienen dipolos permanentes. Si dos átomos están unidos entre sí y tienen una diferencia suficientemente grande en electronegatividad, entonces hay una separación de carga significativa entre los dos átomos, y resulta un dipolo permanente. La diferencia entre estos dipolos permanentes y los que vimos en las interacciones de Londres es que las interacciones de Londres suben y bajan en un instante. Por lo general, las interacciones de Londres no duran lo suficiente como para mantener juntas dos moléculas muy fuertemente, a menos que haya muchas de estas interacciones. Debido a que un dipolo fijo es permanente, hay pocas oportunidades para que dos moléculas con una interacción dipolo-dipolo se retuerzan una de la otra.
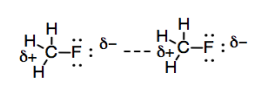
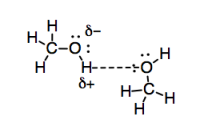
Los enlaces de hidrógeno son un ejemplo particularmente fuerte de interacciones dipolo-dipolo debido a la diferencia significativa de electronegatividad entre oxígeno e hidrógeno. La interacción también se ve fortalecida por la disponibilidad de un par solitario en oxígeno para facilitar la interacción con la carga positiva parcial en el hidrógeno. Además, son realmente importantes cuando vives en un planeta tan acuoso.
Entonces, estas interacciones se vuelven progresivamente más fuertes en función de la cantidad de separación de carga en el enlace. La conclusión lógica de esa progresión es un vínculo completamente ionizado. ¿Qué pasa si un extremo del bono tiene una carga negativa completa y el otro extremo tiene una carga positiva completa? Obviamente, los iones deberían tener aún más atracción electrostática entre sí que los meros dipolos.
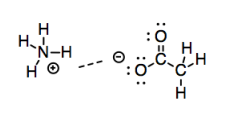
Ahora, muchos tratamientos de atracciones intermoleculares ni siquiera consideran atracciones iónicas; lo tienen cubierto bajo el “enlace iónico”. Sin embargo, también es útil observar las atracciones iónicas en el contexto actual, porque ayudan a completar la imagen de cómo dos moléculas podrían interactuar entre sí.
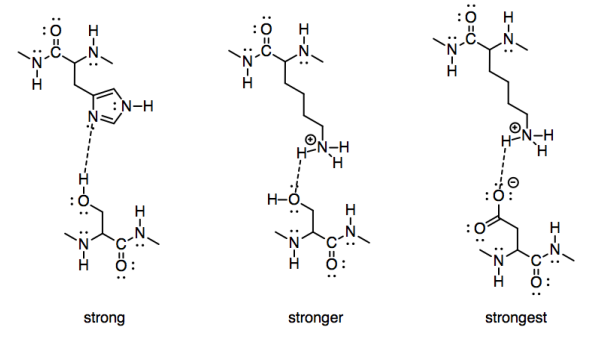
Para tomar un ejemplo biológico, podríamos considerar la fuerza de interacción de dos cadenas laterales de aminoácidos. Una serina e histidina tendrían interacciones significativas entre sí, ya que ambas contienen cadenas laterales capaces de formar enlaces de hidrógeno. Sin embargo, una serina tendría una interacción más fuerte con la cadena lateral de una lisina cargada positivamente. Para ir un paso más allá, una lisina cargada positivamente tendría una atracción aún más fuerte hacia un aspartato cargado negativamente.