7.8: Comparando las propiedades de los isómeros
- Page ID
- 80715
A veces hay más de una manera de conectar un grupo dado de átomos en una estructura molecular. Dada la fórmula C 2 H 6 O, son posibles dos isómeros diferentes: éter metílico y etanol. Tienen la misma fórmula pero diferentes estructuras. La palabra, “isómero”, es del griego, que significa “mismas cosas”, refiriéndose a su contenido idéntico. Sin embargo, los isómeros a menudo tienen propiedades físicas y biológicas muy diferentes.

Estos dos compuestos tienen diferentes propiedades físicas, como puede ver en la siguiente tabla.
|
Recuerde, la temperatura ambiente típica es de unos 25 °C, lo que significa que a temperatura ambiente, el éter dimetílico es un gas, porque está por encima de su punto de ebullición. El etanol, por otro lado, es un líquido a temperatura ambiente. El etanol a esa temperatura está muy por encima de su punto de congelación pero aún no ha alcanzado su punto de ebullición.
¿Por qué es eso? ¿Cuál es el origen de las diferencias en las propiedades físicas entre estos dos compuestos similares, uno de los cuales es un gas a temperatura ambiente mientras que el otro es un líquido? Ambos contienen enlaces carbono-hidrógeno y carbono-oxígeno. El etanol también contiene un enlace carbono-carbono y un enlace oxígeno-hidrógeno.
Ciertos enlaces, o grupos de enlaces, confieren comportamientos específicos a los compuestos en los que se encuentran. Por ejemplo, cuando se encuentra un grupo OH en un compuesto orgánico, puede hacer que el compuesto sea moderadamente ácido. También hace que el compuesto sea un poco más probable que sea un sólido o líquido en lugar de un gas. ¿Por qué?
La atracción intermolecular dominante entre las moléculas de etanol es el enlace de hidrógeno. Lo que queremos decir es que, aunque dos moléculas de etanol pueden ser atraídas por las fuerzas de dispersión londinenses e incluso por dipolos, ambos factores palidecen en comparación con la atracción que surge de los enlaces de hidrógeno. El enlace de hidrógeno es el factor más importante que mantiene unidas dos moléculas de etanol.
En el éter dimetílico, por otro lado, los enlaces de hidrógeno no son un factor. En esta molécula, la mayor atracción intermolecular involucra momentos dipolares regulares. Debido a que los enlaces de hidrógeno suelen ser atracciones mucho más fuertes que los momentos dipolares ordinarios, un grupo de moléculas de etanol es mucho más difícil de separar entre sí que un grupo de moléculas de éter dimetílico. El etanol tiene un punto de ebullición mucho mayor.
Ejercicio\(\PageIndex{1}\)
Los compuestos realmente no tienen que ser isómeros para poder compararlos de esta manera. Sólo tienen que ser lo suficientemente similares como para que podamos compararlos razonablemente.
Por ejemplo, propan-2-ona o acetona, CH 3 (CO) CH 3, tiene un punto de ebullición de 56-57 °C mientras que el 2-propanol, CH 3 CH (OH) CH 3, tiene un punto de ebullición cercano a 83 °C. Explique la diferencia.
- Responder
-
El enlace de hidrógeno entre las moléculas de 2-propanol es una interacción más fuerte y es más difícil de superar que las interacciones dipolo-dipolo entre moléculas de 2-propanona. Por lo tanto, las moléculas de 2-propanona pueden escapar más fácilmente a la fase de vapor.
Diferentes colecciones de enlaces que se encuentran comúnmente en compuestos orgánicos se denominan grupos funcionales. Los grupos funcionales influyen en las propiedades físicas de los compuestos en los que se encuentran. También pueden influir en la actividad biológica de un compuesto; es decir, pueden ayudar a determinar si un compuesto podría estar activo como un tipo específico de medicamento, una hormona u otro tipo de compuestos que interactúan regularmente con organismos en la naturaleza.
En el caso que miramos arriba, estábamos comparando un alcohol con un éter. En un alcohol, hay un grupo OH unido a un carbono. En un éter, hay una O unida a dos carbonos. (Existen excepciones a estas definiciones: si un grupo OH está unido a un carbonilo, un grupo C=O, no es un alcohol sino un ácido carboxílico. Si un oxígeno está unido a un carbonilo y a otro carbono, no es un éter sino un éster.) En general, podemos decir que, debido a la diferencia en las atracciones intermoleculares, un alcohol tiene un punto de ebullición más alto que un éter de tamaño comparable.
- Las propiedades de los materiales están estrechamente relacionadas con su estructura
- Dos compuestos isoméricos, compuestos exactamente por los mismos elementos en exactamente la misma proporción, pueden tener propiedades muy diferentes debido a las diferentes formas en que los átomos están conectados dentro de los compuestos.
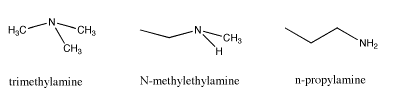
Otro ejemplo de isómeros se encuentra al observar la fórmula C 3 H 9 N. Esta vez hay tres estructuras diferentes que pueden ocurrir con la fórmula dada. Los tres isómeros contienen el grupo funcional “amina”. Una amina es solo un nitrógeno conectado a una mezcla de carbonos e hidrógenos. Nuevamente, los tres isómeros tienen diferentes propiedades, y estas diferencias no se limitan solo a los puntos de fusión y puntos de ebullición. Qué factor crees que es el responsable de estas diferencias.
|
Las diferencias en los puntos de fusión y puntos de ebullición son bastante sencillas. El primer ejemplo no posee potencial para enlaces de hidrógeno. El segundo lo hace porque contiene un enlace N-H y el tercero aún más, porque contiene dos enlaces N-H en lugar de uno.
A diferencia de los alcoholes y éteres, el hecho de que una amina contenga o no un N-H no cambia el nombre del grupo funcional. Todavía se le llama amina. Ese puede ser un artefacto desafortunado de la historia, porque claramente una amina que puede formar enlaces de hidrógeno es un poco diferente de una amina que no puede, de la misma manera que un alcohol es diferente de un éter. Para compensar esa falta de distinción entre aminas, se emplea un adjetivo adicional para describirlas. Una amina en la que el nitrógeno está unido a un solo carbono y dos hidrógenos se denomina “amina primaria” (primaria significa uno, como en un enlace de carbono). Una amina en la que el nitrógeno está unido a dos carbonos y uno hidrógenos se denomina “amina secundaria” (secundaria significa unión a dos carbonos). Una amina en la que el nitrógeno está unido a tres carbonos y no hay hidrógenos se denomina “amina terciaria” (unión a tres carbonos).
Los isómeros tienen una variedad de propiedades que son diferentes de las propiedades de otros miembros de su grupo. No todas estas propiedades pueden explicarse fácilmente al observar diferentes estructuras, pero algunas sí. La densidad de un material es la relación entre su peso y su volumen (en lenguaje más “científico”: masa/volumen). Un material con una densidad mayor que otro puede pensarse que tiene el mismo peso, pero encogido a un volumen menor. Alternativamente, podría pensarse que tiene el mismo volumen, pero lleno de más masa.
Obsérvese que los isómeros de la tabla anterior tienen diferentes densidades. Las densidades en la tabla se refieren a densidades de líquidos. A pesar de sus similitudes, los tres compuestos en estado líquido se juntan de manera un poco diferente. Eso, también, es resultado de diferencias estructurales.
Ejercicio\(\PageIndex{2}\)
Explique las diferencias entre las densidades en la tabla anterior. Todos los valores de la tabla se refieren a los materiales en sus estados líquidos.
- Responder
-
Hay enlaces de hidrógeno entre las moléculas de N-metiletilamina, pero no entre las moléculas de trietilamina, las cuales se mantienen unidas por dipolos relativamente débiles. Las moléculas de trimetilamina no se mantienen juntas tan fuertemente como las moléculas de N-metiletilamina, que por lo tanto se empaquetan más densamente. Por otro lado, la n-propilamina contiene dos enlaces N-H, en comparación con solo uno en N-metiletilamina. En consecuencia, la n-propilamina tiene una mayor propensión a formar enlaces de hidrógeno, y se empaqueta aún más densley que la N-metiletilamina.
Ejercicio\(\PageIndex{3}\)
Si bien esta información no se anota en la tabla anterior, los valores de densidad generalmente se listan junto con la temperatura a la que se midió el valor. Eso es porque la densidad es en realidad una función de la temperatura. La mayoría de los materiales se vuelven más densos ya que se vuelven más fríos y menos densos a medida que se calientan Explicar por qué la densidad varía con la temperatura.
- Responder
-
La temperatura es una medida de cuánta energía está disponible en el ambiente. A medida que aumenta la temperatura, las moléculas obtienen más energía y transfieren esa energía a una variedad de movimientos moleculares. A medida que se mueven más, son menos capaces de permanecer densamente empaquetados. La densidad disminuye a medida que sube la temperatura. Por el contrario, las cosas tienden a encogerse a medida que se enfrían, porque las moléculas se ralentizan y comienzan a empacar más Se vuelven más densos.
Existen otras propiedades que se pueden comparar y explicar con base en las estructuras de los compuestos. La presión de vapor está estrechamente relacionada con el punto de ebullición. Se refiere a la presión ejercida por moléculas que escapan de un líquido a la fase vapor. Cuanto más fácilmente las moléculas puedan alejarse unas de otras en el líquido y escapar a la fase de vapor por encima del líquido, mayor será la presión de vapor. Cuanto mayor es la presión de vapor, más fácilmente alcanza el líquido el punto de ebullición. En un sentido sencillo, podemos pensar en fuertes atractivos entre las moléculas que las mantienen en fase líquida y la disminución de su presión de vapor.
La viscosidad se refiere a la resistencia al flujo en un líquido. Cuanto mayor es la viscosidad de un líquido, más lentamente fluye. El jarabe de arce es más viscoso que el agua, pero la miel es más viscosa que el jarabe de arce. De manera simplificada, podemos pensar en moléculas que se aferran a sus vecinos a medida que fluyen entre sí, obstaculizando el flujo y aumentando la viscosidad. Así, las atracciones intermoleculares entre moléculas en un líquido afectan su viscosidad.
Es un poco como un grupo de amigos corriendo por una calle abarrotada de Manhattan. Si todos se toman de la mano, no avanzan tan rápido como lo harían individualmente. Individualmente, cada miembro del grupo es capaz de hacerse a un lado, dardos hacia adelante y pasar a los peatones que se aproximan. Aferrándose, todos tienen que volverse, pararse y esperar a que la gente los deje pasar.
La tensión superficial es una medida de la fuerza con la que un líquido resiste las fuerzas externas. Se podría pensar en ello como la fuerza con la que las moléculas de un material se aferran entre sí cuando se les da la oportunidad de aferrarse a otra cosa en su lugar.
La imagen más familiar de la tensión superficial es una gota de agua. El agua forma gotas porque las moléculas en el agua se adhieren entre sí más fuertemente que a las moléculas en el aire. Esas son en su mayoría moléculas de nitrógeno, N 2, con una fracción significativa de moléculas de oxígeno, O 2. Las moléculas en el aire son bastante no polares, porque están hechas de los mismos tipos de átomos: dos nitrógenos, por ejemplo. No hay diferencia de electronegatividad que imparta un dipolo a la molécula. Eso está en marcado contraste con una molécula de agua altamente polar; es difícil encontrar moléculas más polares que eso. Si una molécula de agua interactuara con una molécula de dinitrógeno, estaría comerciando algunos enlaces de hidrógeno fuertes con otras moléculas. Eso no valdría la pena.
Ejercicio\(\PageIndex{4}\)
Explicar las diferencias en las presiones de vapor de los siguientes compuestos (enumerados en HectoPascales, hPa).
- ácido acético, CH 3 CO 2 H (15.3) vs propan-2-ona, CH 3 (CO) CH 3 (240)
- acetato de etilo, CH 3 CO 2 CH 2 CH 3 (97) vs éter dietílico, CH 3 CH 2 OCH 2 CH 3 (587)
- pentano, CH 3 CH 2 CH 2 CH 2 CH 3, (573) vs heptano, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 (48)
- Respuesta a:
-
El ácido acético posee capacidad de enlace de hidrógeno, mientras que la 2-propanona tiene la capacidad de formar solo interacciones dipolo-dipolo. Por lo tanto, las moléculas de 2-propanona no se mantienen en la fase líquida tan fuertemente como el ácido acético, y el primer compuesto tiene una presión de vapor más alta.
- Respuesta b:
-
El enlace C=O del acetato de etilo tiene un dipolo sustancial, pero los dipolos en éter no suman mucho; son más pequeños para empezar y cancelan parcialmente vía adición vectorial. Las moléculas de éter pueden escapar del líquido más fácilmente, lo que resulta en una mayor presión de vapor.
- Respuesta c:
-
Ambas moléculas están limitadas a interacciones de dispersión relativamente débiles en Londres. Debido a que el heptano forma una cadena más larga que el pentano, habrá una interacción ligeramente mayor entre las moléculas de heptano que entre las moléculas de pentano. Por lo tanto, el pentano tiene la mayor presión de vapor.
Ejercicio\(\PageIndex{5}\)
Explicar las diferencias en las viscosidades de los siguientes compuestos (enumerados en centipoise, cP, o milipascal-segundos, MPa. s).
- éter dietílico, CH 3 CH 2 OCH 2 CH 3 (0.22) vs. 2-butanona, CH 3 (CO) CH 2 CH 3 (0.41)
- decano, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 (0.70) vs hexano, CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 (0.26)
- éter dietílico, CH 3 CH 2 OCH 2 CH 3 (0.22) vs. 1-butanol, CH 3 CH 2 CH 2 CH 2 OH (2.54)
- Respuesta a:
-
El enlace C=O 2-butanona tiene un dipolo sustancial, pero los dipolos en éter no suman mucho; son más pequeños para empezar y cancelan parcialmente vía adición vectorial. Las moléculas de 2-butanona se adhieren más fuertemente, lo que resulta en una mayor viscosidad.
- Respuesta b:
-
Ambas moléculas están limitadas a interacciones de dispersión relativamente débiles en Londres. Debido a que el decano forma una cadena más larga que el hexano, habrá una interacción ligeramente mayor entre las moléculas de decano que entre las moléculas de hexano. El decano tiene así la mayor viscosidad. Posteriormente, si estudias macromoléculas, verás que en cadenas muy, muy largas, el “enredo” se convierte también en factor. Así como su nombre lo indica, cadenas realmente largas se enredan juntas y tienen dificultades para pasar unas de otras; por eso materiales como el aceite de cocina y el aceite de motor son tan viscosos.
- Respuesta c:
-
El 1-butanol puede unirse por hidrógeno, pero el éter solo tiene interacciones dipolo-dipolo débiles. El 1-butanol es por lo tanto más viscoso.
Ejercicio\(\PageIndex{6}\)
Explicar las diferencias en las tensiones superficiales de los siguientes compuestos (enumerados en dinas/cm).
- 1-butanol, CH 3 CH 2 CH 2 CH 2 OH (25) vs éter dietílico, CH 3 CH 2 OCH 2 CH 3 (16)
- 1-butanol, CH 3 CH 2 CH 2 CH 2 OH (25) vs 1,3-butanodiol, HOCH 2 CH 2 CH (OH) CH 3 (47)
- formamida, H (CO) NH 2 (57) vs nitrometano, CH 3 NO 2 (36)
- Respuesta a:
-
El 1-butanol puede unirse por hidrógeno, pero el éter solo tiene interacciones dipolo-dipolo débiles. Por lo tanto, el 1-butanol tiene mayor tensión superficial.
- Respuesta b:
-
El 1-butanol puede unirse por hidrógeno, pero el 1,3-butanodiol tiene dos grupos OH y puede formar incluso más enlaces de hidrógeno que el 1-butanol. Por lo tanto, el 1,3-butanodiol tiene mayor tensión superficial.
- Respuesta c:
-
La formamida tiene enlaces N-H y por lo tanto es capaz de formar enlaces de hidrógeno. A pesar de tener un dipolo bastante grande y maldito, el nitrometano realmente no puede unir el hidrógeno. Por lo tanto, la formamida tiene mayor tensión superficial.
No es necesario tener datos frente a usted para comparar las propiedades de dos compuestos. Al menos hasta cierto punto, es posible que pueda observar dos estructuras similares y hacer una conjetura educada sobre cuál se derretirá o evaporará más fácilmente que la otra, siempre que tengan diferentes grupos funcionales que pueda comparar. Conocer algo sobre la estructura tiene valor explicativo; puedes explicar las diferencias con base en la estructura. También tiene valor predictivo: se pueden predecir diferencias en función de la estructura.
Ejercicio\(\PageIndex{7}\)
En los siguientes pares de isómeros, ¿cuál se esperaría que tuviera el punto de ebullición más alto?
- 2-propenol, CH 2 CHCH 2 OH vs propanal, CH 3 CH 2 CHO
- pentanoato de etilo, CH 3 CH 2 O 2 CCH 2 CH 2 CH 2 CH 3 vs ácido heptanoico, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CO 2 H
- 1-hexen-3-ona, CH 2 CHCOCH 2 CH 2 CH 3 vs éter dialílico, (CH 2 CHCH 2) 2 O
- Respuesta a:
-
2-propenol. Tiene capacidad de enlace de hidrógeno pero el propanal no.
- Respuesta b:
-
ácido heptanoico. Tiene capacidad de enlace de hidrógeno pero el pentanoato de etilo no.
- Respuesta c:
-
1-hexen-3-ona. Su dipolo es mayor que el del éter, porque proviene de un enlace C=O en lugar de enlaces C-O.
Ejercicio\(\PageIndex{8}\)
En los siguientes pares de isómeros, ¿cuál se esperaría que tuviera la viscosidad más alta?
- 2-butanona, CH 3 COCH 2 CH 3 vs metil alil éter, CH 3 OCH 2 CHCH 2
- pentano, CH 3 CH 2 CH 2 CH 2 CH 3 vs octano, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3
- dimetoxietano, CH 3 OCH 2 CH 2 OCH 3 vs 1,3-butanodiol, HOCH 2 CH 2 CH (OH) CH 3
- Respuesta a:
-
2-butanona. Su dipolo es mayor que el del éter, porque proviene de un enlace C=O en lugar de enlaces C-O.
- Respuesta b:
-
octano. Tiene mayores interacciones de dispersión en Londres que el pentano debido a la mayor área de contacto superficial en octano.
- Respuesta c:
-
1,3-butanodiol. Tiene enlaces de hidrógeno pero el DME no.
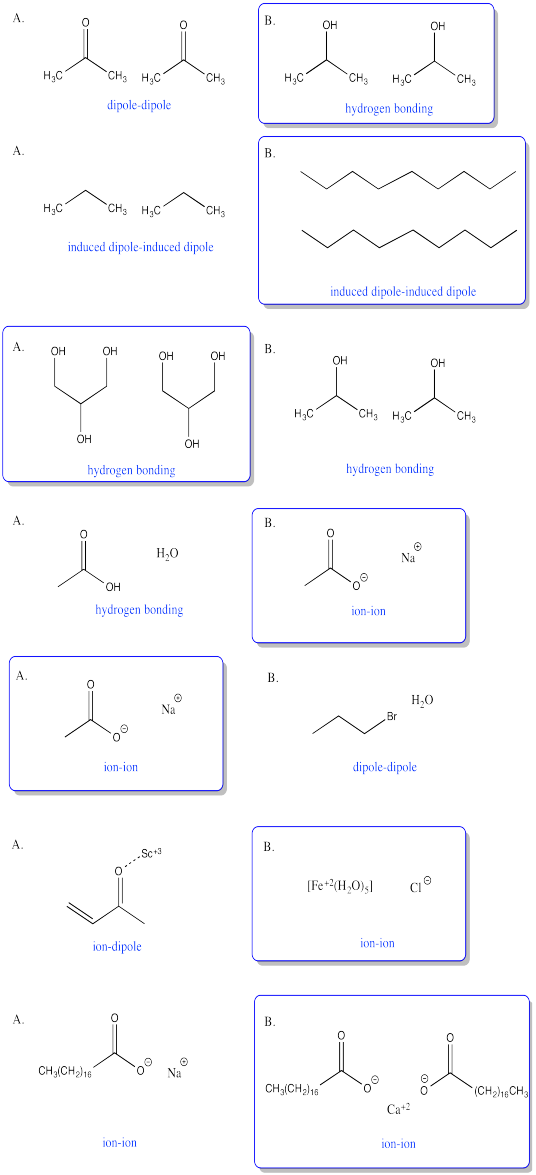
Ejercicio\(\PageIndex{9}\)
En cada una de las siguientes preguntas, tienes la opción entre A y B. Elige qué opción en qué atracciones más fuertes están presentes.
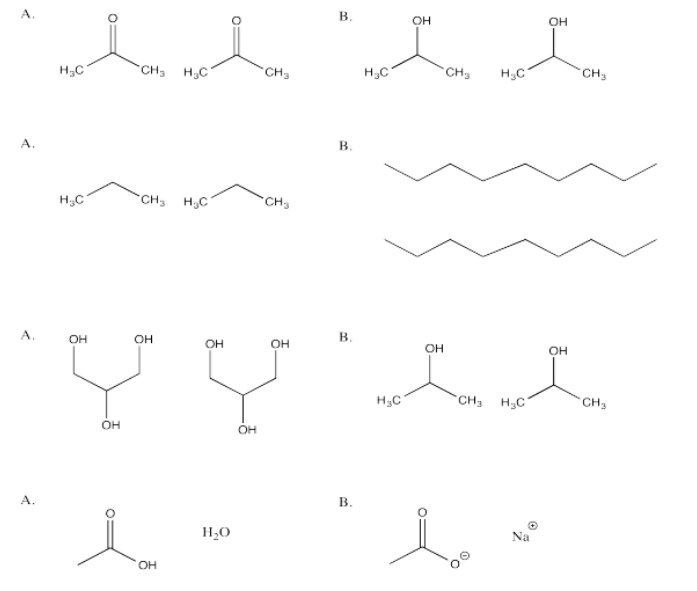
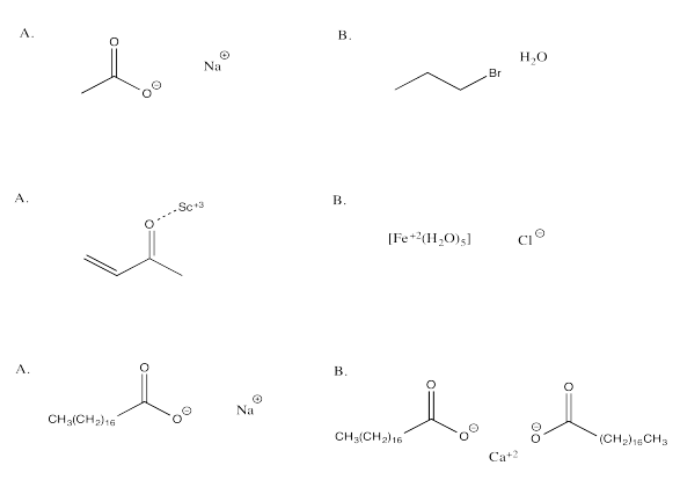
- Responder
-