7.9: Miscibilidad
- Page ID
- 80718
Hasta ahora, hemos estado pensando en cómo una molécula podría interactuar con otra molécula del mismo compuesto para formar un líquido o un sólido. ¿Qué pasa con dos compuestos diferentes? Resulta que si dos compuestos diferentes interactúan entre sí depende del mismo tipo de interacciones que hemos visto hasta ahora.
Dos líquidos que realmente no se mezclan bien, como el aceite y el agua, se describen como inmiscibles. Se dice que dos líquidos que parecen mezclarse completamente juntos son miscibles. El agua y el etanol son un ejemplo de un par de líquidos miscibles, porque puedes tomar cualquier cantidad de etanol y mezclarlo con cualquier cantidad de agua y siempre terminarás con un líquido transparente e incoloro como los que empezaste con.
Ejercicio\(\PageIndex{1}\)
¿Qué tipo de atracción intermolecular permite que el agua y el etanol se mezclen?
- Responder
-
Enlace de hidrógeno.
Ejercicio\(\PageIndex{2}\)
Los siguientes pares de líquidos son miscibles. Identificar el tipo predominante de atracción intermolecular entre cada par.
- 2-propanona y etanoato de etilo (acetato de etilo)
- pentano y octano
- diclorometano y 2-butanona
- metanol y ácido etanoico
- Respuesta a:
-
interacciones dipolo
- Respuesta b:
-
Interacciones en Londres
- Respuesta c:
-
interacciones dipolo
- Respuesta d:
-
enlaces de hidrógeno
Ejercicio\(\PageIndex{3}\)
Explique, en términos de fuerzas intermoleculares, por qué el agua y el octano no son miscibles.
- Responder
-
Las moléculas de agua interactúan entre sí principalmente a través de enlaces de hidrógeno, mientras que las moléculas de octano interactúan entre sí a través de las interacciones El principal problema aquí es el fuerte enlace de hidrógeno entre las moléculas de agua. Todas las moléculas, en principio, podrían interactuar entre sí a través de las interacciones de Londres. Sin embargo, si se introdujeran moléculas de octano entre las moléculas de agua, ocuparían espacio. Algunas de las moléculas de agua ya no podrían acercarse lo suficiente entre sí al enlace de hidrógeno. La pérdida de esa interacción tan estabilizadora sería demasiado costosa.
Ejercicio\(\PageIndex{4}\)
Explique, en términos de fuerzas intermoleculares, por qué el etanitrilo y el hexano no son miscibles.
- Responder
-
Este problema es similar al anterior, pero en este caso la atracción entre los dipolos fuertes de los grupos nitrilo sería demasiado para superar.
En ocasiones, las atracciones entre moléculas son un poco más complicadas. Dos moléculas pueden tener diferentes interacciones por sí mismas, pero cuando se colocan juntas aún logran interactuar entre sí. Por ejemplo, el diclorometano y el hexano se mezclan bastante bien.
¿Cómo puede ser eso? El diclorometano tiene interacciones dipolares. El hexano no tiene nada más que las interacciones de Londres. El etanitrilo y el hexano no se mezclaron por esa misma razón. Pero el problema no era si esas dos moléculas podían interactuar entre sí; sí podían. El problema era que el etanitrilo no renunciaría a sus interacciones dipolo-dipolo por la pequeña cantidad que podría ganar al mezclarlo con hexano.
En este caso, los dipolos entre diclorometano son mucho más pequeños; no se retienen de las moléculas de hexano con tanta fuerza. Por otro lado, la interacción entre el hexano y el diclorometano en realidad se amplifica un poco. Mientras que las moléculas de hexano dependen únicamente de interacciones débiles y transitorias de Londres para adherirse entre sí, el diclorometano tiene un dipolo permanente. Ese dipolo permanente es capaz de potenciar el dipolo transitorio en hexano.
Esto se llama interacción dipolo/dipolo inducido. El ligero tirón que el diclorometano ejerce sobre los electrones del hexano en realidad ayuda a que las dos moléculas diferentes interactúen más fuertemente.
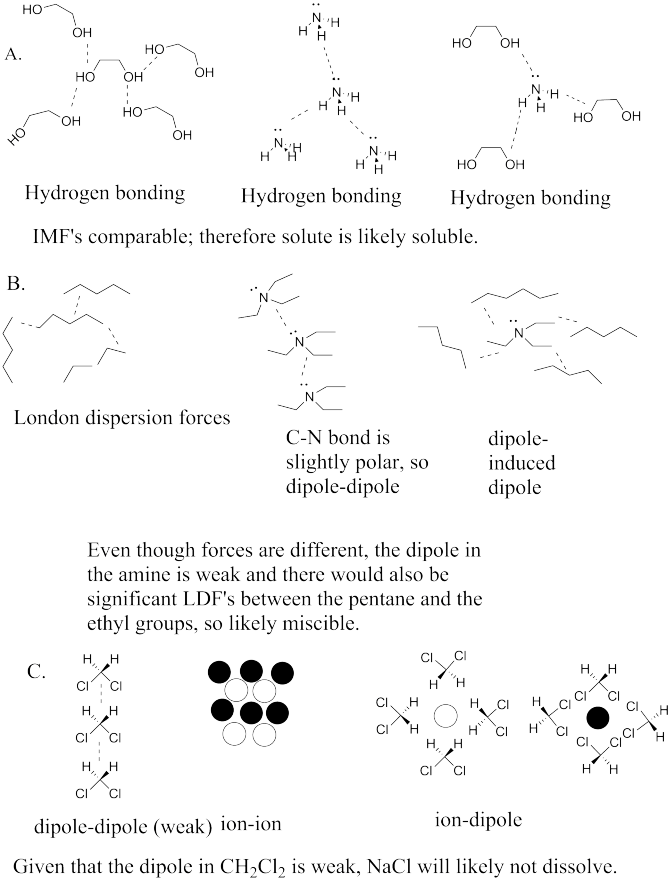
Ejercicio\(\PageIndex{5}\)
A continuación se presentan varios disolventes y algunos posibles solutos. Para cada par,
i. Dibujar una molécula solvente que interactúe con varias otras moléculas solventes (idénticas). Marque la fuerza intermolecular más fuerte que los mantiene unidos.
ii. Dibujar una molécula de soluto interactuando con varias otras moléculas de soluto (idénticas). Marque la fuerza intermolecular más fuerte que los mantiene unidos.
iii. Dibujar una molécula de soluto interactuando con varias moléculas de disolvente. Marque la fuerza intermolecular más fuerte que los mantiene unidos. Predecir si el disolvente disolverá cantidades significativas del soluto.
A. Disolvente = Etilenglicol (HOCH 2 CH 2 OH); Soluto = NH 3
B. Solvente = Pentano (CH 3 (CH 2) 2 CH 3); Soluto = trietilamina, [(CH 3 CH 2) 3 N]
C. Solvente = CH 2 Cl 2; Soluto = NaCl
- Responder
-
Ejercicio\(\PageIndex{6}\)
Describir la interacción intermolecular entre cada uno de los siguientes pares.
a) 2-propanona; benceno
b) 2-propanol; diclorometano
c) etanol; ácido etanoico
d) octanol; metilbenceno
- Respuesta a:
-
dipolo/dipolo inducido
- Respuesta b:
-
dipolo/dipolo
- Respuesta c:
-
enlaces de hidrógeno
- Respuesta d:
-
dipolo/inducir dipolo
La solubilidad es conceptualmente similar a la miscibilidad. Si puedes mezclar un sólido con un líquido y la partícula sólida se hace cada vez más pequeña hasta que desaparece, debe haberse disuelto en el líquido. En ese punto puede parecer que te quedas solo con el líquido original, pero realmente las moléculas individuales del sólido simplemente se distribuyen por todo el líquido en lugar de que todas se sientan juntas en el fondo. Esto se puede ver cuando el polvo de kool-aid azul se disuelve en agua para dar kool-aid azul. La sustancia azul no ha desaparecido; se ha mezclado íntimamente con el agua. Así como no se puede ver un “pedazo” individual de agua, ya no se puede ver un “pedazo” individual del sólido original —se ha separado en unidades individuales (moléculas) que son demasiado pequeñas para ser vistas.

