7.10: Solubilidad
- Page ID
- 80717
Para que dos sustancias sean miscibles, o para que una sustancia sea soluble en otra, los dos tipos de moléculas deben interactuar entre sí. No sólo eso, sino que debe haber una atracción lo suficientemente fuerte de un tipo de molécula por la otra para que estén dispuestos a alejarse de sus hermanos idénticos. Si las fuerzas atractivas entre las moléculas diferentes son lo suficientemente fuertes como para superar esas fuerzas entre ambos conjuntos de moléculas similares, resulta la disolución.
La sal de mesa se disuelve en agua porque las moléculas de agua muy polares atraen tanto a los iones de sodio cargados positivamente como a los iones de cloruro cargados negativamente. Esta interacción se llama interacción ión/dipolo.
Para distribuir los cationes de sodio y los iones cloruro por toda la solución, algunas de las moléculas de agua pueden necesitar alejarse unas de otras para dejar espacio para los iones. Algunos de los fuertes enlaces de hidrógeno pueden perderse, pero la energía necesaria para superar esas interacciones es compensada por la atracción entre el dipolo del agua y los iones sodio o cloruro.
Otras sales se disuelven en agua, también, pero algunas de ellas se disuelven más fácilmente que otras. Podrías disolver fácilmente alrededor de 360 g de sal de mesa en un litro de agua, pero la solubilidad del carbonato de calcio es de solo unos 0.01 gramos por litro. Eso se debe en parte a que los iones en cloruro de sodio, Na + y Cl-, tienen cargas menores que los iones en carbonato de calcio, Ca 2+ y CO 3 2-. Cuanto mayores sean las cargas sobre los iones, más fuerte será su atracción electrostática entre sí, y más difícil es para el agua separarlos. También es algo bueno; si el carbonato de calcio en mármol se disolviera con demasiada facilidad, piense en cuántos edificios y estatuas se disolverían bajo la lluvia.
Ejercicio\(\PageIndex{1}\)
Clasifique las siguientes sales de más fácilmente a menos fácilmente disueltas en agua: MgSO 4, LiCl, AlPO 3
- Responder
-
El orden previsto, de más soluble a menor, sería LiCl > MgSO 4 > AlPO 4 porque los iones aumentan en carga de 1+/- a 2+/- a 3+/-
Sin embargo, los factores que controlan la solubilidad de los iones pueden ser complejos. Por ejemplo, las cargas sobre los iones también afectan la fuerza de la interacción con las moléculas de agua. Los iones altamente cargados interactúan más fuertemente entre sí, pero también interactúan más fuertemente con las moléculas de agua.
Existen otros solventes que pueden disolver sales a través de interacciones ión/dipolo. Normalmente tendrían dipolos fuertes. Sin embargo, no muchos solventes tienen dipolos tan fuertes como el del agua.
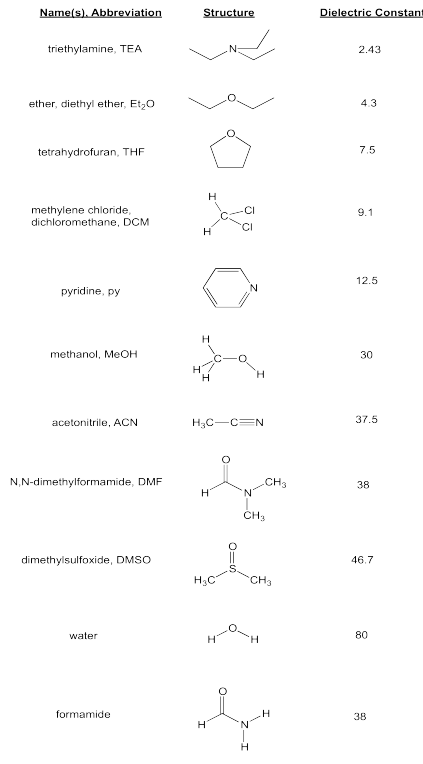
Ejercicio\(\PageIndex{2}\)
¿Cuál de los siguientes disolventes sería más capaz de disolver algo de LiCl? Rango de mayor solubilidad a menor solubilidad.
trietilamina, dimetilsulfóxido, diclorometano, acetonitrilo, piridina.
- Responder
-
El orden previsto, de más soluble a menor, sería
dimetilsulfóxido > acetonitrilo > piridina > diclorometano > trietilamina.
Por supuesto, no son solo las sales las que pueden disolverse en solventes. Otros sólidos también pueden, si pueden interactuar con las moléculas de solvente con suficiente fuerza. El azúcar también se disuelve bastante bien en agua. ¿Por qué crees que es así?
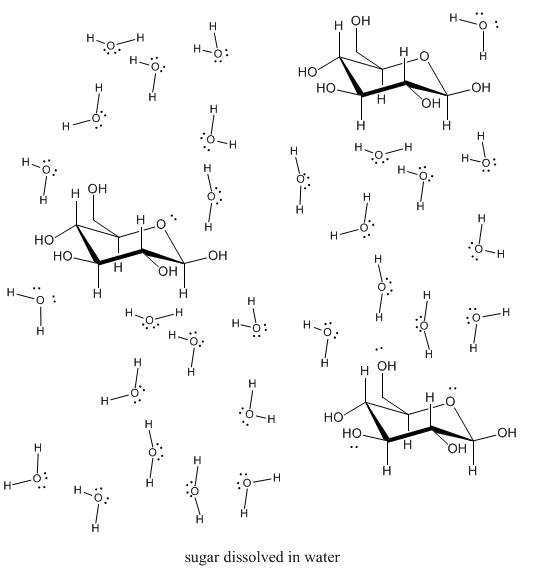
Los azúcares, por supuesto, pueden formar enlaces de hidrógeno fácilmente con el agua, por lo que suelen ser bastante solubles.

