7.11: Aceptores de enlaces de hidrógeno
- Page ID
- 80719
El formaldehído es otro ejemplo de un compuesto que se disuelve bien en agua, y de hecho la forma más común de obtener formaldehído es como una solución acuosa. Es posible que haya encontrado una solución de este tipo en un laboratorio de anatomía o biología general, porque las soluciones de formaldehído se utilizan como conservantes para especímenes biológicos. Por supuesto, el agua y el formaldehído son moléculas polares, por lo que es fácil imaginar que sus dipolos interactúan entre sí. Sin embargo, el formaldehído no tiene enlaces de hidrógeno muy fuertes como el agua, por lo que a primera vista parece como si el formaldehído pudiera no interactuar con las moléculas de agua tan fuertemente como las moléculas de agua interactúan entre sí.
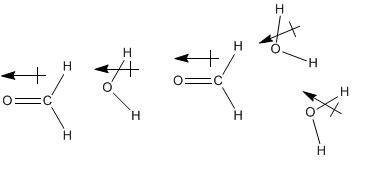
En realidad, la interacción entre estas moléculas puede ser más fuerte de lo que parece al principio. Aunque el formaldehído no se involucra en fuertes enlaces de hidrógeno por sí mismo, en presencia de agua u otro compuesto prótico —uno que contiene un hidrógeno muy positivo, como H 2 O, HF o NH 3 —, se forman fuertes enlaces de hidrógeno.
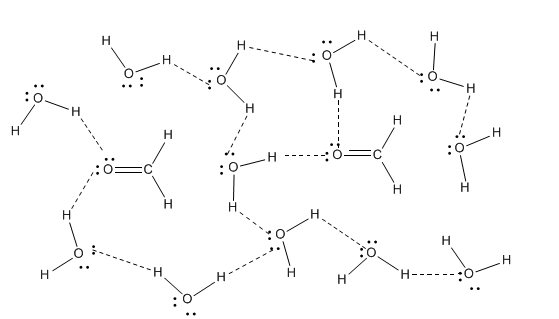
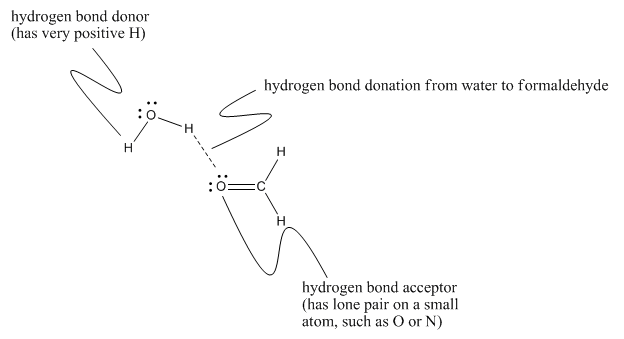
Esto ocurre porque el formaldehído tiene un átomo de oxígeno con pares solitarios y así puede actuar como aceptor de enlaces de hidrógeno. Eso significa que puede participar en enlaces de hidrógeno con algo que sí tiene hidrógenos positivos que pueden interactuar con sus pares solitarios. El agua en este caso está actuando como donador de enlaces de hidrógeno para el formaldehído. Los aceptores de enlaces de hidrógeno suelen ser importantes en los sistemas biológicos, donde casi todo ocurre en presencia de agua.
Ejercicio\(\PageIndex{1}\)
¿Cuáles de los siguientes compuestos son capaces de formar enlaces de hidrógeno? ¿Cuáles son los aceptores de enlaces de hidrógeno? ¿Cuáles son ninguno?
a) trietilamina
b) pentanal
c) etilamina
d) éter dietílico
e) butanamida
f) hexeno
- Respuesta a:
-
Aceptador H-bond
- Respuesta b:
-
Aceptador H-bond
- Respuesta c:
-
Completamente H-bonding
- Respuesta d:
-
Aceptador H-bond
- Respuesta e:
-
Completamente H-bonding
- Respuesta f:
-
ni

