7.12: Mezclas Heterogénicas
- Page ID
- 80723
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)¿Por qué el aceite no se disuelve en agua? El petróleo está compuesto, en parte, de largas cadenas de átomos de carbono con hidrógenos unidos. Estas cadenas no son muy polares. No debería ser demasiado difícil separarlos, porque solo se mantienen unidos por las interacciones londinenses. Las cadenas realmente no son lo suficientemente largas como para crear las fuertes interacciones de Londres que evitarían que el petróleo se mezcle con el agua.
Por otro lado, es bastante difícil separar las moléculas de agua unas de otras, y el petróleo no tiene los medios para hacerlo; simplemente no es lo suficientemente polar. Si las moléculas de agua no se alejan unas de otras, no habrá espacio entre ellas para que las moléculas de aceite individuales se disuelvan. Estas dos sustancias no se mezclarán muy bien.
En consecuencia, si se colocan en el mismo recipiente, permanecerán separados y formarán dos capas diferentes. La capa más densa (el agua) se hundirá hasta el fondo mientras que la más ligera, menos densa (el aceite) flotará hasta la parte superior.
La misma situación es cierta para una serie de otros compuestos orgánicos no polares, como el benceno y el tolueno. Estos líquidos son demasiado no polares para disolverse muy bien en el agua. En consecuencia, si mezclas benceno y agua, los dos líquidos formarán dos capas separadas. El benceno tiene una densidad o densidad específica de 0.874 g/mL, mientras que la densidad del agua es 1.0 g/mL. Como resultado, el benceno flotaría en la parte superior, mientras que el agua se hundiría hasta el bttom. Mezclar las dos capas tan duro como puedas puede producir una mezcla temporal (la mezcla formaría una especie de desorden turbio y brillante llamado schlieren), pero una vez que se dejan solos el benceno y el agua se separarían nuevamente.
Hay un ejemplo más útil que deberíamos mirar. Supongamos que tenemos una molécula que es muy polar en un extremo, pero no polar en el otro. El jabón, por ejemplo, es un compuesto iónico, pero si bien el catión suele ser solo un ion de sodio, el anión es más complicado. Este anión molecular suele contener un “grupo carboxilato” muy polar, compuesto por un carbono con dos oxígenos unidos. También contiene una cadena de carbono muy larga, al igual que en el aceite. Entonces una parte de la molécula debe disolverse bien en agua, mientras que la otra no. Hay una compensación, y se alcanzará un equilibrio que determine exactamente qué tan soluble es el jabón en el agua. Curiosamente, cuando se colocan en agua, estas moléculas de jabón se dispondrán en grupos para que los extremos polares miren hacia afuera, hacia el agua, mientras que los extremos no polares se meten en el interior. Piense en la escena de “rodear los vagones” en una película clásica del western.
Hay dos razones por las que este fenómeno es útil. La formación de micelas, como se llama el comportamiento, permite que sustancias no polares, como la suciedad y los aceites, se disuelvan en el agua polar. La suciedad puede interactuar perfectamente bien con las colas de jabón no polares, y así terminará en medio de las micelas, y algo que no podría disolverse en agua corriente resulta ser perfectamente soluble en agua jabonosa. Pero a otro nivel, la formación de micelas es un muy buen modelo para algunos de los fenómenos de la biología celular y molecular. Por ejemplo, las membranas celulares están compuestas por moléculas que son algo similares a las moléculas de jabón. Estas moléculas forman agrupaciones similares a las micelas grandes, pero con una capa adicional de moléculas en el interior del círculo, con sus extremos polares apuntando hacia adentro. Eso deja los extremos no polares de ambas capas intercalados entre sí, fuera del agua. Las proteínas también tienen regiones polares y no polares, y alejar las regiones no polares del agua lleva a la proteína a adoptar una forma específica que, a su vez, determina el comportamiento de la proteína.
Ejercicio\(\PageIndex{1}\)

- Respuesta a:
-
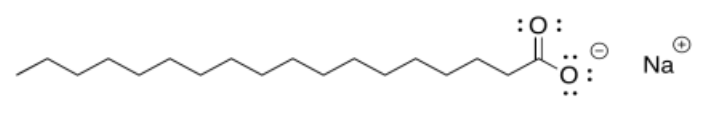
- Respuesta b:
-
La cola es no polar e hidrofóbica. La cabeza es polar e hidrofílica.
- Respuesta c:
-
dipolo inducido - dipolo inducido
dipolo inducido por iones
dipolo inducido por dipolo
ión-dipolo
- Respuesta d:
-
No. El dipolo inducido por dipolo es demasiado débil para superar los enlaces de hidrógeno entre las aguas.
- Respuesta e:
-
Dipolo iónico entre el agua y la cabeza hidrofílica del jabón.
- Respuesta f:
-
afuera
- Respuesta f:
-
El agua es atraída por las cabezas hidrofílicas para formar esta fuerte interacción ión-dipolo, mientras que las colas no pueden superar el fuerte enlace de hidrógeno de las interacciones agua-agua.
- Respuesta g:
-
La suciedad y la grasa hidrofóbicas preferirán interactuar con las colas hidrófobas (dentro de las micelas).
- Respuesta h:
-
La grasa será encapsulada en la micela y lavada en agua.

