7.13: Atractivos intermoleculares y estructura proteica
- Page ID
- 80716
Las atracciones intermoleculares aportan una parte crucial al comportamiento de los materiales cotidianos que nos rodean. En biología, las atracciones que involucran biomoléculas son esenciales para su función. Para hacernos una idea del papel que juegan las atracciones intermoleculares, como los enlaces de hidrógeno, en biología, veamos un tipo común de biomolécula: las proteínas.
Recuerde que las proteínas son polímeros formados por muchos aminoácidos unidos entre sí ny enlaces peptídicos. A continuación se muestra una estructura explícita etiquetada con un átomo. Además, hay una estructura esquelética abreviada por debajo de esa. Este dibujo lineal no etiqueta explícitamente los átomos de carbono; ni siquiera muestra dónde están los átomos de hidrógeno si están conectados a los carbonos. Se supone que solo debes saber que están ahí. El trade-off es una imagen mucho más limpia y simple.
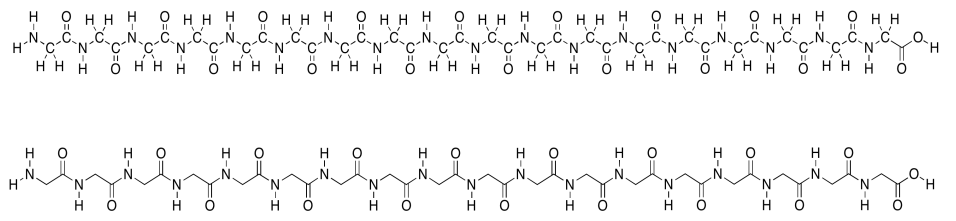
En la estructura lineal, podemos ver fácilmente el esqueleto en zig-zag de la cadena proteica. Periódicamente a lo largo de esa cadena podemos ver un enlace amida (N-C=O). Los enlaces amida se han formado uniendo el extremo amino de un aminoácido al extremo carboxílico de otro.
Esta cadena de aminoácidos no es muy larga; probablemente ni siquiera la llamaríamos proteína, porque las proteínas son mucho más grandes que eso. Simplemente lo llamaríamos un polipéptido o un oligopéptido —este último término significa que hay un montón de aminoácidos en esta cadena, pero ni siquiera lo suficiente como para considerarlo un verdadero polímero. El oligopéptido particular que estamos viendo es una molécula de poli (glicina). Todos los aminoácidos son el mismo monómero: glicina.
Los oligopéptidos, aunque no realmente proteínas, son importantes a su manera. A menudo se usan como moléculas de señalización porque su pequeño tamaño les permite viajar con relativa facilidad por todo un organismo. La mayoría de las proteínas y oligopéptidos están compuestos por diferentes aminoácidos. Sólo para ilustrar esta idea, a continuación se muestra un ejemplo; se trata de una cadena de siete aminoácidos.
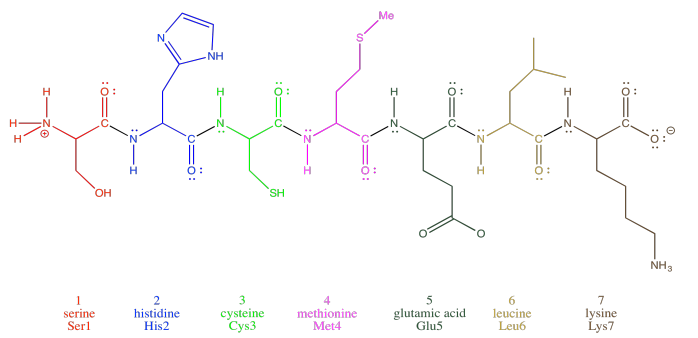
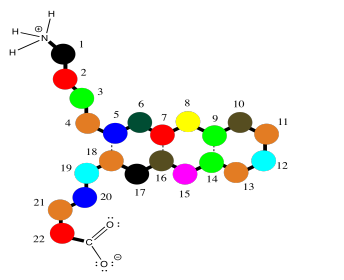
Para ayudar a describir su estructura, las proteínas y los péptidos suelen estar numerados, comenzando desde el extremo amino de la cadena (observe que “oligopéptido” y “polipéptido” son un poco bocados, por lo que a menudo se acortan al término más general “péptido”). A menudo, si un investigador quiere discutir un aminoácido en particular a lo largo de la cadena, enumerará tanto su número como su identidad de aminoácidos. Los aminoácidos difieren entre sí por su “cadena lateral” o “residuo”; esa es la parte que cuelga de la columna principal. Si las moléculas de agua no se alejan unas de otras. Por ejemplo, la cadena lateral de serina es un grupo CH 2 OH; la metionina es un grupo CH 2 CH 2 SC3. Entonces, cuando estás leyendo el último artículo en ese número de Bioquímica has estado esperando toda la semana, y mencionan que Ser237 juega un papel crucial en catalizar la formación de un importante neurotransmisor, están hablando de un residuo particular de serina unido en la posición 237 de la proteína, contando desde el extremo del nitrógeno.
Esas estructuras proteicas pueden complicarse un poco, simplemente porque las moléculas son muy grandes. Sin embargo, la idea básica de la estructura es bastante simple. La misma cadena principal en zig zag se extiende por toda la molécula, y los residuos están espaciados uniformemente a lo largo de la cadena principal. Aquí, podemos representar esos diferentes residuos como puntos coloreados. La estructura empieza a parecerse un poco a una serie de diferentes globos atados a un tendedero.
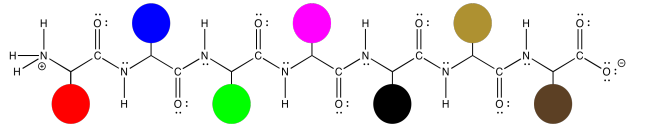
Eso no es para ver que las estructuras de esas cadenas laterales no sean importantes. Son muy importantes, y nos pondremos en contacto con ellos un poco más tarde. A veces, sin embargo, tienes que decidir en qué necesitas enfocarte ahora mismo, y puede ser que queramos mirar la columna vertebral sin la distracción de todas esas estructuras de cadena lateral.
De hecho, incluso la columna vertebral podría ser demasiado detalle. A lo mejor solo queremos tener en cuenta que estamos tratando con un polímero, una larga cadena de aminoácidos unidos entre sí. Podríamos recurrir a un dibujo aún más simple de cuentas de colores en una cuerda para significar esa cadena.
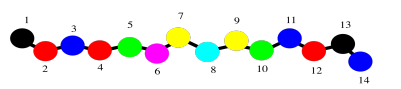
Ahora vamos a quedarnos con las cuentas simples en una imagen de cuerda por un minuto para pensar en la estructura proteica. Ese simple orden de aminoácidos —que uno está en el extremo amino de la cadena, quién viene después de eso, y quien viene después de eso, hasta el extremo carboxilato de la cadena— se llama la estructura primaria de la proteína. La estructura primaria es exactamente qué aminoácidos se encuentran en la proteína, y en qué orden.
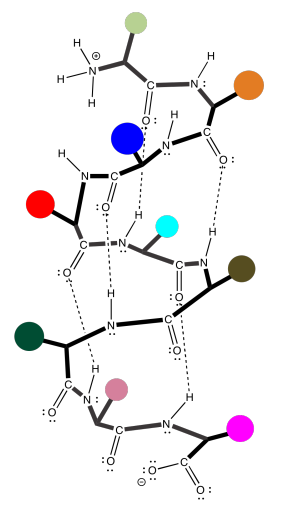
La estructura secundaria es un segundo nivel de detalle sobre la proteína. Comienza a describir la forma tridimensional de la estructura. Ahí es donde las atracciones intermoleculares entran en escena. Una proteína, al ser una cadena muy larga, suele llegar atrás e interactuar consigo misma. Realmente, deberíamos llamar a estos atractivos intramoleculares, ya que están dentro de una misma molécula. Las interacciones podrían involucrar diferentes cadenas laterales de la proteína, pero frecuentemente también involucran la columna vertebral. Recuerde, la cadena principal tiene mucho oxígeno carbonilo capaz de donar un par solitario, y muchos enlaces amida N-H capaces de donar un protón, por lo que los enlaces de hidrógeno a lo largo de la cadena principal son muy importantes. La caricatura a continuación intenta sugerir una cadena que se ha vuelto a su lado, y se mantiene en su lugar por algún tipo de interacciones (las líneas discontinuas).
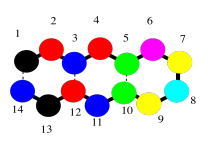
Ese tipo de motivo, en el que una proteína puede girar y correr paralela a sí misma, y puede mantenerse en su lugar por una interacción (específicamente enlaces de hidrógeno), se encuentra en las láminas beta. Las láminas beta son muy comunes en las proteínas.
Desafortunadamente, la caricatura realmente no transmite ningún detalle sobre las atracciones intramoleculares que la mantienen en su lugar. Para verlo, deberíamos echar un vistazo a un ejemplo más detallado. Aquí tenemos nuevamente ese oligómero de poliglicina, y lo estamos usando para ilustrar enlaces de hidrógeno entre dos cadenas para formar una lámina beta. En este caso, hemos dibujado los dos péptidos como dos moléculas separadas. Sin embargo, como en la caricatura, también podríamos tener un péptido largo que retroceda para correr junto a sí mismo.
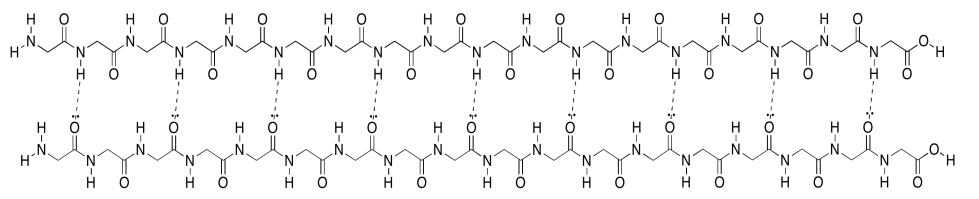
Obsérvese que, en el ejemplo anterior, las dos cadenas corren en la misma dirección (los extremos amino están a la izquierda y los extremos carboxilato están a la derecha). Ese es un ejemplo de lo que se llama una lámina beta paralela. También se puede tener una hoja beta antiparalela, en la que las dos cadenas corren en direcciones opuestas. Eso se ilustra en el siguiente diagrama, usando nuestro dibujo simplificado de globos sobre un tendedero.
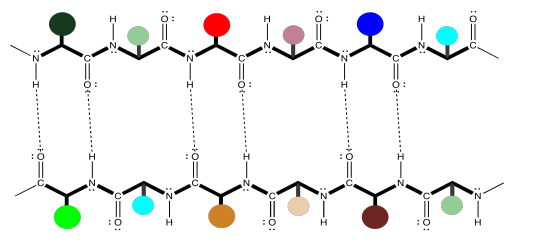
Los enlaces de hidrógeno están espaciados de manera ligeramente diferente en estos dos casos. Una vez más, estas podrían ser dos cadenas peptídicas diferentes que interactúan entre sí, pero es muy común que una cadena sufra un giro y vuelva a alcanzar el enlace de hidrógeno consigo misma. Eso pondría las dos secciones de cadena corriendo antiparalelas entre sí. Esta idea se ilustra en la simple caricatura a continuación.
El caso anterior, de una lámina beta paralela, también es posible en una sola cadena; simplemente implica un giro mucho más largo, de modo que la cadena se articula alrededor para correr en la misma dirección que la sección original. Este caso se ilustra en la caricatura a continuación.
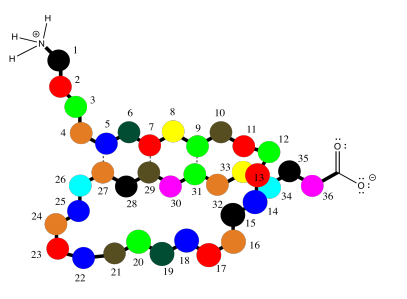
Las láminas beta, de ambos tipos, son muy comunes en las proteínas. También lo son las hélices alfa, en las que una cadena peptídica se arrolla como una escalera de caracol. Se mantiene en esa forma, una vez más, por enlaces de hidrógeno a lo largo de la cadena principal de la proteína.
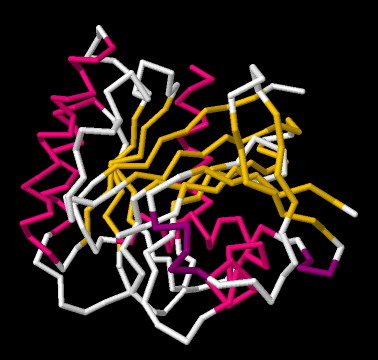
Las láminas beta y las hélices alfa son dos ejemplos comunes de estructura secundaria. Son unidades de organización estructural que frecuentemente aparecen en estructuras proteicas. Mira el siguiente ejemplo; es una imagen de un resultado real de estructura cristalina para una proteína. Los investigadores tomaron esta proteína (en este caso, se llama Proteína de Unión a GTP) y la metieron cuidadosamente en una forma cristalina. Después brillaron rayos X a través del cristal. Al analizar cómo se dispersaban los rayos X a medida que pasaban a través del cristal, podían regresar y determinar dónde estaban todos los átomos. Para eso, podrían obtener esta imagen “llenadora de espacio”, mostrando las posiciones de todos los átomos.

Esa imagen es un poco complicada, pero cada bola redonda en esa masa representa un carbono, oxígeno, nitrógeno o azufre (los átomos de hidrógeno suelen ser demasiado pequeños para detectarlos usando rayos X). Los colores fueron agregados por los investigadores para realizar un seguimiento de partes de la estructura que les interesaban, y, verás en un minuto, las estructuras secundarias.
Si vamos a un modelo más simple, ignoraremos los átomos individuales y simplemente trazaremos esa cadena principal de la proteína. De pronto las cosas se verán mucho menos complicadas.
Ahora bien, si echas un vistazo a la parte rosa del lado izquierdo, casi puedes ver cómo la columna vertebral forma una bobina, como una escalera de caracol. Eso es una hélice alfa. Y esos zig-zags amarillos en el medio parecen estar rastreándose unos a otros. Como una cadena zigzaguea hacia arriba, también lo hace su vecino. Cuando una cadena zigzaguea hacia abajo, su vecino le sigue. Eso es porque están conectados. Están formando una lámina beta.
Por lo que los investigadores simplifican aún más, reemplazando parte de la columna vertebral con una hélice rosa. Reemplazan otras partes de la columna vertebral con cintas amarillas; donde las cintas amarillas corren una al lado de la otra, están formando láminas beta. Las flechas en los extremos de las cintas apuntan hacia el extremo carboxilato de la cadena.
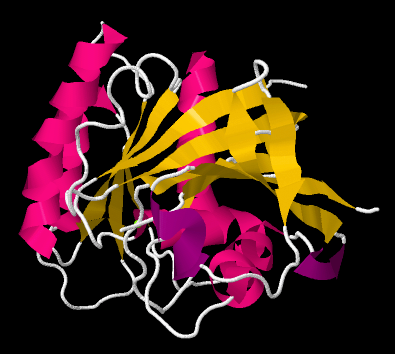
Por lo que una proteína puede contener tanto hélices alfa como láminas beta. También puede contener bucles y giros menos organizados. Ese nivel superior de estructura —cómo se organizan las hojas beta y las hélices alfa y otras cosas en el espacio— se llama estructura terciaria. En una caricatura muy simple, la proteína podría comenzar con un largo de cadena, entrar en una hoja beta, correr a través de otra longitud abierta de cadena o un bucle, y terminar con una hélice alfa. La forma general que forma es la estructura terciaria.
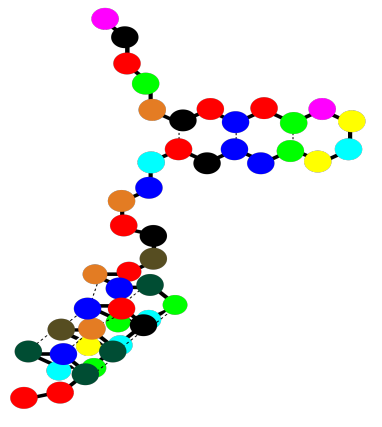
Hay un nivel más de estructura en una proteína, aunque no todas las proteínas tienen esta característica. Se llama la estructura cuaternaria. Una estructura cuaternaria es realmente un cúmulo de más de una proteína, pegadas entre sí. A continuación, la caricatura muestra un dímero. Dos estructuras terciarias idénticas se mantienen unidas por atracciones intermoleculares. La estructura cuaternaria es un ejemplo de lo que se llama un “ensamblaje supramolecular”. Ahí es cuando dos o más moléculas se unen y se aferran fuertemente, formando una estructura más grande que es más grande que una molécula.
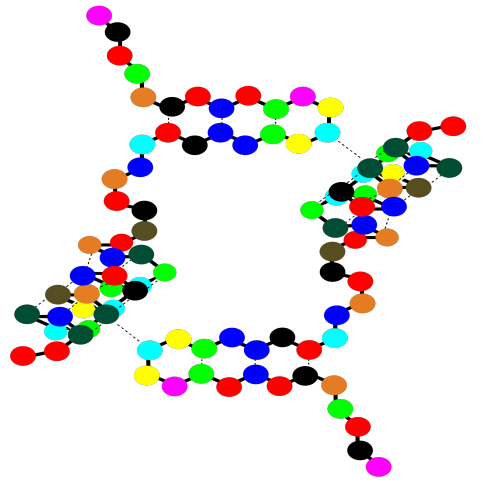
Observe que hay brechas dentro de esa estructura de dibujos animados. Esas brechas pueden ser muy importantes. Por lo general, una proteína se empaca muy apretada y no deja muchos espacios; cuando hay un espacio, suele ser por una razón específica. Una brecha en una proteína puede contener otra molécula. La otra molécula podría ser otra proteína que llega y “atraca” temporalmente mientras se realiza alguna tarea importante. También podría ser una molécula pequeña que necesita unirse con la proteína para lograr algún objetivo.
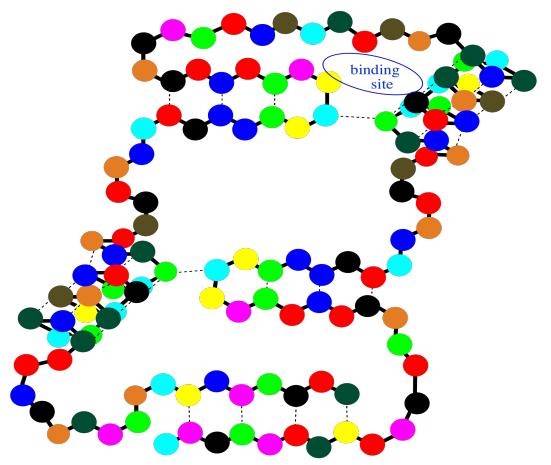
Estos sitios de unión son cruciales para tu supervivencia como organismo. Al mismo tiempo, también son explotados por los médicos cuando recetan un medicamento. El medicamento que te da el médico, la mayoría de las veces, se une en un lugar específico en una proteína específica, ajustando un poco su actividad. Por lo general, consigue que la proteína disminuya la velocidad y tome un descanso, pero en algunos casos puede animarle un poco la proteína y hacerla trabajar más duro. Por supuesto, sea cual sea la pequeña molécula que sea, y lo que sea que esté haciendo ahí, se une a ese “sitio activo” a través de atracciones intermoleculares.

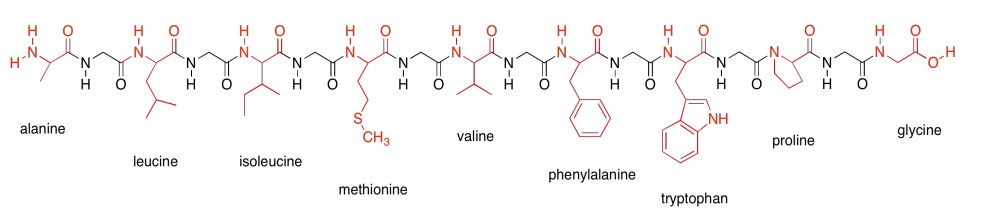
Eso es todo para las estructuras proteicas. Sin embargo, tomemos un minuto para conocer los aminoácidos que componen las proteínas. Los aminoácidos suelen dividirse en cuatro categorías diferentes, en parte en función de su potencial de atracción intermolecular. Aquí están los aminoácidos no polares. A veces se les llama los aminoácidos hidrófobos, porque no pueden formar enlaces de hidrógeno con cosas como el agua. Aquí se muestran conectados en una cadena peptídica, para que puedas ver cómo se verían en una proteína.
En contraste, el siguiente grupo muestra los miembros de los aminoácidos polares. Son mucho mejores en los enlaces de hidrógeno y otras interacciones polares, como las interacciones ión-dipolo.
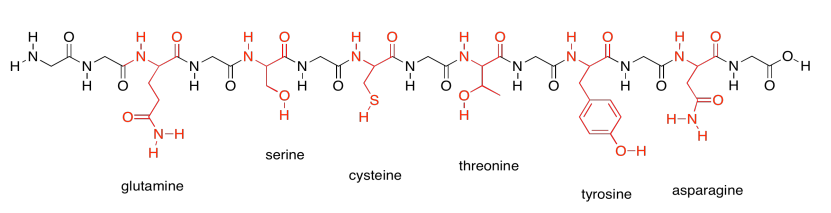
Hay algunos aminoácidos polares que no fueron incluidos en ese último grupo porque son especiales. Estos son los aminoácidos básicos. Sólo hay tres de ellos.
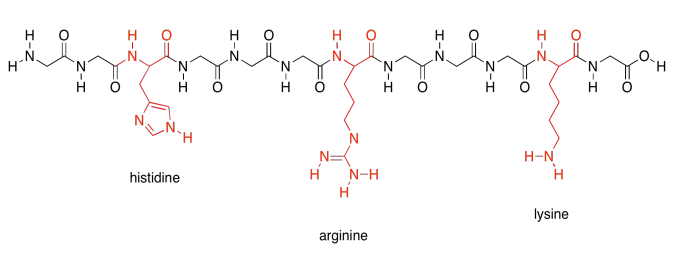
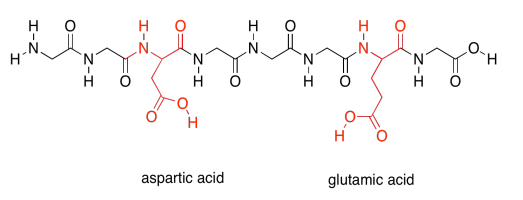
Por último, hay dos polares más especiales. Estos son los aminoácidos ácidos.
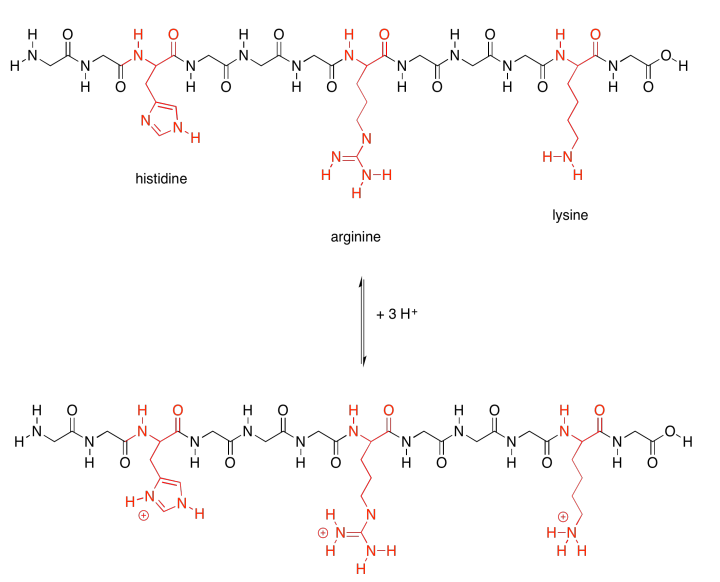
Esos dos últimos grupos son especiales porque cada uno en realidad tiene dos estructuras posibles. Variarán dependiendo de su entorno. Cada uno de los aminoácidos básicos es capaz de recoger un protón extra (un ion H +). Eso es muy importante; ayudan a la proteína a llevar a cabo muchos trabajos importantes moviendo protones alrededor.
Los aminoácidos ácidos, por otro lado, pueden regalar cada uno un protón. También son necesarios para llevar a cabo diferentes tareas por la proteína.

No sólo eso, sino que los aminoácidos ácidos suelen tener una carga negativa en sus cadenas laterales, porque generalmente están en el estado en el que han perdido un protón. Los aminoácidos básicos suelen tener carga positiva en sus cadenas laterales, por razones similares: suelen estar en el estado con un protón extra. Eso significa que estos dos conjuntos de aminoácidos son capaces de atracciones intermoleculares adicionales, tanto dentro de la estructura de la proteína como con otras moléculas que pueden aparecer y unirse a la proteína.
Ejercicio\(\PageIndex{1}\)
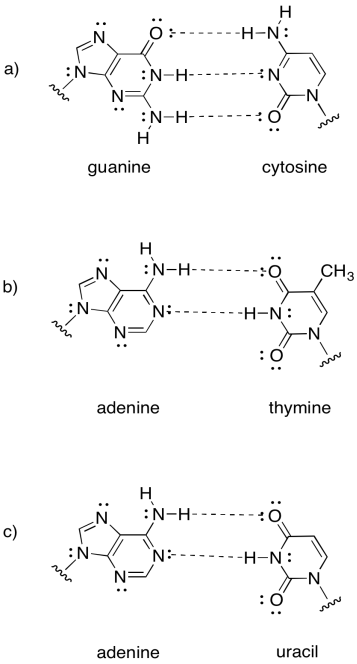
Las atracciones intermoleculares juegan un papel crucial en otras biomoléculas, como el ADN. Una “molécula” de ADN es realmente un ensamblaje supramolecular de dos moléculas separadas. Mostrar cómo los siguientes pares de bases de ADN se sujetarían entre sí.
- Responder
-
Tenga en cuenta que el último ejemplo en realidad se encuentra en el ARN, no en el ADN. El ARN se encuentra como una sola hebra, en lugar de un par de hebras. Se une hidrógeno consigo mismo en una forma particular, no muy diferente de la forma en que una proteína adopta una forma específica.
Ejercicio\(\PageIndex{2}\)
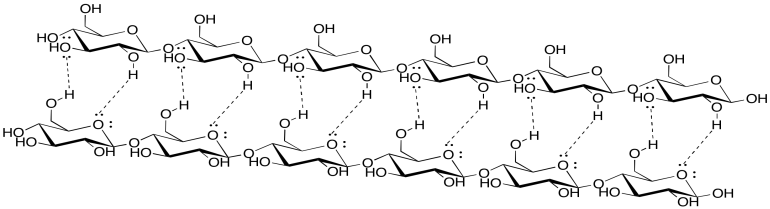
Las atracciones intermoleculares pueden ser importantes en otras biomoléculas, como la celulosa. Mostrar cómo las siguientes cadenas de celulosa podrían sujetarse entre sí.
- Responder
-
Ejercicio\(\PageIndex{3}\)
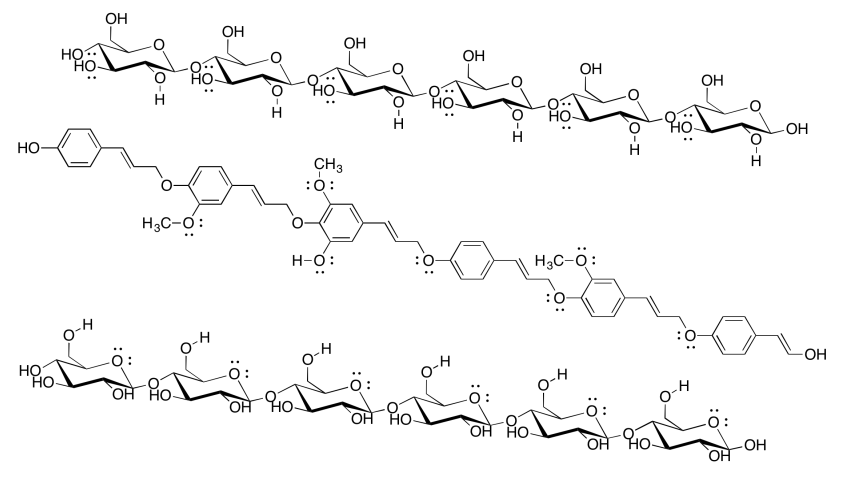
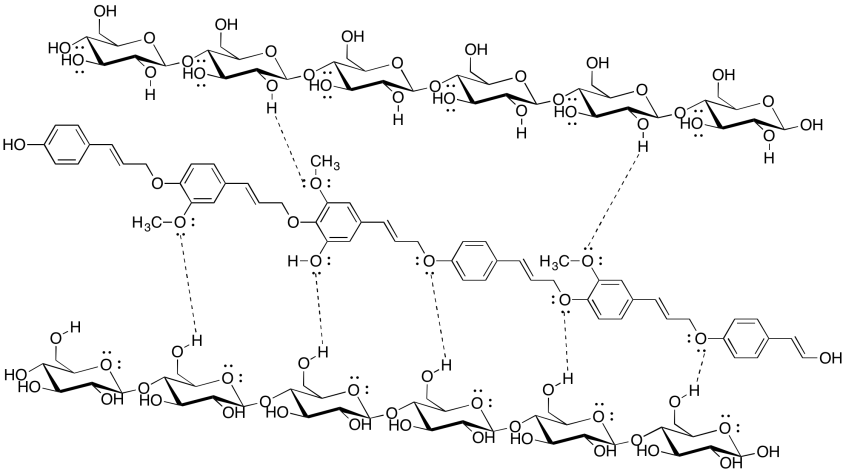
La celulosa es una mercancía de importancia industrial: la utilizamos para hacer ropa y dinero (generalmente de algodón) así como papel (generalmente de madera), por ejemplo. La industria de pulpa y papel gasta una gran cantidad de energía procesando madera para hacer papel, siendo un objetivo importante la eliminación de lignina (que constituye alrededor del 15-30% de la mayoría de las maderas, en comparación con aproximadamente el 30-50% de contenido de celulosa). El siguiente dibujo muestra dos cadenas de celulosa y una cadena de lignina. ¿Por qué las empresas de papel querrían eliminar la lignina?
- Responder
-
Aunque la lignina es capaz de algunos enlaces de hidrógeno, no puede hacer casi tantos enlaces de hidrógeno como la celulosa. El papel que contiene lignina sería mucho más débil, y más probable que se rasgara o se desmorone cuando se moje, porque las moléculas de celulosa no podrían unirse entre sí tan fuertemente con la lignina mezclada. De hecho, las bolsas de papel marrón de la tienda de abarrotes están hechas de kraft, a la que no se le ha quitado la lignina; son mucho más débiles que la mayoría del papel, sobre todo si se mojan.
Ejercicio\(\PageIndex{4}\)
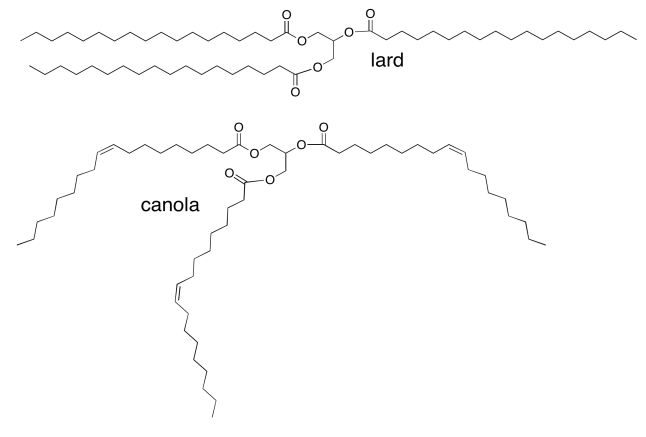
Los aceites vegetales, como el aceite de canola, son ricos en ácidos grasos “insaturados”, en los que las cadenas de ácidos grasos en los triglideridos contienen dobles enlaces C=C. Por ejemplo, el aceite de canola contiene aproximadamente 60% de ácido oleico, una cadena de 18 carbonos con un doble enlace en el medio. Las grasas animales, como la manteca de cerdo, contienen principalmente ácidos grasos saturados (sin dobles enlaces C=C). La manteca de cerdo contiene aproximadamente 30% de ácido esteárico; tiene la misma longitud de cadena que el ácido oleico pero sin el doble enlace. ¿Por qué la canola es un aceite, mientras que la manteca de cerdo es sólida?
- Responder
-
La atracción intermolecular dominante aquí es solo la dispersión de Londres (o solo dipolo inducido). La dispersión londinense es muy débil, por lo que depende fuertemente de mucha área de contacto entre moléculas para construir una interacción apreciable. Los triglicéridos que contienen ácido esteárico podrán empacar mucho más estrechamente que los que contienen ácido oleico más mezclados, por lo que tendrán mucho más contacto superficial y atracciones mucho más fuertes. Ellos se mantendrán unidos en un sólido.
Ejercicio\(\PageIndex{5}\)
Identifique las siguientes imágenes como ilustraciones de hélices alfa o hojas beta.

- Respuesta a:
-
hélice alfa
- Respuesta b:
-
hoja beta
- Respuesta c:
-
hélice alfa
- Respuesta d:
-
hoja beta
- Respuesta e:
-
hoja beta
- Respuesta f:
-
hélice alfa
- Respuesta g:
-
hélice alfa
- Respuesta h:
-
hoja beta
- Respuesta i:
-
hélice alfa
- Respuesta j:
-
hélice alfa
Estructuras cristalinas de rayos X para relleno de espacio, columna vertebral e ilustraciones de dibujos animados: Filchtinski, D.; Sharabi, O.; Ruppel, A.; Vetter, I.R.; Herrmann, C.; Shifman, J.M. Lo que convierte a Ras en un cambio molecular eficiente: un estudio computacional, biofísico y estructural de las interacciones Ras-GDP con mutantes de Raf. m>j. Mol. Biol. 2010 399: 422-435. Imágenes obtenidas a través del Banco de Datos de Proteínas RCSB (3KUD).

