8.4: Carbohidratos
- Page ID
- 80617
Los carbohidratos (CHO) se encuentran entre las moléculas biológicas más complejas. Si alguna vez has “contado” tus carbohidratos, sabes que una función biológica de ChOS es almacenar y proporcionar energía (tras la oxidación) al cuerpo para las funciones requeridas. En lugar de concentrarnos en cómo se utilizan los CHO para la producción de energía, nos centraremos predominantemente en sus estructuras, lo que les permite obtener su función principal para proporcionar interacciones de unión con otras biomoléculas, ya sea en solución o en membranas celulares. La unión, promovida a través de IMF, inicia y modula todas las interacciones y procesos biológicos. Primero, consideraremos la estructura de carbohidratos simples y más complejos.
Monosacáridos
Los carbohidratos más simples son los monosacáridos, pequeñas moléculas orgánicas que contienen más de un grupo OH (alcohol) y un solo aldehído (RCOH) o cetona (RCOR). De ahí que los monosacáridos más simples, gliceraldehído y dihidroxiacetona, contienen tres carbonos. A diferencia de los hidrocarburos alcanos que tienen la fórmula genérica C n H 2n +2, los monosacáridos simples tienen la fórmula genérica C n (H 2 O) n que corresponde a su designación como carbo (hidratos).
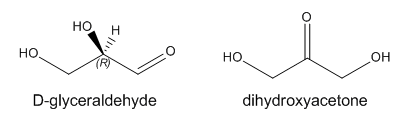
El gliceraldehído tiene un estereocentro. El isómero de origen natural mostrado anteriormente es el R-gliceraldehído. En lugar de utilizar los sistemas R/S para denotar la configuración absoluta de estereocentros específicos en azúcares (así como aminoácidos), los bioquímicos suelen utilizar el sistema D/L. La designación D en azúcares se refiere a cualquier monosacárido cuyo último estereocentro (o en el caso del gliceraldehído, el único estereocentro) tenga la misma configuración absoluta que el R-gliceraldehído. Todos los aminoácidos naturales tienen la configuración L ya que tienen la misma configuración absoluta en comparación con el L-gliceraldehído.
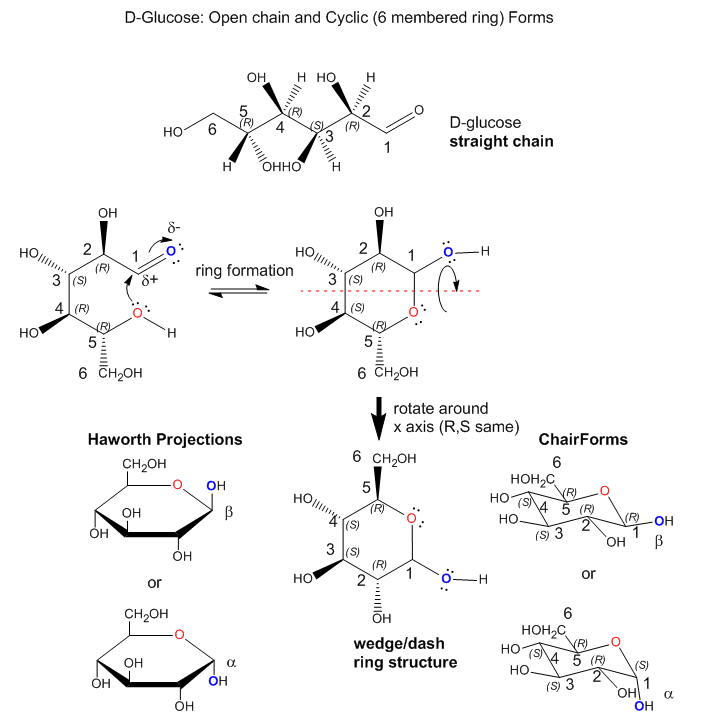
Los monosacáridos pueden existir en solución en una mezcla de equilibrio de cadena lineal y forma cíclica. A continuación se muestra un ejemplo para el azúcar común D-glucosa (Glc). Se incluye la designación R/S para cada estereocentro para facilitar la visualización de la orientación de cada grupo OH a medida que se cicla la forma de cadena recta. En el proceso de formación del anillo de 6 miembros, un par solitario en el OH ligeramente negativo en C5 forma un enlace con el C1 ligeramente positivo. Este proceso requiere rotación alrededor de los diversos enlaces C-C para permitir que el OH en C5 se acerque a C1. Dado que el carbono solo puede tener 4 enlaces, la formación de enlaces a C1 a partir del OH en C5 hace que el C=O (un aldehído) se convierta en C-OH (un alcohol). Se muestran las proyecciones de silla, cuna/tablero y “Haworth” del anillo resultante. Tenga en cuenta que el OH en C1 puede apuntar hacia arriba (forma beta, recordada por la frase mariposas ARRIBA) o hacia abajo (forma alfa, recordada por hormigas ABAJO). En la forma beta, todos los sustituyentes del anillo están en la posición ecuatorial (en forma de silla) y en formas alternantes arriba y abajo en la estructura de cuña, haciendo que la forma beta sea la forma más estable de todas las formas cíclicas de 6 miembros posibles de azúcares 6C.
Dado que hay 4 estereocentros en un aldehído de azúcar 6C, hay 2 4 o 16 posibles estereoisómeros. La mayoría de los azúcares 6C son azúcares D que se definen para tener la misma designación R, S que D-gliceraldehído en el último estereocentro del azúcar. Los azúcares 6C comunes son D-manosa (Man) y D-galactosa (Gal). D-glucosa, D-manosa y D-galactosa, todas las cuales tienen la configuración R en C5, difieren en la orientación de los grupos OH en las estructuras de anillo en C2, C3 y C4. De ahí que sean diastereómeros. El azúcar 6C más común que contiene una cetona (RCOR) en C2 es la fructosa.
Dado que los azúcares son polihidroxialdehídos o cetonas, los OH en C2, C3 y C4 también pueden formar un enlace a C1 (como se ilustra para los OH C5 anteriores) y formar anillos. Pueden pero la forma más común es la forma de anillo de 6 miembros que se muestra anteriormente para la D-glucosa. ¿Cuántos átomos habría en los anillos si los otros OH estuvieran involucrados en la formación del anillo? ¿Por qué el anillo de 6 miembros es más abundante en la naturaleza?
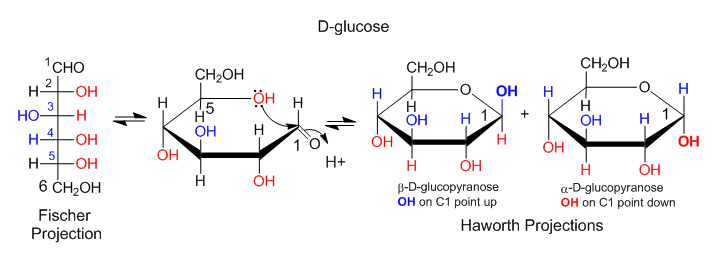
Otro tipo de representación estructural, la proyección Fisher, se utiliza a menudo en los textos de biología. De esta forma, la estructura se escribe en dirección vertical con líneas verticales y horizontales (no cuñas ni guiones). Es sencillo traducir un proyecto Fisher para azúcares simples en una proyección Haworth, luego a una estructura de anillo de cuña/tablero, y luego a una forma de silla. A continuación se muestra un ejemplo de cómo convertir una proyección Fisher en una Haworth para D-glucosa. Si el grupo OH apunta a la derecha en la proyección de Fisher, apunta hacia abajo en las proyecciones de Haworth. Si el OH apunta hacia la izquierda, apunta hacia arriba en la proyección de Haworth.
 JSmol externo (HTML5): glucosa:
JSmol externo (HTML5): glucosa:Derivados Químicos de Monosacáridos
Muchos derivados de monosacáridos se encuentran en la naturaleza. Estos incluyen:
- formas oxidadas en las que los grupos funcionales aldehído y/o alcohol se convierten en ácidos carboxílicos
- formas fosforiladas en las que el ATP añade fosfato para formar derivados de fosfoéster
- derivados de amina tales como glucosamina o galactosamina
- derivados de amina acetilada como N-acetil-GlcNAc (GlcNAc) o GalNAc
- productos de condensación más complejos de derivados de azúcar con lactato (CH 3 CHOHCO 2 -) y piruvato, (CH 3 COCO 2 -) para formar ácido murámico y ácidos neuramínicos, (también llamados ácidos siálicos), respectivamente.
Di- y Polisacáridos
Al igual que con las proteínas, que son polímeros de monómeros de aminoácidos, se pueden formar enlaces covalentes entre diferentes monómeros de azúcar para formar disacáridos, trisacáridos y finalmente polisacáridos, como se muestra a continuación para dos disacáridos, lactosa y sacarosa.
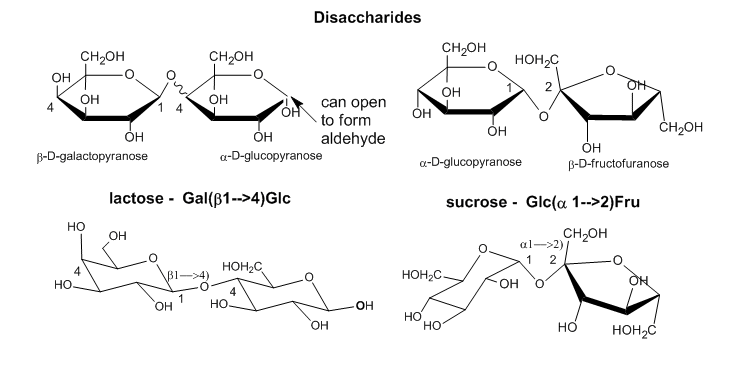
 JSmol externo (HTML5): sacarosa:
JSmol externo (HTML5): sacarosa:Los polisacáridos más largos pueden ser de estructura bastante simple, pero dada la diversidad de monosacáridos que cada uno tiene múltiples grupos OH disponibles para conectar dos monosacáridos en un polímero, la complejidad de la estructura de los polisacáridos puede ser abrumadora de estudiar y comprender. Compare esto con una proteína, un polímero de aminoácidos que, con la excepción de las cadenas laterales, cada una tiene solo dos grupos funcionales involucrados en los enlaces entre los aminoácidos.
Homopolisacáridos
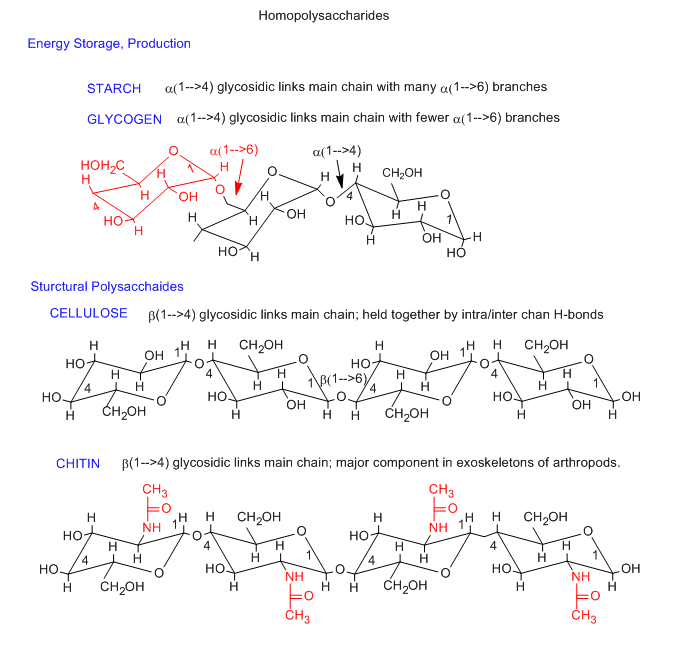
Los polisacáridos más simples consisten en una sola unidad repetitiva de monosacáridos. A continuación se muestran tres ejemplos de homopolisacáridos, glucógeno/almidón, celulosa y quitina. El monómero en glucógeno/almidón y celulosa es glucosa. Las diferencias entre ellos es la vinculación entre los monómeros de glucosa. En almidón y glucógeno, que son polisacáridos de almacenamiento de energía, el enlace es alfa 1-4. En la celulosa, la biomolécula más abundante, el enlace es beta 1-4. El enlace beta asegura que todos los grupos voluminosos en las sillas de glucosa estén en la posición ecuatorial más estable. Este es otro ejemplo más del hecho de que la estructura puede dar cuenta de las propiedades y función de las moléculas. Un pequeño cambio covalente a glucosa, la sustitución de un CH 3 CONH- por un grupo OH en C2 de glucosa da el monosacárido N-acetilglucosamina. Esta polimeriza, como la celulosa, con un enlace beta 1-4, para formar un nuevo polisacárido, la quitina, con propiedades marcadamente diferentes a las de la celulosa. La quitina, es el componente principal del exoesqueleto de los artrópodos.
El almidón consiste en 20-30% de amilosa, un polímero alfa 1-4 no ramificado de D-glucosa y 70-80% de amilopectina, que consiste en enlaces alfa 1-4 con enlaces alfa 1-6 cada 25-30 residuos de glucosa. El glucógeno es similar a la amilopectina y además tiene una proteína, la glucogenina, en el núcleo de la partícula de glucógeno.
 JSmol externo (HTML5): amilosa: complejo de amilosa-yodo
JSmol externo (HTML5): amilosa: complejo de amilosa-yodo JSmol externo (HTML5): amilopectina:
JSmol externo (HTML5): amilopectina: JSmol externo (HTML5): amilopectina:
JSmol externo (HTML5): amilopectina: JSmol externo (HTML5): modelo de glucógeno (similar al almidón): Obsérvese que la cadena principal se retuerce (como lo indica la silla negra se forma en la figura anterior mostrando los enlaces alfa 1-4 de la cadena principal), y formando así una hélice larga. La triodiida, I 3 -, puede caber en la abertura de la hélice, provocando que una solución de almidón/glucógeno se vuelva púrpura en esta conocida prueba de almidón.
JSmol externo (HTML5): modelo de glucógeno (similar al almidón): Obsérvese que la cadena principal se retuerce (como lo indica la silla negra se forma en la figura anterior mostrando los enlaces alfa 1-4 de la cadena principal), y formando así una hélice larga. La triodiida, I 3 -, puede caber en la abertura de la hélice, provocando que una solución de almidón/glucógeno se vuelva púrpura en esta conocida prueba de almidón. JSmol externo (HTML5): modelo de celulosa: Obsérvese la estructura extendida, no helicoidal del polímero
JSmol externo (HTML5): modelo de celulosa: Obsérvese la estructura extendida, no helicoidal del polímeroHeteropolisacáridos con repetición de disacáridos
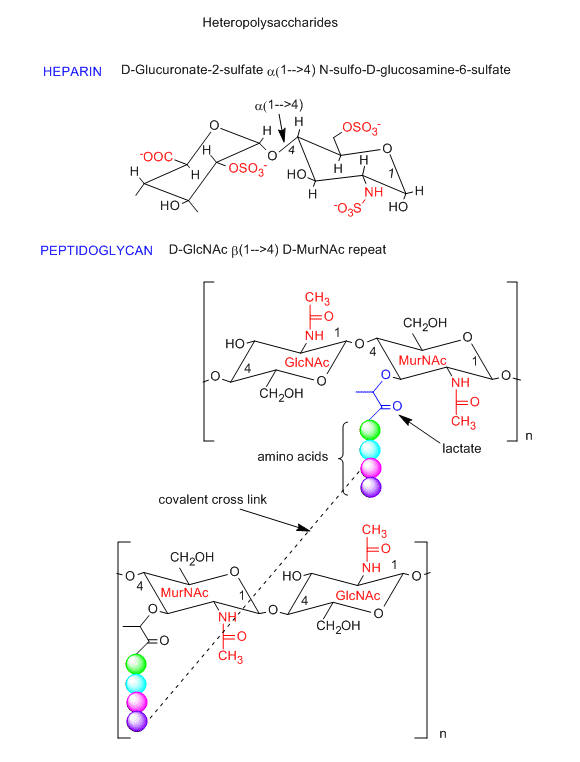
Los polisacáridos también pueden estar hechos de una unidad repetitiva de disacárido, en lugar de repetir monosacáridos en los homopolisacáridos mostrados anteriormente. Un ejemplo es un glicosoaminoglicano llamado heparina (un anticoagulante, que se muestra en la figura a continuación) que está compuesto por unidades repetitivas del disacárido, D-glucuronato-2-sulfato (alfa 1,4) GlcNsulfo-6-sulfato. Estos disacáridos se componen de dos glucosas que han sido modificadas químicamente. Anote los cargos en esta unidad repetitiva. Otro ejemplo es la repetición de disacáridos en las paredes celulares de las bacterias del peptidoglicano (contiene tanto CHO como aminoácidos) (ver figura a continuación). La repetición nuevamente consiste en unidades de glucosa modificadas químicamente. Comparar la repetición con el componente principal del citoesqueleto, la quitina. La naturaleza ha elegido variantes de esta repetición para crear un exoesqueleto rígido y protector y pared celular para artrópodos y bacterias.
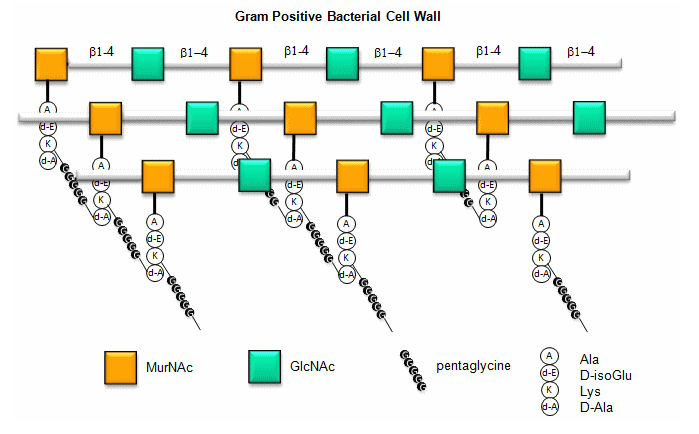
Aquí hay una figura que proporciona una mejor visión de la pared celular general de las bacterias Gram-positivas.
Carbohidratos en el reconocimiento de biomoléculas
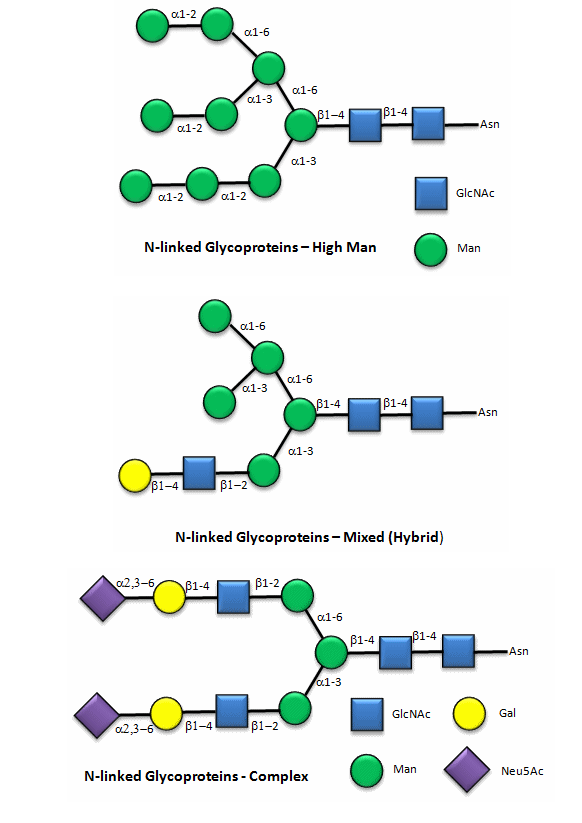
Los carbohidratos se unen covalentemente a muchas biomoléculas diferentes, incluyendo lípidos, para formar glicolípidos, y proteínas, para formar glicoproteínas. Las glicoproteínas y glicolípidos se encuentran a menudo en las membranas biológicas, a las que se anclan por interacciones no polares. Un tipo especial de glicoproteína, un proteoglicano, en realidad tiene más masa de carbohidratos que proteínas. ¿Cuál es la función de estos carbohidratos? Dos son aparentes. Primero, la glicosilación de proteínas ayuda a proteger la proteína de la degradación por catalizadores enzimáticos dentro del cuerpo. Sin embargo, una segunda función principal surge de la facilitación del reconocimiento de biomoléculas. Los carbohidratos unidos covalentemente que “decoran” la superficie de glicoproteínas o glicolípidos proporcionan nuevos sitios de unión para interacciones con otras biomoléculas. Por lo tanto, la glicosilación permite interacciones célula:célula, célula:proteína o proteína:proteína. Desafortunadamente, las bacterias y los virus a menudo reconocen moléculas glicosiladas en las membranas celulares, lo que permite su importación a la célula.
Aquí hay algunos ejemplos de “dibujos animados” de carbohidratos unidos covalentemente al aminoácido asparagina (Asn) en una glicoproteína.
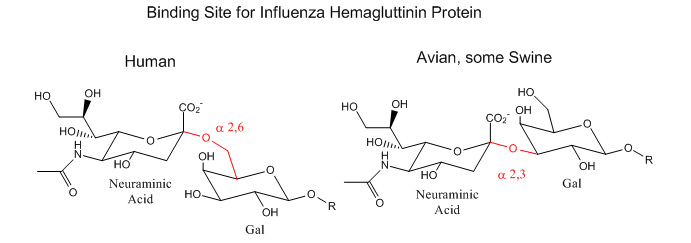
Aquí hay algunos ejemplos de interacciones biomoleculares promovidas por IMF que involucran carbohidratos.
Virus de la Influenza que se une a glicoproteínas de superficie celular con Neu5Ac - Una proteína en la superficie del virus de la influenza, la hemagluttinina, se une al ácido siálico (Sia), que se une covalentemente a muchas glicoproteínas de la membrana celular en las células hospedadoras. El ácido siálico suele estar conectado a través de un enlace alfa (2,3) o alfa (2,6) a galactosa en glicoproteínas N-enlazadas. Los subtipos encontrados en los aislamientos de influenza aviar (y equina) se unen preferentemente a Sia (alfa 2,3) Gal que predomina en el tracto gastrointestinal aviar donde los virus se replican. Los virus humanos del subtipo H1, H2 y H3 (causa de las pandemias de 1918, 1957 y 1968) reconocen a Sia (alfa 2,6) Gal, la forma principal en el tracto respiratorio humano. La influenza porcina HA se une a Sia (alfa 2,6) Gal y algo de Sia (alfa 2,3) las cuales se encuentran en cerdos.
- Modelo Jmol de hemaglutinina viral unida a fármacos antivirales y ácido siálico (neuramínico) de Proteopedia
Leucocitos: Unión a la pared celular - Durante la inflamación, los leucocitos circulantes (un tipo de glóbulo blanco) se atan y ruedan sobre las paredes de los vasos sanguíneos donde se vuelven activos. Las proteínas E-, L- y P-selectina son las principales proteínas responsables del anclaje y balanceo de estos leucocitos. La P-selectina se une, en parte, a un tetrasacárido, Sialil-Lewis x (SLEX) en la superficie celular. La interacción entre P-selectina y la célula media la unión/balanceo inicial del leucocito en la pared del vaso.
Ejercicio\(\PageIndex{1}\)
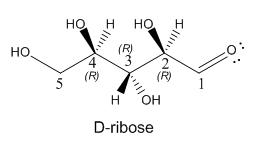
Dibuje una estructura de anillo Haworth y cuna/guión para la D-ribosa de azúcar de cinco carbonos, cuya forma de cadena recta se muestra a continuación. La D-ribosa es extremadamente importante en el mundo biológico ya que su forma de anillo de 5 miembros se encuentra en el ARN. Una variante, la desoxirribosa, en la que el OH en C2 es reemplazado por un átomo de H, es parte de la cadena principal del ADN.
Ejercicio\(\PageIndex{2}\)
Los humanos utilizan dos tipos de moléculas de almacenamiento de energía: glucógeno y triacilglicéridos. (Revisar la estructura de los triaciglicéridos del Capítulo 8.1). Dadas las fuerzas intermoleculares entre estos diferentes tipos de moléculas y el agua, predecir cuál podría ser biológicamente ventajoso desde una perspectiva peso/masa para un organismo que debe soportar esta masa de almacenamiento.
Ejercicio\(\PageIndex{3}\)
Usando figuras geométricas para representar monómeros, dibuja figuras de dibujos animados de lo siguiente
a. un homopolímero de cadena recta
b. un homopolímero de cadena altamente ramificada
c. un heteropolímero lineal con una unidad repetitiva que consiste en dos monómeros diferentes
d. un polímero altamente ramificado que contiene 4 monómeros diferentes
Ejercicio\(\PageIndex{4}\)
La naturaleza utiliza todos estos motivos en el mundo biológico de los carbohidratos. Debe haber ventajas de estas estructuras variables. Ofrecer una posible razón para que los siguientes tipos de estructuras de polisacáridos sean adoptados por la naturaleza.
a. polímero de cadena recta y alargado de glucosa que puede formar fibrillas en celulosa
b. un polímero altamente ramificado de glucógeno que debe ser descompuesto por enzimas para formar glucosa en tiempos de urgente necesidad energética
c. un polímero altamente ramificado de diversos monómeros y monómeros químicamente modificados unidos a proteínas.
Ejercicio\(\PageIndex{5}\)
El motivo disacárido repetido de la heparina (discutido anteriormente) se muestra a continuación una vez más.
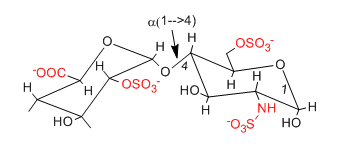
a. ¿Esperaría que esta molécula colapsara en una estructura esférica compacta o tuviera una estructura más abierta y extendida? Explique.
b. La heparina se usa ampliamente como anticoagulante. Afecta las propiedades de la trombina, una enzima que hace que la sangre coagule. La trombina es una proteína globular (esférica). Para que la heparina tenga un efecto directo sobre la trombina, debe interactuar con ella. ¿Qué características estructurales de la trombina podrían estar involucradas en esta interacción? Dibuja un modelo de dibujos animados que muestre la interacción.

