12.2: Viscosidad
- Page ID
- 80646
En su estado líquido, los polímeros parecen más gruesos que los líquidos regulares. Se parecen más a la miel que al té. Son difíciles de remover, molestos de verter e imposibles de extraer en una pipeta. Con el té, es mucho más fácil hacer todas estas cosas. Describimos esta propiedad de “espesor” como “viscosidad”.
- Esos líquidos similares al té tienen baja viscosidad.
- Esos líquidos similares a la miel tienen alta viscosidad.
Una forma de pensar sobre el movimiento a través de líquidos es imaginar el líquido dividido en capas. Claro que no lo es, de verdad. La razón por la que estamos pensando en ello de esta manera es imaginar lo que sucederá cuando un objeto pase por el líquido, paralelo a estas capas. A lo mejor estamos viendo una bala disparada desde una pistola hacia una cámara de pruebas en CSI.
En un líquido de baja viscosidad, a medida que la bala se mueve a través del líquido, empuja un par de capas fuera del camino. No tiene mucho efecto en las capas circundantes.
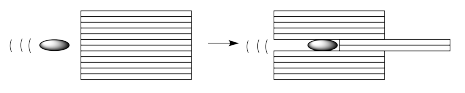
A medida que la bala se mueve a través de un líquido de alta viscosidad, todavía desplaza las capas frente a ellas, pero esas capas arrastran las capas circundantes a lo largo, también. Esas capas circundantes, a su vez, arrastran a lo largo de las capas que están junto a ellas.
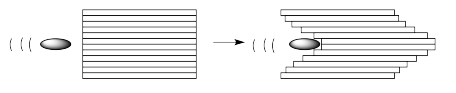
¿Cuál es la diferencia entre estos dos escenarios? A nivel molecular, tiene que ver con la interacción entre las moléculas en una capa y la siguiente. Si las moléculas están completamente aisladas, no interactúan entre sí en absoluto. La bala simplemente empuja las moléculas delante de ella hacia adelante sin molestar a las de ninguno de los lados.
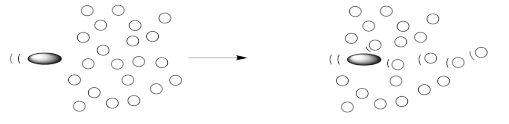
Una macromolécula es diferente de las moléculas regulares porque una fuerza sobre una parte de la molécula se transmitirá muy lejos. Podemos imaginar una macromolécula que abarca muchas capas, de manera que cuando la bala golpea un extremo de la molécula, el otro extremo de la molécula transmite esta fuerza a sus vecinos.
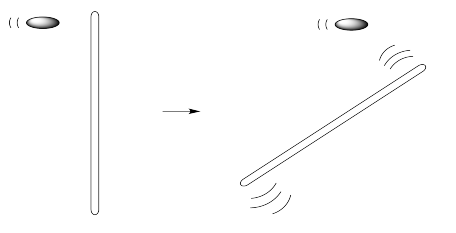
La viscosidad no es un fenómeno limitado a macromoléculas. De hecho, los líquidos realmente no exhiben el caso de no viscosidad descrito anteriormente, porque las moléculas sí interactúan entre sí. Sin embargo, diferentes líquidos exhiben diferentes viscosidades, y las macromoléculas están en el extremo de alta viscosidad del espectro.
En realidad, las macromoléculas no son como palitos largos que caen unos sobre otros. Son flojos y pueden cambiar de forma debido a las rotaciones de los enlaces; pueden sufrir “cambios conformacionales”. Como resultado, las macromoléculas se “enredan” entre sí.

El enredo es una característica muy importante en el comportamiento de los polímeros. Influye en la viscosidad de un polier en su estado fundido, lo que afecta la facilidad con la que el polímero se puede moldear en diferentes formas para diferentes aplicaciones. No solo eso, sino que influye fuertemente en la resistencia física de un plástico en su estado regular de temperatura ambiente. Cuanto más enredado están las cadenas de polímero, más fuerte es el material.
- El enredo aumenta la viscosidad de un polímero en la fase fundida.
- El enredo aumenta la resistencia de un polímero en la fase “sólida”.
Ejercicio\(\PageIndex{1}\)
Usando el agua como punto de comparación, explique los valores relativos de viscosidad (η) de los siguientes líquidos, registrados cerca de la temperatura ambiente, 25 °C). Agua: η =1.00 MPa s. (e.g. Este es un poco más bajo que el agua porque...)
- etilenglicol o 1,2-hidroxietano: η = 16.1 MPa s.
- aceite de oliva: η = 84 MPa s.
- metanol: η = 0.58 MPa s.
- 2-propanona: η = 0.34 MPa s.
- hexano: η = 0.294 MPa s.
- Respuesta a:
-
El agua puede en principio formar cuatro enlaces de hidrógeno: puede donar dos y aceptar dos. El etilenglicol tiene dos grupos OH, por lo que puede donar dos enlaces H y aceptar cuatro. Esa adherencia mejorada es responsable de su mayor viscosidad.
- Respuesta b:
-
El aceite de oliva no une hidrógeno; ni siquiera es muy polar. Sin embargo, es un triglicérido y sus cadenas de ácidos grasos son aproximadamente 80% de ácido oleico y ácido linoleico, que son ambas cadenas de 18 carbonos. Por lo que la molécula promedio de aceite de oliva contiene tres 18 ramas de carbono, lo que lleva a un modesto nivel de enredo. Su viscosidad es mucho mayor que la del agua.
- Respuesta c:
-
El metanol tiene solo un enlace OH, por lo que tiene un poco menos de enlaces de hidrógeno que el agua, pero no lo suficiente de nada más para formar otras interacciones. la viscosidad ts es un poco menor que la del agua.
- Respuesta d:
-
La 2-propanona no tiene ningún enlace de hidrógeno, aunque sí tiene un momento dipolar para mantener unidas diferentes moléculas. Su viscosidad es un poco menor que la del metanol.
- Respuesta e:
-
El hexano no tiene dipolo ni enlaces de hidrógeno. Realmente es demasiado corto para enredarse. Las moléculas solo se atraen entre sí a través de interacciones débiles de dispersión de Londres. Su viscosidad es un poco menor que la de 2-propanona.
Ejercicio\(\PageIndex{2}\)
Explicar por qué la viscosidad de una muestra fundida de polietileno, (CH 2 CH 2) n, depende del peso molecular de los polímeros en la muestra.
- Responder
-
Cuanto mayor sea el número de unidades repetitivas, mayor será el peso molecular. Además, cuanto mayor sea el número de unidades repetitivas, mayor será el enredo y mayor será la viscosidad.
Un curioso ejemplo de un líquido de muy alta viscosidad se ilustra con el experimento de caída de tono que se realiza actualmente en la Universidad de Queensland, Australia. En este experimento, el betún se vertió en un embudo de vidrio y posteriormente se monitoreó la velocidad a la que el betún gotea a través del embudo. El experimento se puso en marcha en 1927. Hasta el momento han caído diez gotas.

