12.7: Peso molecular
- Page ID
- 80640
Las macromoléculas son moléculas muy grandes. Sus pesos moleculares pueden oscilar entre miles y millones. Por lo general, se construyen a partir de pequeñas unidades repetitivas unidas entre sí de alguna manera.
Describir el peso molecular de un polímero no es tan sencillo como lo es en una molécula pequeña. El hecho de que cada macromolécula se construya uniendo una gran cantidad de monómeros complica las cosas. ¿Exactamente cuántos monómeros hay en una molécula de polímero? ¿Veinte? ¿Veinticinco? ¿Treinta? Cada una de esas posibilidades tendría un peso molecular muy diferente.
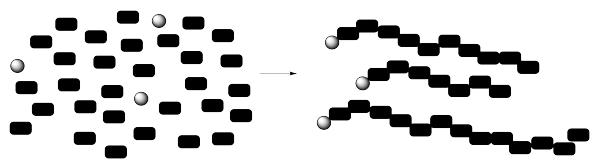
Este suele ser el caso en las macromoléculas, ya sea que se trate de muestras comerciales o biológicas. Los polímeros se cultivan, a menudo a través de la acción de algún “iniciador” que recoge un monómero y comienza a tejer una cadena. ¿Y si uno de los iniciadores empieza un poco más tarde que los demás? ¿Y si una de las cadenas crece un poco más rápido que las otras? ¿Y si algo sale mal y una cadena deja de crecer?
Como resultado de una serie de factores, los polímeros generalmente muestran una distribución de pesos moleculares que representan una distribución de longitudes de cadena. No hay peso molecular exacto. En cambio, se debe determinar un promedio.
Ejercicio\(\PageIndex{1}\)
Explicar la relación general entre el grado de polimerización y el peso molecular de la cadena.
- Contestar
-
A medida que aumenta el número de unidades repetidas, aumenta el peso molecular.
Ejercicio\(\PageIndex{2}\)
Calcular el peso molecular de cada una de las siguientes cadenas poliméricas. Por simplicidad, supongamos que los grupos terminales son solo átomos de hidrógeno en cada caso.
- poliestireno (PS) con DP = 1,000
- polilactida (PLA) con DP = 200
- poli (óxido de etileno) (PEO) con DP = 50
- polipropileno (PP) con DP = 100,000
- Respuesta a:
-
El peso molecular es la suma de los pesos de todas las unidades repetidas más el peso de los grupos terminales.
MW = 1,000 unidades x 104.15 Da/Unidad + 2 Da = 104,152 Da
- Respuesta b:
-
MW = 200 unidades x 72.06 Da/unidad + 2 Da = 14,412 Da (basado en 200 unidades repetitivas simples, pero este es un caso complicado. En la práctica común, el PLA se elabora a partir de un monómero dimérico, formando cada monómero dos unidades repetidas en la cadena, por lo que un grado de polimerización de 200 corresponde realmente a 400 unidades repetidas en la cadena, lo que tendría el doble de peso molecular).
- Respuesta c:
-
MW = 50 unidades x 44.05 Da/Unidad + 2 Da = 2,202 Da
- Respuesta d:
-
MW = 100,000 unidades x 42.08 Da/Unidad + 2 Da = 4,208,002 Da
Tenga en cuenta que, en este caso, los grupos finales no hacen ninguna diferencia apreciable en el peso porque son muy pequeños.
Hay muchas formas diferentes de estimar el peso molecular promedio de un polímero. Estos métodos se clasifican en dos categorías, dando lugar a dos estimaciones diferentes del peso molecular promedio.
En algunas técnicas, se mide el peso total de una muestra seguido de una determinación del número de moléculas presentes. El peso molecular es solo el peso total dividido por el número de moléculas. Esta cantidad se llama el peso molecular promedio en número, o M n
Ejercicio\(\PageIndex{3}\)
- Se determina que una muestra que pesa 3.205 g contiene 5.50 x 10 -4 moles. ¿Qué es M n?
- Se determina que una muestra que pesa 1.315 g contiene 1.25 x 10 -3 moles. ¿Qué es M n?
- Se determina que una muestra que pesa 0.225 g contiene 3.20 x 10 -7 moles. ¿Qué es M n?
- Respuesta a:
-
MW = peso (en g)/moles
5827 Da
- Respuesta b:
-
1052 Da
- Respuesta c:
-
703,000 Da o 703 kDa
Un ejemplo clásico de este tipo de medición es una depresión del punto de congelación. Un líquido puro se congela a una temperatura específica, pero las impurezas en el líquido tienden a interferir con la formación de cristales, disminuyendo el punto de congelación. El cambio en el punto de congelación depende del número de moléculas presentes en la impureza. En este enfoque, una cantidad medida de polímero se disolvería en una cantidad específica de tolueno y el punto de congelación se mediría con mucho cuidado. El polímero en este contexto está actuando como impureza. El cambio en el punto de congelación indicaría el número de moléculas (o moles) de la impureza. Entonces se podría calcular el peso molecular promedio.
Otras técnicas se basan en mediciones que dependen del tamaño relativo de las macromoléculas, más que del número de ellas. La cantidad determinada de esta manera se denomina peso molecular promedio en peso, o M w.
Un ejemplo clásico de este tipo de medición es un experimento de dispersión de luz. Un haz de luz láser se ilumina en una solución de polímero. Parte de la luz se dispersa cuando se encuentra con moléculas de polímero, y los patrones de interferencia en la luz dispersada se pueden decodificar para dar información sobre el tamaño de partícula.
Por lo general, las técnicas que dependen del tamaño de partícula están más fuertemente influenciadas por las partículas más grandes, y así M w > M n. Cuanto más cerca estén estos números entre sí, más uniformes deben ser los partciles. Cuanto más diferentes son, más amplia es la distribución presente. En consecuencia, la relación M w/M n, históricamente llamada índice de polidispersidad (PDI), es un indicador importante de cuán uniformes son las moléculas en tamaño. “Polidisperso” como adjetivo significa que existe una amplia distribución de tamaños, a diferencia de “monodispersa”, lo que significa que todo es del mismo tamaño.
La IUPAC ha decidido recientemente que se abandone el término “índice de polidispersidad” a favor del término más conciso, dispersidad ().
Ejercicio\(\PageIndex{4}\)
Determinar la polidispersidad en cada uno de los siguientes casos.
- M n = 2,105; M w = 2,408
- M n = 102,365; M w = 124,710
- M n = 56.300; M w = 87.530
- M n = 8.105; M w = 14.220
- M n = 1,170,000; M w = 1,899,000
- Respuesta a:
-
= M w/M n
1.14
- Respuesta b:
-
1.22
- Respuesta c:
-
1.56
- Respuesta d:
-
1.76
- Respuesta e:
-
1.62
En estos días, dos de las técnicas más comunes para estimar el peso molecular son la espectroscopia de RMN 1H y la cromatografía de exclusión por tamaño (aunque todavía se utilizan otras técnicas como la dispersión de la luz). Echaremos un vistazo más de cerca al análisis de RMN en un minuto. Primero comenzaremos con una visión simplificada de la cromatografía de exclusión por tamaño (SEC) o, como a veces se le llama, cromatografía de permeación en gel (GPC).
En SEC, se envía una muestra a través de una columna que contiene un gel poroso. Generalmente, las moléculas más pequeñas que vagan por los poros dentro del gel tardan más en atravesar la columna. Las moléculas más grandes que no pueden caber en los poros emergen antes. El efluente de la columna es monitoreado por una técnica como espectroscopía UV-Vis o índice de refracción. La respuesta de este detector cambia con el tiempo, con una respuesta más fuerte que indica que se están detectando más moléculas a medida que salen de la columna. La salida del instrumento muestra una distribución, no diferente a una curva de campana, indicando la distribución de pesos moleculares en comparación con una muestra estándar.
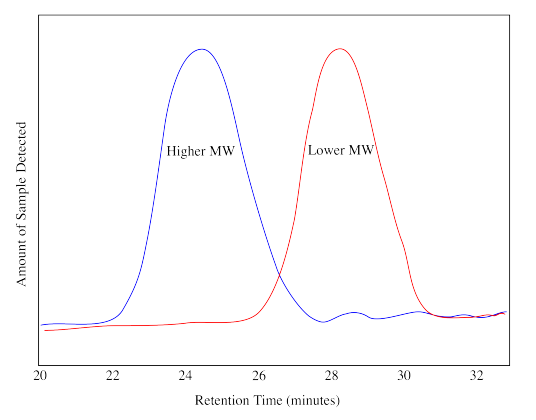
El dibujo anterior te muestra cómo sería un cromatograma o traza para dos muestras diferentes, una de mayor peso molecular y otra de menor peso molecular. El tiempo de retención en una traza de GPC no indica directamente el peso molecular del polímero. Se tiene que ejecutar una calibración. En una calibración, los polímeros de peso molecular conocido se pasan a través del GPC y se obtienen sus cromatogramas. La traza GPC de un polímero desconocido, ejecutada en el mismo instrumento en las mismas condiciones, se compara luego con las estándar. Se utiliza software para estimar el peso molecular y la polidispersidad.
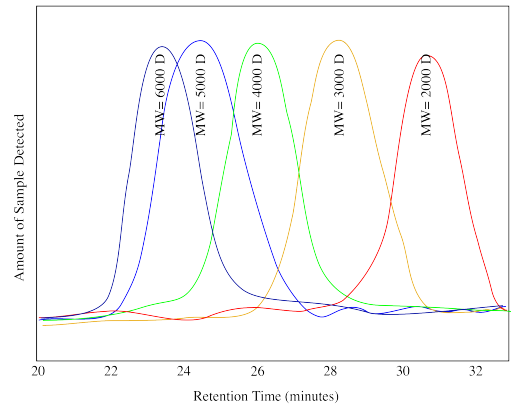
Ejercicio\(\PageIndex{5}\)
Supongamos que el siguiente dibujo muestra trazas de calibración para el cromatograma mostrado anteriormente (D significa Daltons, otro nombre para las unidades “g/mol”). Estimar el peso molecular de
- el bajo peso molecular desconocido.
- el alto peso molecular desconocido.
- Respuesta a:
-
3,000 D
- Respuesta b:
-
5,000 D
Ejercicio\(\PageIndex{6}\)
La SEC, que se basa en el tamaño de una molécula de polímero en espiral, a veces puede dar estimaciones engañosas del peso molecular. Explica por qué con la ayuda del siguiente diagrama.
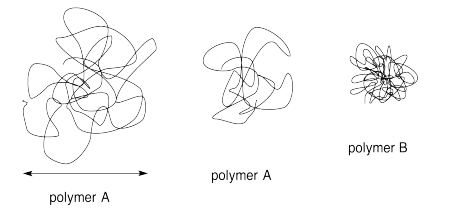
- Contestar
-
Cuanto más larga es la cadena en el polímero A, más grande es la esfera en la que se enrolla. No hay mucho problema comparando muestras de polímero A entre sí, siempre que tengamos alguna manera de calibrar el tamaño de la esfera con la longitud de la cadena.
Sin embargo, el polímero B parece estar más enrollado que A. Una esfera relativamente pequeña podría empaquetar mucha más cadena. Tendríamos que ser cautelosos al comparar el tamaño de la esfera de B con el de A y sacar conclusiones sobre la longitud de la cadena o el peso molecular.
La espectroscopia de RMN es un método que utiliza campos magnéticos y ondas de radio para detectar diferentes tipos de átomos en una muestra. 1H NMR detecta los átomos de hidrógeno en una muestra. Es conceptualmente muy similar a la resonancia magnética utilizada en hospitales y clínicas. En el experimento, la muestra se coloca en un campo magnético muy fuerte (en algún lugar del orden de cien mil veces mayor que el campo magnético de la tierra en la superficie del planeta). Las ondas de radio se envían a través de la muestra. La mayoría de ellos pasan directamente a través, pero algunos de ellos son absorbidos por los átomos de hidrógeno.
El resultado del experimento de RMN es un espectro de RMN. Un espectro es realmente solo una gráfica. En el eje x, muestra todas las frecuencias posibles de las ondas de radio que se enviaron a través de la muestra. En el eje y, muestra el nivel de absorción: es decir, qué cantidad de las ondas de radio en cada frecuencia fueron absorbidas por la muestra. ¿Una frecuencia particular de ondas de radio acaba de pasar a través de la muestra? La absorbancia a esa frecuencia sería cero. Si se absorbe una frecuencia particular, habrá un “pico” en la gráfica (un punto alto) a esa frecuencia.
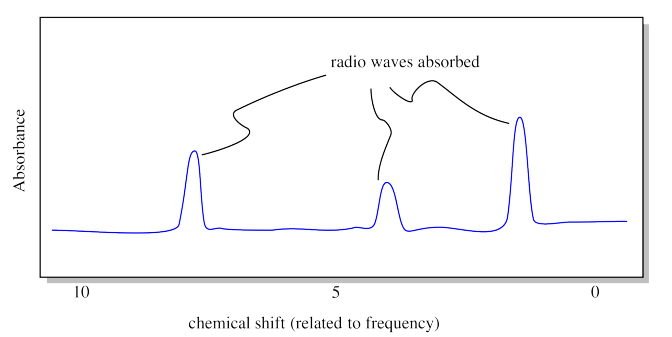
Cada pico en el espectro de RMN corresponde a un hidrógeno en un ambiente diferente. Tal vez el hidrógeno está unido a un átomo de oxígeno, o a un átomo de carbono, y así sucesivamente. En el dibujo mostrado anteriormente, el espectro indica tres ubicaciones diferentes para los átomos de hidrógeno en la molécula. Nótese que la “frecuencia” en RMN se denomina “desplazamiento químico”, por razones históricas. Las unidades de desplazamiento químico son partes por millón, o ppm, por razones que tienen que ver con la mecánica del experimento.
Pero, ¿cómo nos ayuda eso con el peso molecular? Estamos llegando ahí.
La espectroscopia de RMN 1H también nos permite medir cuántos hidrógenos tenemos de cada tipo, al menos en un sentido relativo. Podría decirnos que tenemos cantidades iguales de hidrógenos en estos tres lugares, o tal vez el doble en un lugar que en los otros dos. La relación es bastante simple: cuantos más hidrógenos haya en una ubicación particular, mayor será el pico asociado a ellos. Eso es porque si un átomo de hidrógeno absorbe un fotón de radiofrecuencia, dos átomos de hidrógeno absorberían dos fotones de radiofrecuencia. Eso es el doble. El pico debería ser el doble de grande para dos hidrógenos que para un hidrógeno.
Sin embargo, ¿qué queremos decir con “más grande”? Resulta que la altura del pico realmente no nos dice nada. Lo que importa es la zona del pico. Eso es porque incluso para dos protones aparentemente idénticos en una muestra, hay muchos factores que se meten con la radiofrecuencia absorbida, aunque ligeramente. Entonces, si un hidrógeno específico en una molécula absorbe un radiofotón a 1.7005 ppm, un hidrógeno en la misma posición exacta en una segunda molécula podría absorber a 1.7007 ppm. Hay muchas razones complicadas para eso. El resultado, sin embargo, es que los picos de RMN se manchan un poco, de modo que no es la altura lo que importa, sino el área, que es la suma de una gran cantidad de radiofrecuencias muy similares absorbidas por esos hidrógenos idénticos en diferentes moléculas.
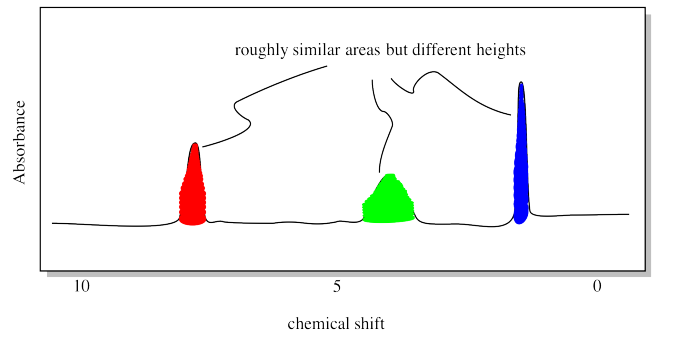
Entonces necesitamos medir las áreas de esos picos. Afortunadamente, los espectrómetros de RMN están equipados con software que puede hacer esto. Clásicamente, el instrumento imprimiría una línea roja a través del espectro. La línea roja saltaría cada vez que pasaba por encima de un pico. La cantidad de cada lúpulo correspondió al área relativa del pico.
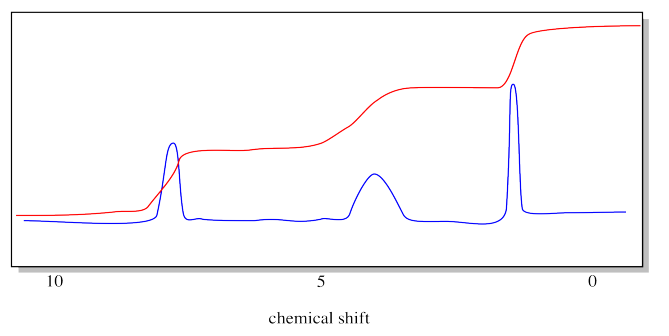
Observe que ya no nos molestamos en etiquetar el eje y. No nos dice nada, de todos modos.
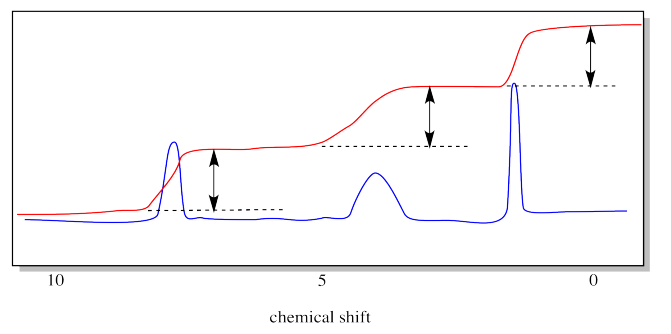
El dibujo a continuación enfatiza lo que estamos midiendo con la línea integral. Es la distancia vertical que sube la línea integral a medida que pasa por un pico. Esa distancia se llama la “integral”. En este caso, las integrales de los tres picos son casi iguales.
Ahora es el momento de ver cómo la espectroscopia de RMN 1H puede revelar el peso molecular a través de una medición llamada “análisis de grupos finales”.
Considera el polímero poli (etilenglicol), o PEG. El PEG se usa comúnmente en medicina. Por sí mismo se puede utilizar como laxante, dependiendo de su peso molecular. También se puede mezclar con productos farmacéuticos; ayuda a controlar los efectos secundarios y propaga el efecto medicinal durante más tiempo, por lo que no es necesario tomar el medicamento con tanta frecuencia.
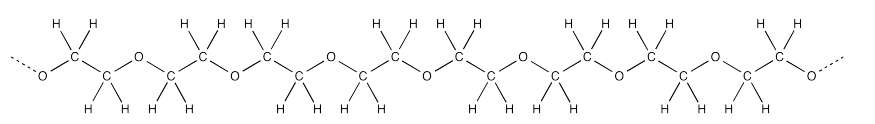
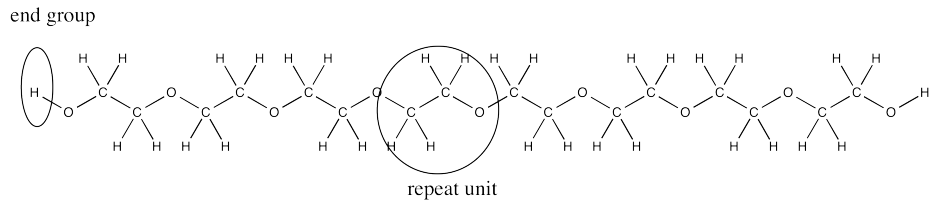
Frecuentemente, hay un grupo OH en ambos extremos de la cadena. En el medio, el polímero está hecho de CH 2 CH 2 O unidades repetitivas.
El PEG se puede considerar como un polímero de etilenglicol (o etano-1,2-diol). La estructura del etilenglicol se proporciona a continuación. La estructura del etilenglicol muestra dos tipos diferentes de hidrógenos. Están los hidrógenos a lo largo de la cadena, unidos a los carbonos, y hay hidrógenos en los extremos de la cadena, unidos a los oxígenos. El espectro de RMN 1H del etileno mostraría un pico diferente para cada uno de esos tipos de hidrógenos. Habría dos picos.
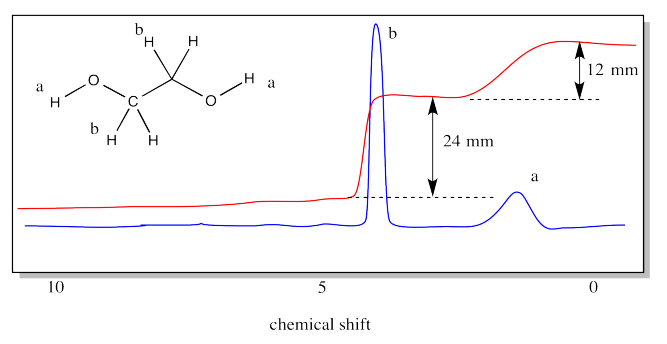
El espectro también muestra una línea de integración. Hemos medido la integral para cada pico. Parece una relación 2:1, porque la distancia vertical en un caso es de 24 mm y en el otro caso es de sólo 12 mm. Incluso si no sabes nada más sobre la espectroscopia de RMN, puedes ver que el pico alrededor de 4 ppm debe corresponder a los hidrógenos en los carbonos, mientras que el pico alrededor de 1 ppm debe corresponder a los hidrógenos en los oxígenos. Eso es porque hay cuatro hidrógenos en los carbonos y sólo dos en los oxígenos. La relación es de 2:1.
La estructura del PEG es bastante similar a la del etilenglicol, excepto que tiene un montón de unidades colgadas en una fila. El espectro de RMN del PEG también es bastante similar al del etilenglicol.
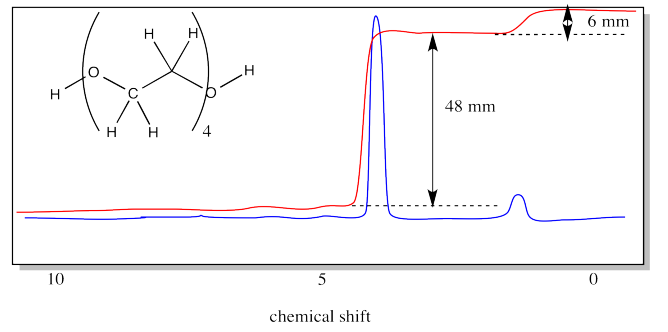
En el análisis de grupos finales, comparamos la integral de un hidrógeno que se encuentra al final de la cadena con la integral de uno que se encuentra a lo largo de la cadena, en la unidad repetitiva. En PEG, el grupo final es el grupo OH en cada extremo. La unidad repetida corresponde a los hidrógenos en los carbonos.
En el caso anterior, hay dos hidrógeno en los grupos terminales (uno en cada extremo). Las cuatro unidades de repetición tienen cuatro hidrógenos cada una, para un total de dieciséis. La relación de integración debe ser 16:2, o 8:1. La relación medida es de 48:6, o 8:1.
Contraste ese resultado con el caso del etilenglicol, en el que básicamente hay una sola unidad repetida. La relación en el oligómero (polímero corto) es cuatro veces mayor que la relación en el monómero. Eso es porque hay cuatro veces más unidades repetidas en el oligómero. A veces llamamos al número de unidades repetidas en la cadena el “grado de polimerización”.
Ejercicio\(\PageIndex{7}\)
Expandir la estructura anterior del oligómero PEG de 4 unidades para mostrar la cadena completa, en lugar de solo la unidad de repetición entre paréntesis.
Ejercicio\(\PageIndex{8}\)
¿Cuál sería la relación de integración en el siguiente oligómero?
- Contestar
-
16:1
Para estimar la longitud de la cadena en RMN, se debe encontrar un pico a partir de una de las unidades repetitivas a lo largo de la cadena así como un pico de un grupo final, que se encuentra solo al final de la cadena. La integración de la unidad repetitiva al grupo final indica el número promedio de unidades repetitivas por polímero. Esta técnica proporciona esencialmente M n.
Ejercicio\(\PageIndex{9}\)
¿Cuál es el peso molecular del oligómero PEG de 4 unidades, cuyo espectro de RMN se mostró anteriormente?
- Contestar
-
Es OH + 4 x (CH 2 CH 2 O) + H. Eso es 17 + (4 x 44) + 1 = 18 + 176 = 194 D.
En el siguiente ejemplo, vas a ver un hecho peculiar de la vida. La verdad es que los grupos OH a menudo no aparecen bien en la espectroscopía de RMN 1H (por razones complicadas). Eso puede complicar las cosas. Para sortear ese problema, las personas suelen fabricar polímeros de tal manera que hay un grupo final diferente, distinto de un OH, de manera que la relación de integración se puede medir más fácilmente.
Ejercicio\(\PageIndex{10}\)
Utilice la relación de integración en el siguiente espectro para estimar el grado de polimerización.
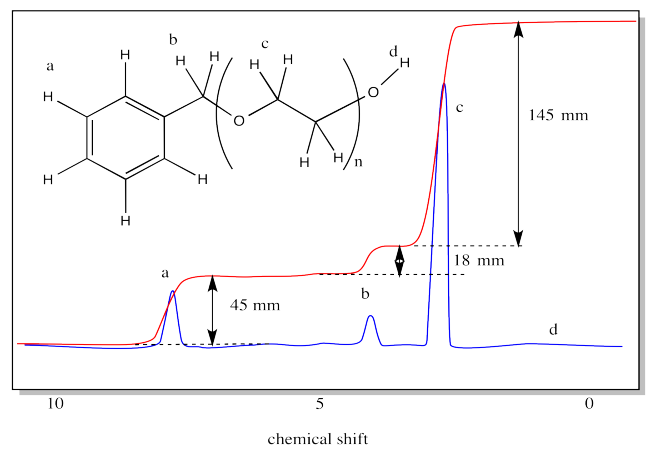
- Contestar
-
La relación de c a b es 145:18 = 8:1. Sin embargo, el número de hidrógenos en la unidad repetida c es 4; el número de hidrógenos en el grupo final b es 2. Esa relación es 2:1. Eso significa que la comparación que necesitamos es (145/4)/(18:2) = 4:1. El grado de polimerización es 4.

