12.8: Asambleas Supramoleculares
- Page ID
- 80654
Los ensamblajes supramoleculares son un tipo diferente de estructura grande, relacionados con macromoléculas. En un ensamblaje supermolecular, partes de la estructura se mantienen unidas por interacciones muy fuertes, pero no necesariamente por enlaces covalentes. Por ejemplo, se puede considerar que un polímero en el que las cadenas se mantienen unidas mediante reticulaciones físicas tales como enlaces de hidrógeno forma un ensamblaje supermolecular.
El ADN es un ejemplo de un ensamblaje supramolecular. Cada cadena de ADN es un copolímero alternante de azúcar-fosfato. A lo largo de esta columna vertebral, hay unidades colgantes “base”, adenina, citosina, guanina o timina.
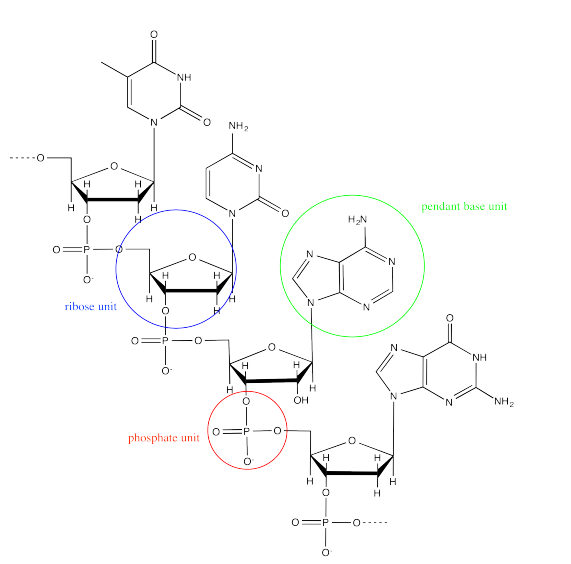
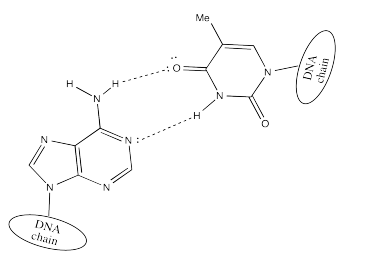
Dos cadenas de ADN forman un ensamblaje supramolecular helicoidal a través de interacciones de enlaces de hidrógeno que se forman entre las bases. La timina puede formar enlaces de hidrógeno preferentemente con adenina.
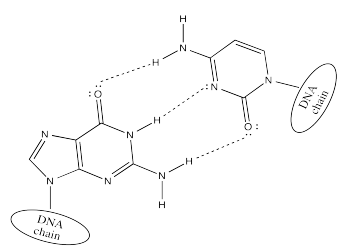
El hidrógeno de la citosina se une preferentemente con la guanina.
Hay una serie de formas diferentes en las que se pueden formar ensamblajes supramoleculares sintéticos. Este tipo de estructuras han ido recibiendo una mayor atención en los últimos años ya que los investigadores intentan desarrollar nuevos materiales con propiedades útiles. Existen algunos métodos comunes a través de los cuales se forman los ensamblajes. Analizaremos los enlaces de hidrógeno, la química hospedador-huésped y la química de coordinación.
Enlace de hidrógeno
Los enlaces de hidrógeno son una forma común de construir ensamblajes supramoleuculares. Bert Meijer de la Universidad Técnica de Eindhoven en los Países Bajos ha desarrollado una serie de sistemas que utilizan este enfoque. Por ejemplo, los copolímeros de injerto se han ensamblado en su laboratorio colgando cadenas colgantes en una cadena principal de polímero a través de enlaces de hidrógeno.
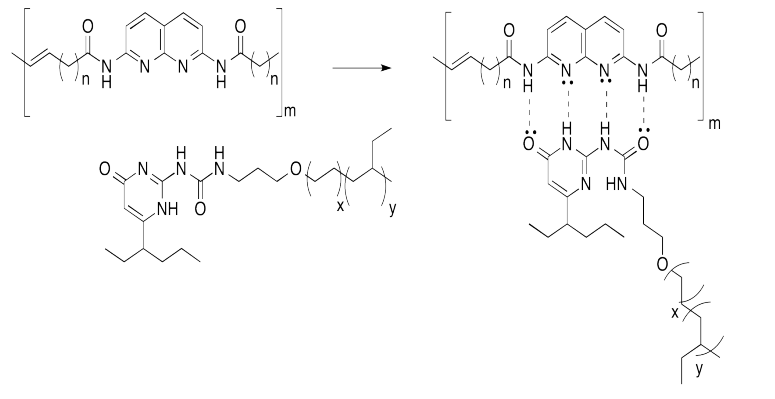
Este enfoque se puede representar en caricatura, a continuación, en la que los elementos de enlace de hidrógeno son cajas y las líneas son cadenas o colas flexibles.
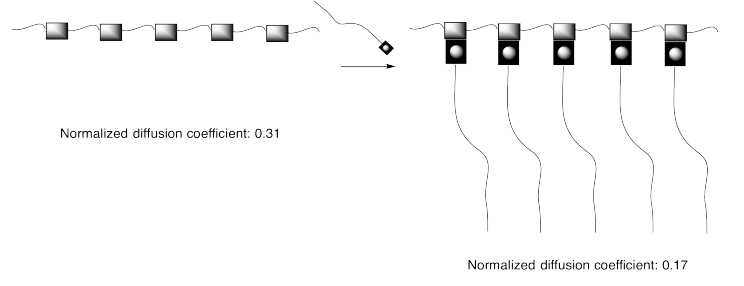
Ejercicio\(\PageIndex{1}\)
Los coeficientes de difusión citados en la imagen anterior están relacionados con la facilidad con la que los compuestos pueden moverse a través de una solución. Cuanto mayor sea el coeficiente de difusión, más fácilmente se mueve el compuesto a través de la solución.
- ¿Cómo se relaciona el coeficiente de difusión con la viscosidad?
- Explicar la diferencia entre los coeficientes de difusión de los dos compuestos anteriores.
- Respuesta a:
-
La viscosidad está relacionada con la cantidad de arrastre en el fluido. Cuanto más arrastre, los solutos más lentos serán capaces de moverse, por lo que el coeficiente de difusión está inversamente relacionado con la viscosidad (es decir, un coeficiente de difusión mayor debería correlacionarse con menor viscosidad).
- Respuesta b:
-
El polímero de cadena regular se difunde más fácilmente que el copolímero injerto/ensamblaje supramolecular porque las cadenas colgantes en este último conducen a un mayor enredo.
Complejos Host-Huésped
Otro enfoque de los ensamblajes supramoleculares es explotar las interacciones hospedador-huésped para unir diferentes partes del ensamblaje. Los complejos huésped-huésped actúan un poco como enzimas y sus sustratos en biología, o como materiales unidos dentro de zeolitas. La idea es que una molécula tenga una cavidad o abertura lo suficientemente grande como para que otra molécula encaje dentro. Es un poco como una básquetbol encajando en una canasta de durazno.
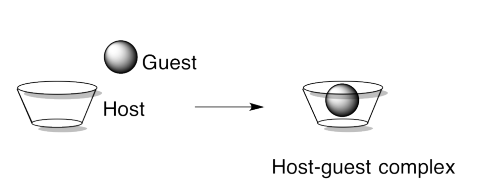
Podría haber una atracción física (una fuerza intermolecular) entre un huésped y un huésped, pero no tiene que haber. Julius Rebek del Instituto Scripps ha desarrollado complejos anfitriones que albergarán a huéspedes normalmente distantes como N 2. Parte de la razón por la que los huéspedes pueden quedar cómodamente instalados sin atracciones intermoleculares implica el hecho de que la molécula en su interior tendría que tomar un camino muy particular para poder escapar.
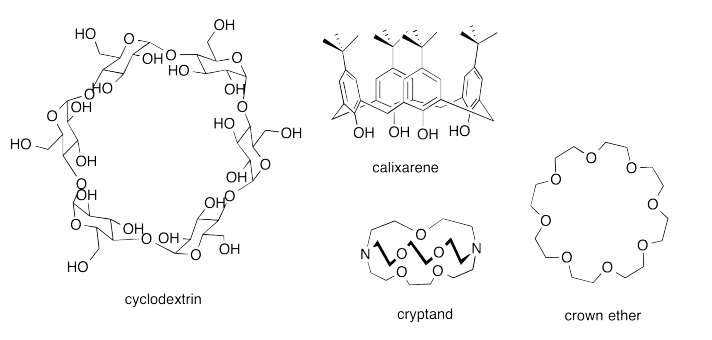
A continuación se muestran varios compuestos hospedadores. Cada uno de ellos está diseñado para tener un espacio cerrado de algún tipo. En algunos casos no es más que un anillo, pero eso es suficiente para evitar que el huésped se escape por esos lados.
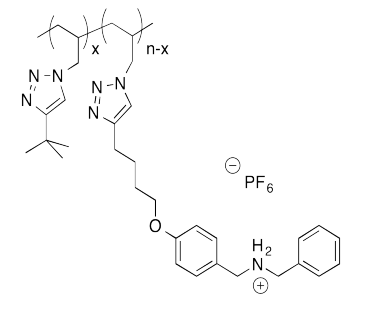
Ejercicio\(\PageIndex{2}\)
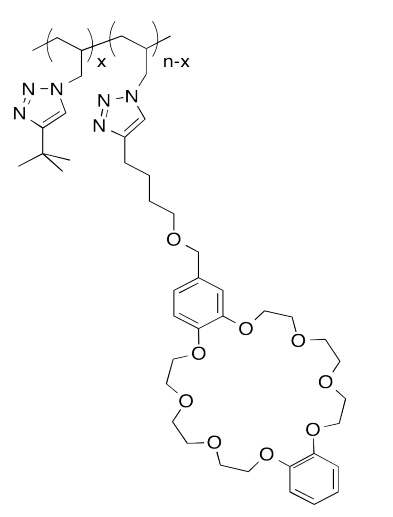
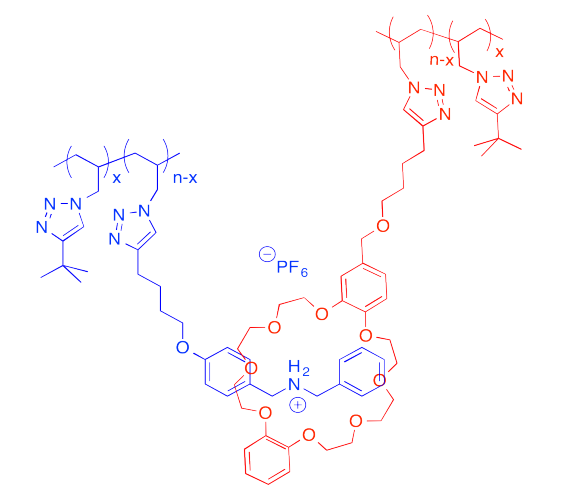
El siguiente sistema host-invitado fue diseñado en el laboratorio de Taichi Ikeda en el Instituto Nacional de Ciencia de Materiales en Japón. En la notación polimérica, “x” y “n-x” son solo números de unidades repetitivas. Cuando las soluciones de los dos polímeros se mezclan entre sí, se forma un gel elástico.
- Dibuja una caricatura de cada uno de los polímeros y del conjunto vinculado anfitrión-invitado.
- ¿Qué hace que este anfitrión e invitado sean especialmente atractivos el uno para el otro?
- Describir la estructura de este ensamblaje, en términos de arquitecturas poliméricas vistas anteriormente.
- ¿Por qué el gel es elástico?
- Este gel es “autocurativo”: se puede cortar con un cuchillo, pero las piezas se pueden volver a unir de nuevo. Explique cómo ocurre este re-apego.
- Respuesta b:
-
Los pares solitarios en los oxígenos en el huésped se sentirían atraídos por los nitrógenos cargados positivamente en el huésped. Los grupos N-H en el huésped incluso actuarían como donantes de enlaces de hidrógeno a los oxígenos.
- Respuesta c:
-
Este ensamblaje supramolecular forma una arquitectura reticulada.
- Respuesta d:
-
El gel es elástico porque, aunque contiene cadenas flexibles y puede distorsionarse hasta cierto punto, en algún momento las reticulaciones lo tiran de nuevo a su posición original.
- Respuesta e:
-
Cuando se corta el gel, probablemente algunos invitados son alejados de sus anfitriones a lo largo de la superficie del corte. Cuando los bordes se vuelven a colocar juntos, los invitados pueden encontrar nuevos anfitriones y volver a formar la estructura reticulada.
Compuestos de Coordinación
Si no conoces los compuestos de coordinación, es posible que quieras comenzar con los complejos ácido-base de Lewis.
Se han reportado varias asambleas de este tipo en el laboratorio de Stephen Craig en la Universidad de Duke. Por ejemplo, mezclar una solución de ciertos compuestos de paladio en una solución de poli (vinilpiridina) (PVP) produce un espesamiento del líquido en una consistencia similar a la miel.
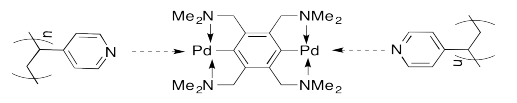
Como caricatura, este sistema se puede representar como se muestra a continuación. Los complejos de paladio forman reticulaciones físicas entre las unidades de piridina colgantes en las cadenas poliméricas.
Ejercicio\(\PageIndex{3}\)
Este es un problema de desafío para los estudiantes de Chem 251.
El laboratorio de Craig reportó los siguientes datos cinéticos para el sistema poli (vinilpiridina)/ML n en disolvente DMSO (dimetilsulfóxido). Recuerda, ML n solo significa “complejo de coordinación”.
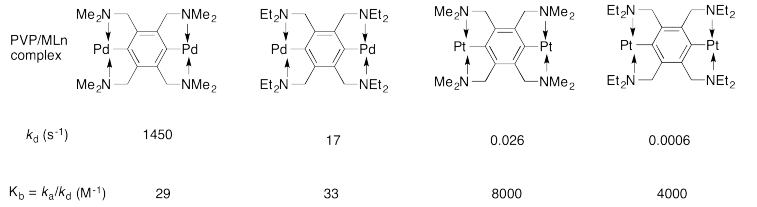
- La constante de velocidad k d se refiere a la disociación de un enlace PVP/ML n. Mostrar un mecanismo probable para esa reacción.
- Explique por qué la reacción es más rápida con el ligando sustituido con metilo que con el sustituido con etilo.
- ¿Es K b la constante de equilibrio para la formación del enlace PVP/ML n o para la disociación del enlace?
- Explicar la gran diferencia en valores de K b entre los complejos de paladio y los complejos de platino.
- Respuesta a:
-
El paladio en el complejo es Pd (II), por lo que es d8 y la estructura de la reticulación es cuadrada plana en paladio. El intercambio de ligandos probablemente ocurre a través de un proceso asociativo. Eso significa que antes de que la PVP se disocie, se uniría un nuevo ligando; este ligando es probablemente una molécula solvente, DMSO.
- Respuesta b:
-
El aumento del hacinamiento en el ligando sustituido con etilo, en comparación con el metilo, dificultaría la aproximación del DMSO durante la sustitución, ralentizando la reacción.
- Respuesta c:
-
K b se define como k a/k d, la constante de velocidad para el paso de asociación sobre la constante de velocidad para la etapa de disociación. Es la constante de unión para la formación de PvP-Pd.
- Respuesta d:
-
El paladio es un metal de transición de segunda fila mientras que el platino es un metal de transición de tercera fila. Los metales de la tercera fila tienen mayores energías de división del campo ligando que los metales de la segunda fila y generalmente son menos lábiles.

