13.5: Vinculación Pi con orbitales p
- Page ID
- 80469
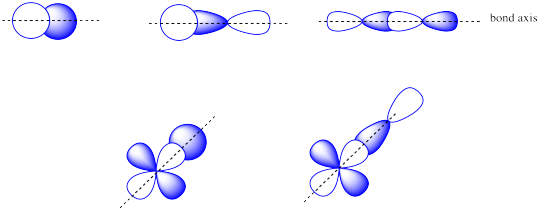
Anteriormente, vimos que p orbitales que se encuentran a lo largo del mismo eje pueden interactuar para formar enlaces.
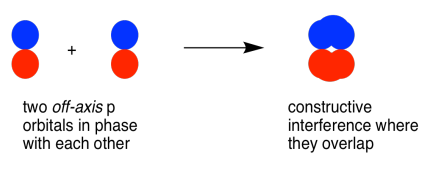
Los orbitales p paralelos, pero no colineales, también pueden interactuar entre sí. Se acercarían uno al otro lado del otro, por encima y por debajo del eje de enlace entre los dos átomos. Pueden estar lo suficientemente cerca entre sí como para solaparse, aunque no se superponen tan fuertemente como los orbitales que se encuentran a lo largo del eje del enlace. Pueden hacer una combinación en fase, como se muestra a continuación.
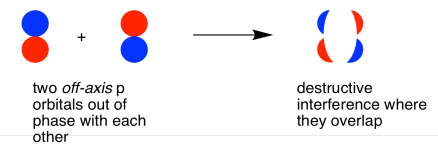
También podrían hacer una combinación fuera de fase, como se muestra a continuación.
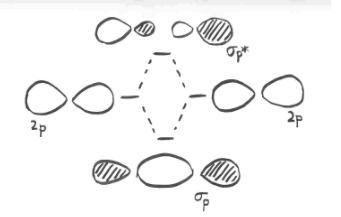
- los orbitales p paralelos pueden superponerse para producir combinaciones de unión y antiadhesión.
- los orbitales resultantes contienen nodos a lo largo del eje de enlace.
- la densidad electrónica se encuentra por encima y por debajo del eje del enlace.
- esto se llama un enlace p (pi).
La ilustración anterior es para un conjunto de p orbitales que son ortogonales al eje de enlace. La segunda imagen muestra el resultado de la interferencia constructiva (o destructiva). Se podría mostrar una imagen similar para el otro conjunto de orbitales p.
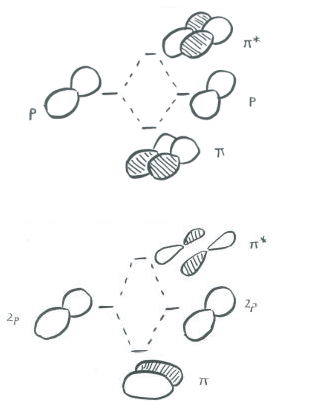
En un grupo principal especies diatómicas como dinitrógeno, un orbital p que se extiende a lo largo del eje de enlace puede participar en la unión s. Los dos orbitales p ortogonales al eje de unión pueden acoplarse en la unión p. Habrá combinaciones tanto de unión como de antiadhesión.
Así como los orbitales de unión sigma muestran longitudes de onda progresivamente más cortas a lo largo del eje de unión a medida que van a mayor energía, también lo hacen los orbitales de unión pi. En otras palabras, hay más nodos en los orbitales de mayor energía que en los de menor energía.
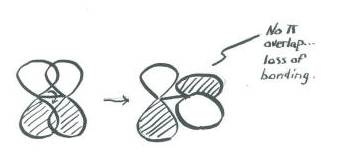
Una consecuencia importante de la distribución espacial o “forma” de un orbital p es que no es simétrica con respecto al eje de enlace. A s orbital no se ve afectada cuando el átomo en un extremo del enlace es rotado con respecto al otro. Un orbital p se ve afectado por la rotación. Si un átomo gira con respecto al otro, el orbital p tendría que estirarse para mantener la conexión. Los orbitales no serían capaces de superponerse, por lo que se perdería la conexión entre los átomos.
Ejercicio\(\PageIndex{1}\)
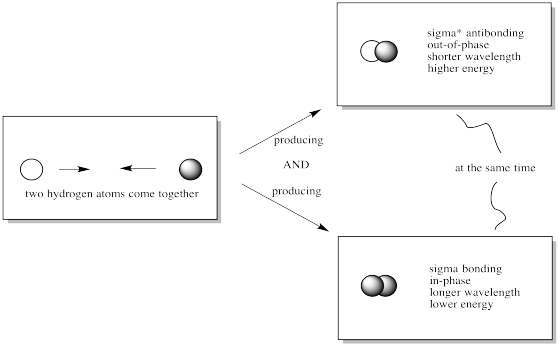
Cuando los orbitales 1s de dos átomos de hidrógeno se combinan para formar una molécula de hidrógeno, ¿qué orbitales moleculares se forman?
Dibuja un cuadro.
- Contestar
-
Cuando se combinan 2 orbitales atómicos, se forman 2 orbitales moleculares: uno orbital de enlace en fase y otro orbital antienlace fuera de fase.
Ejercicio\(\PageIndex{2}\)
Las combinaciones en fase de orbitales atómicos dan orbitales ______________.
Dibuja un cuadro
- Contestar
-
Las combinaciones de fase Ain de orbitales atómicos dan orbitales de unión.
Ejercicio\(\PageIndex{3}\)
Las combinaciones fuera de fase de orbitales atómicos dan orbitales ______________.
Dibuja un cuadro.
- Contestar
-
Las combinaciones fuera de fase de orbitales atómicos dan orbitales antiadhesión.
Ejercicio\(\PageIndex{4}\)
Las combinaciones de ______________ orbitales atómicos conducen a orbitales σ.
Dibuja imágenes.
- Contestar
-
Las combinaciones de s + s OR s + p OR p + p OR s + d OR p + d orbitales atómicos pueden conducir a orbitales σ.
Ejercicio\(\PageIndex{5}\)
Las combinaciones de ______________ orbitales atómicos conducen a π orbitales.
Dibuja imágenes.
- Contestar
-
Las combinaciones de orbitales atómicos lado a lado p + p o p + d conducen a orbitales π.

Ejercicio\(\PageIndex{6}\)
¿Cuál orbital molecular es típicamente el más alto en energía?
a. p
b. σ
c. π*
d. π
e. σ*
- Contestar
-
e) σ*
Ejercicio\(\PageIndex{7}\)
¿Por qué el orbital 1s no puede interactuar con un orbital 2s?
Pista: ¿Por qué un enlace Li 2 O es más fuerte que un enlace K 2 O?
- Contestar
-
Li + y O 2- son más similares en tamaño que K + y O 2-, por lo que el enlace entre Li + y O 2- es más fuerte.
La diferencia de energía entre los orbitales 1s y los orbitales 2s es demasiado grande, por lo que no pueden interactuar. Para que los orbitales interactúen, los orbitales necesitan tener la misma simetría, estar en el mismo plano, y ser similares en energía.
Ejercicio\(\PageIndex{8}\)
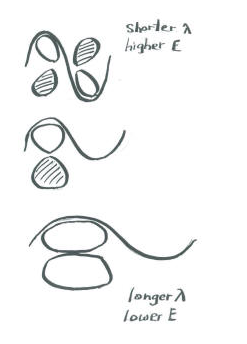
Agrega algunas palabras para explicar las ideas que se transportan en estos dibujos.
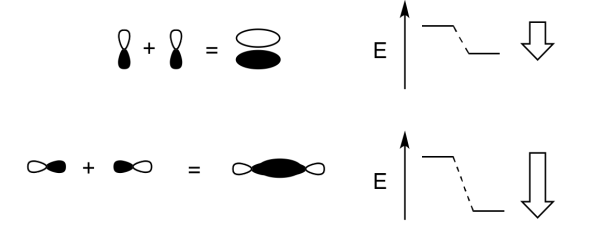
- Contestar
-
Cuando dos orbitales p paralelos se combinan fuera de fase, se produce una intereferencia destructiva.
Hay un nodo entre los átomos.
La energía de los electrones aumenta.
Cuando dos orbitales p paralelos se combinan en fase, se produce interferencia constructiva.
No hay ningún nodo entre los átomos; los electrones se encuentran por encima y por debajo del eje que conecta los átomos.
La energía de los electrones disminuye.

