13.6: Ensamblar el diagrama completo y la población de electrones
- Page ID
- 80513
Hasta ahora, hemos mirado las formas en que pares de orbitales atómicos podrían combinarse para formar orbitales moleculares —para formar enlaces—. Así como pensamos que hay una progresión de orbitales atómicos desde la energía más baja a la más alta (1s, 2s, 2p, 3s...), podemos organizar estos orbitales moleculares por orden de su energía.
En gran medida, se puede considerar que el orden de los orbitales moleculares en energía sigue del orden de los orbitales atómicos a partir de los cuales se construyen. Hay algunas desviaciones de esa regla, a veces, pero ese es el lugar más sencillo para comenzar. Entonces, en una molécula, los orbitales moleculares de menor energía serían los formados a partir de los orbitales atómicos de menor energía, los orbitales 1s.
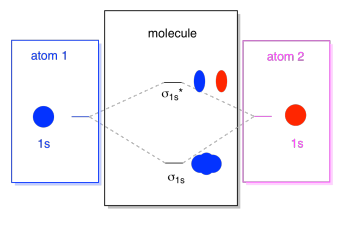
Lo que vemos aquí es un diagrama de interacción orbital molecular. La mitad del diagrama es solo el diagrama de energía orbital molecular. Es análogo al diagrama de energía orbital atómica (que va 1s, 2s, 2p, 3s...). El orden de la energía hasta el momento es σ 1s, σ 1s *. Los lados del diagrama solo hacen referencia de nuevo a donde vinieron esos orbitales moleculares, con líneas punteadas para guiarte de un lugar a otro. En conjunto, la imagen dice que el orbital 1s en un átomo y el orbital 1s en el otro átomo pueden combinarse de dos maneras diferentes, produciendo la energía más baja, uniendo σ 1s y la de mayor energía, antiunión σ 1s *.
Tenga en cuenta que aún no hemos agregado ningún electrón a ese diagrama de energía orbital molecular, pero cuando lo hagamos, simplemente los rellenaremos de abajo hacia arriba, tal como lo haríamos con un diagrama de energía orbital atómica.
El siguiente conjunto más bajo de orbitales atómicos es el nivel 2s. Estos orbitales esféricos combinarían mucho como orbitales 1s, y obtendríamos un diagrama similar, sólo a un nivel de energía ligeramente superior.
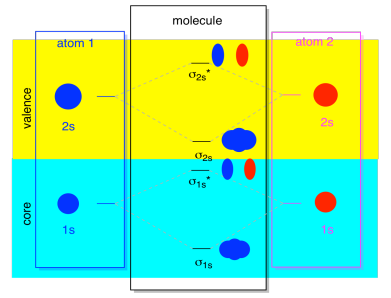
La mayor parte del tiempo, no vamos a ver tanto los σ 1s como los σ 2s mostrados en el diagrama. Eso es porque si hay electrones 2s, entonces esos electrones 1s son realmente electrones centrales, no valencia. Están enterrados un poco más profundamente en el átomo, y no juegan un papel muy importante en la vinculación. Ignorar los electrones centrales es bastante común; si recuerdas, en configuraciones de electrones atómicos podríamos escribir [He] 2s 2 2p 4 en lugar de 1s 2 2s 2 2p 4 para oxígeno; estábamos ignorando el núcleo. Cuando dibujamos estructuras de Lewis, le dimos al oxígeno seis electrones, en lugar de ocho; estábamos ignorando el núcleo.
En el contexto de MO, supongamos que tenemos 2s electrones. Eso debe significar que cada átomo tiene dos electrones 1s propios, para un total de cuatro. Cuando esos cuatro electrones se rellenan en el diagrama MO de abajo hacia arriba, ocuparán tanto el enlace σ 1s como el antienlace σ 1s *. El efecto de que ambas combinaciones estén ocupadas es cancelar la unión; esos dos pares de electrones permanecen sin unión. Para que podamos ignorarlos y realmente no nos falta nada.
Los orbitales 2s no son los únicos en el segundo caparazón. También hay orbitales 2p. Recuerde, hay un par de formas muy diferentes en las que p orbitales pueden combinarse entre sí, dependiendo de qué eje se encuentren. Si no se encuentran paralelos entre sí —es decir, si son perpendiculares entre sí, como una p x y una p y — entonces no pueden interactuar entre sí en absoluto. El p z en un átomo podría interactuar con el p z en el otro átomo, sin embargo, porque son paralelos entre sí.
Por lo general, definimos el eje z como tendido a lo largo de la línea entre los dos átomos que estamos viendo. Dos orbitales p z estarían a lo largo de ese eje, cada uno con un lóbulo que se extiende hacia el espacio entre los átomos, y cada uno con otro lóbulo que se extiende lejos, en la otra dirección
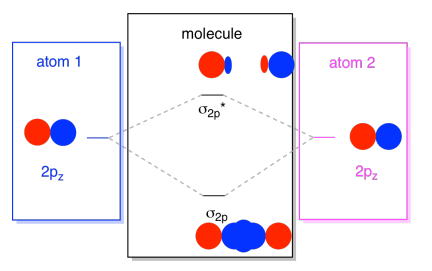
Las combinaciones resultantes se llaman σ porque se encuentran a lo largo del eje entre los átomos (eso es exactamente lo que σ significa, en términos de unión). Hay una combinación σ, si los lóbulos superpuestos están en fase entre sí, y σ* combinación, si esos lóbulos están desfasados entre sí. Debido a que estos nuevos orbitales surgen de los orbitales atómicos 2p, los llamamos σ 2p y σ 2p *.
También están aquellos p orbitales que no se encuentran a lo largo del eje de enlace, o el eje entre los dos átomos. Los orbitales p x son perpendiculares a los orbitales p z que acabamos de observar, y por lo tanto perpendiculares al eje entre los enlaces. Sin embargo, siguen siendo paralelos entre sí, y aún pueden formar combinaciones. Estos dos orbitales formarían una combinación en fase y una combinación fuera de fase.
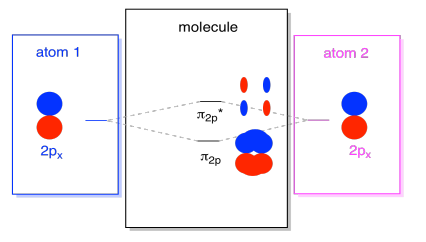
Tenga en cuenta que la separación energética entre estas dos combinaciones es un poco menor que la brecha entre los niveles σ 2p y σ 2p *. La diferencia está relacionada con el grado de superposición entre los orbitales atómicos. Los orbitales en el eje se proyectan fuertemente en el mismo espacio; se superponen mucho e interactúan fuertemente. Los orbitales fuera del eje se rozan entre sí, interactuando con menos fuerza y dando como resultado cambios energéticos más pequeños. La brecha entre el orbital π 2p y el orbital π 2p * es, por lo tanto, mucho menor que el que existe entre los orbitales σ 2p y σ 2p *.
En realidad hay dos de esos orbitales p fuera del eje. Además del conjunto p x, tendríamos un conjunto p y. Si el conjunto p x está en el plano de la pantalla, el conjunto p y tiene un orbital sobresaliendo al frente y otro oculto detrás. Sin embargo, las combinaciones entre los dos orbitales p y son exactamente las mismas que las que vimos entre los dos orbitales p x. Simplemente se rotan en un plano perpendicular con respecto a las combinaciones p x.
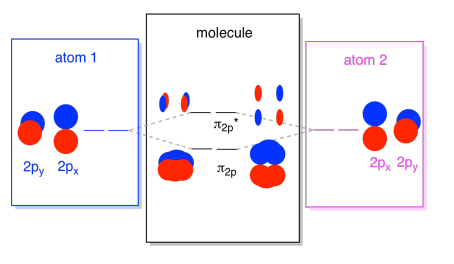
Podemos juntar todos esos orbitales basados en 2p en un solo diagrama. Está empezando a llenarse un poco más, pero este diagrama es solo una combinación de las piezas que ya hemos visto. Tenga en cuenta que los orbitales atómicos p x, p y p z comienzan todos con la misma energía (los hemos apilado aquí para que aún pueda ver la correlación entre los orbitales atómicos y moleculares). Eso significa que los orbitales π 2p y π 2p * se “anidarán” entre los orbitales σ 2p y σ 2p *.
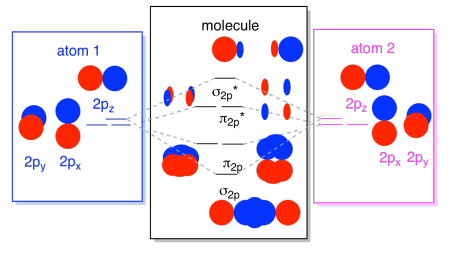
Por último, teniendo en cuenta que los orbitales 2p son más altos en energía que los orbitales 2s, podemos combinar esas imágenes en un solo diagrama. Nuevamente, ya hemos visto estas piezas individuales; ahora apenas las estamos armando.
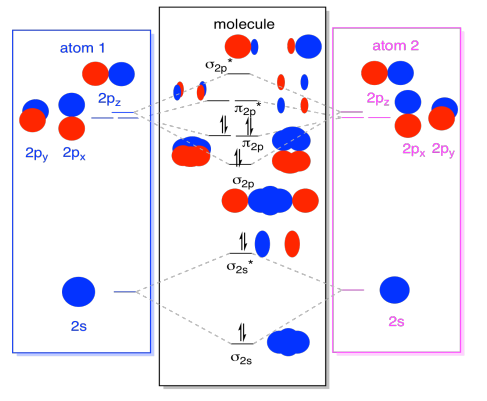
Mientras estamos en ello, podemos sumar los electrones. ¿Cómo? Es sólo el número total de electrones de valencia. Para un ejemplo, hemos utilizado N 2. Cada nitrógeno tiene cinco electrones de valencia, para un total de diez, así que acabamos de llenar diez electrones, comenzando en la parte inferior del diagrama de nivel de energía orbital molecular. Si esta fuera otra molécula, como F 2 o O 2, construiríamos el diagrama general de manera similar, pero solo usaríamos un número diferente de electrones.
La imagen orbital que hemos descrito anteriormente es realmente solo una imagen potencial de la estructura electrónica del dinitrógeno (y cualquier otro grupo principal o diatómico del bloque p). No obtendremos una imagen real de la estructura de dinitrogen hasta que poblemos estos niveles potenciales con electrones.
- Solo los niveles de energía con electrones tienen un efecto sobre la energía (y el comportamiento) de la molécula.
En otras palabras, la energía de los electrones determina el comportamiento de la molécula. Los otros niveles de energía son sólo posibilidades que permanecen incumplidas.
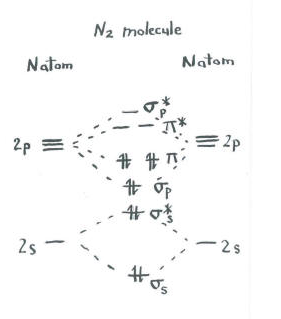
Piensa en el cuadro de dinitrogen.
- Cada nitrógeno tiene cinco electrones de valencia.
- Hay un total de diez electrones.
- Dos cada uno entra en los niveles de unión s s y s s * antiadhesión. Recuerden, los mantuvimos separados del conjunto p como simplificación.
- Dos cada uno entra en la unión s p y cada uno de los niveles de unión p.
Los orbitales restantes (s p * antiadhesión y cada uno de los niveles p * antiadhesión) están desocupados. Se trata de niveles imaginarios que no juegan un papel en la determinación de la energía del dinitrógeno. En un cálculo orbital molecular real, los electrones en estos niveles contribuirían a la energía global de la molécula.
Obtenemos información adicional de esta imagen. Por ejemplo, podemos ver el orden de los bonos en dinitrogen.
- El orden de los enlaces es solo el número de enlaces entre un par de átomos.
- El orden de enlace es uno de varios factores que influyen en la fuerza del enlace covalente.
- Cuanto mayor sea el orden de los enlaces, más electrones se comparten entre los átomos y más fuerte es el enlace.
En dinitrogen, los niveles de unión s s s s * antiadhesión se cancelan entre sí. Un par es menor en energía que en el átomo, pero el otro es mayor. No hay descenso neto de la energía. Estos electrones no contribuyen a un enlace nitrógeno-nitrógeno. Estos son pares de electrones que no se unen.
Los seis electrones en el enlace s p y los niveles de enlace p, sin embargo, representan una disminución en la energía a partir de los niveles de energía en los átomos de nitrógeno libres. Estos tres pares de electrones de baja energía indican tres enlaces entre los átomos de nitrógeno.
Recuerde, hemos hecho algunos atajos en esta imagen, y un cálculo orbital molecular real podría dar resultados ligeramente diferentes. Sin embargo, aún revelaría un orden de enlace de tres, así como dos pares de electrones no enlazantes.
Además, a veces las imágenes orbitales moleculares se muestran de diferentes maneras. Un diagrama de interacción orbital molecular muestra cómo los orbitales atómicos o moleculares se combinan para hacer nuevos orbitales. A veces, podemos estar interesados solo en los niveles de energía orbitales moleculares en sí mismos, y no de dónde provienen. Un diagrama de nivel de energía orbital molecular solo muestra los niveles de energía en la molécula. Frecuentemente, pero no siempre, se muestran diagramas de nivel de energía sin ninguna imagen de los orbitales, con el fin de centrar la atención en los niveles de energía, que de manera fundamental son la parte más importante del cuadro. Además, debido a que solo los niveles de energía ocupada contribuyen realmente a la energía de la molécula, a veces los orbitales desocupados de mayor energía quedan fuera de la imagen.

Muy a menudo los resultados de los cálculos orbitales moleculares refuerzan lo que predeciríamos de las estructuras de Lewis. Si dibujas una estructura de Lewis de dinitrogen, también predecirás un triple enlace nitrógeno-nitrógeno. La principal ventaja de la teoría orbital molecular es que permite la predicción cuantitativa de energía cuando hacemos un cálculo real en una computadora. Además, es importante darse cuenta de que no existe una razón real para la regla del octeto a menos que consideremos la mecánica cuántica. Las estructuras de Lewis se basan en una observación empírica de que los electrones forman pares y octetos, sin intentar explicar por qué. La teoría orbital molecular toma algunas relaciones fundamentales de la física y las aplica a moléculas muy complicadas con muy buen éxito. Con sólo conocer el número de electrones en la molécula, y por saber aproximadamente dónde se encuentran los núcleos en la estructura, los cálculos orbitales moleculares dan información muy útil sobre la energía. Además, en casos más complicados que N 2, estos cálculos pueden incluso corregir nuestra primera suposición sobre la geometría molecular y dónde se encuentran los enlaces.
Ejercicio\(\PageIndex{1}\)
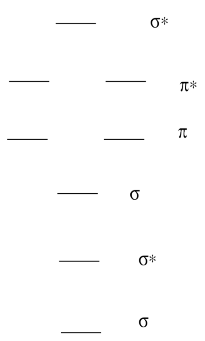
Un diagrama orbital molecular para una molécula diatómica (dos átomos) siempre tiene el mismo patrón básico.
- Dibuja una imagen de los niveles.
- Etiquetar cada nivel con σ, σ*, π, π*
- Contestar
Ejercicio\(\PageIndex{2}\)
Un diagrama orbital molecular para una molécula diatómica (dos átomos) varía en el número de electrones. ¿Cómo se pueblan los electrones?
- Contestar
-
• Contar los electrones de valencia en la molécula. Ese es el número de electrones de valencia en cada átomo, ajustados para cualquier carga en la molécula. (por ejemplo, C 2 2- tiene 10 electrones de valencia: 4 de cada carbono —es decir 8— y dos más para la carga 2-).
• Llene primero los electrones en los orbitales de menor energía.
• Los electrones pares después de todos los orbitales al mismo nivel de energía tienen un electrón.
Ejercicio\(\PageIndex{3}\)
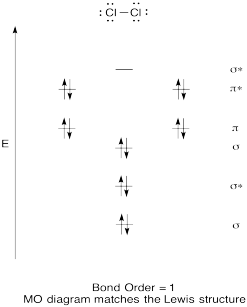
Construir un diagrama orbital molecular cualitativo para cloro, Cl 2. Comparar el orden de enlace con el visto en la estructura de Lewis (recuerde que un electrón en un orbital antienlace cancela la estabilización debido a la unión de un electrón en un orbital de enlace).
- Contestar
Ejercicio\(\PageIndex{4}\)
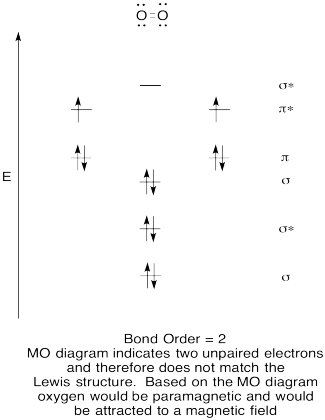
- Construir un diagrama orbital molecular cualitativo para oxígeno, O 2.
- Comparar el orden de unión con el visto en la estructura de Lewis.
- ¿De qué otra manera se compara esta imagen MO de oxígeno con la estructura de Lewis? ¿Qué te dicen las dos estructuras sobre el emparejamiento de electrones?
- Los compuestos que tienen todos sus electrones emparejados se denominan diamagnéticos. Aquellos con electrones desapareados son referidos como paramagnéticos. Los materiales paramagnéticos son atraídos por un campo magnético, pero las cosas diamagnéticas no lo son. ¿Cómo esperarías que se comportara el oxígeno molecular?
- Contestar
-
Ejercicio\(\PageIndex{5}\)
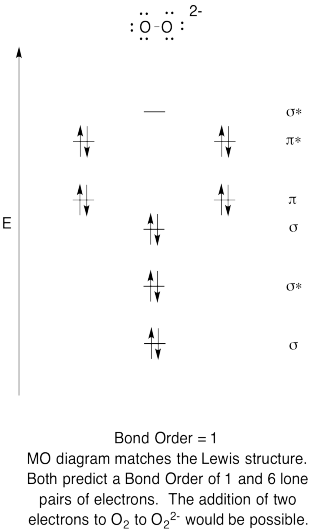
- Construir un diagrama orbital molecular cualitativo para anión peróxido, O 2 2-.
- Comparar el orden de unión con el visto en la estructura de Lewis.
- ¿De qué otra manera se compara esta imagen MO de oxígeno con la estructura de Lewis? ¿Qué te dicen las dos estructuras sobre el emparejamiento de electrones?
- Basado en imágenes orbitales moleculares, ¿con qué facilidad cree que el dioxígeno podría reducirse a peróxido (mediante la adición de dos electrones)?
- Contestar
-
Ejercicio\(\PageIndex{6}\)
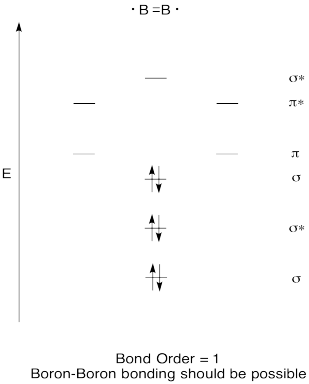
Construir un diagrama orbital molecular cualitativo para el diboro, B 2. ¿Crees que los enlaces boro-boro podrían formarse fácilmente, a partir de esta imagen?
- Contestar
-
Ejercicio\(\PageIndex{7}\)
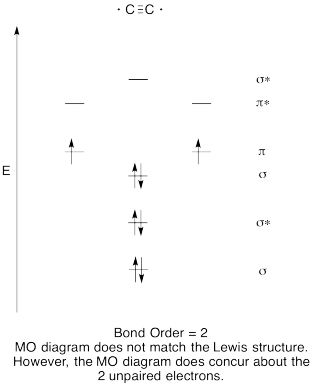
- Construir un diagrama orbital molecular cualitativo para dicarbono, C 2.
- Comparar el orden de unión con el visto en la estructura de Lewis.
- ¿De qué otra manera se compara esta imagen MO de oxígeno con la estructura de Lewis? ¿Qué te dicen las dos estructuras sobre el emparejamiento de electrones?
- Contestar
-
Ejercicio\(\PageIndex{8}\)
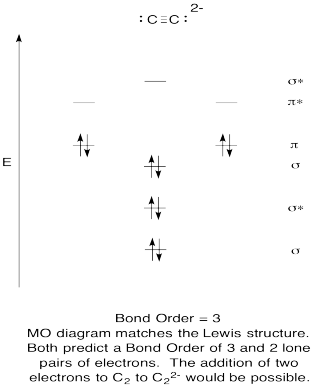
- Construir un diagrama orbital molecular cualitativo para anión acetiluro, C 2 2-.
- Comparar el orden de unión con el visto en la estructura de Lewis.
- ¿De qué otra manera se compara esta imagen MO de oxígeno con la estructura de Lewis? ¿Qué te dicen las dos estructuras sobre el emparejamiento de electrones?
- Basado en imágenes orbitales moleculares, ¿con qué facilidad cree que el dicarbono podría reducirse a acetilida (mediante la adición de dos electrones)?
- Contestar
-
Ejercicio\(\PageIndex{9}\)
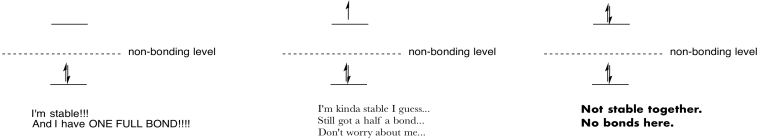
Hacer dibujos y notas para resumir el efecto de poblar orbitales antiadhesión.
- Contestar
-
Ejercicio\(\PageIndex{10}\)
Investigadores de Johns Hopkins reportaron recientemente la formación de Na 4 Al 2 en una descarga de arco pulsado (ponen mucha corriente eléctrica a través de una muestra de sodio y aluminio; Xinxing Zhang, Ivan A. Popov, Katie A. Lundell, Haopeng Wang, Chaonan Mu, Wei Wang, Hansgeorg Schnöckel, Alexander I. Boldyrev, Kit H. Bowen, Angewandte Chemie Edición Internacional, 2018, 57 (43), 14060-14064. Derechos de autor 2018, John Wiley & Sons. Usado con permiso.).
- El compuesto es iónico. Explicar qué átomos forman los cationes, con base en tendencias periódicas.
- Por lo tanto, ¿qué átomos forman el anión?
- El anión es una molécula. ¿Cuál es la carga de esta molécula?
- Mostrar cómo calcular los electrones de valencia totales en este anión molecular.
- Dibuja una estructura de Lewis para este anión molecular.
- Construir un diagrama de nivel de energía orbital molecular diatómica para esta molécula. Marcar los niveles de energía (sigma, pi, etc.) y agregar el número correcto de electrones.
- Mostrar cómo calcular el orden de enlace en la molécula.
- Contestar
-
a) Na, porque el Na tiene un menor potencial de ionización (y una electronegatividad menor) que Al.
b) Al
c) 4-, porque hay cuatro Na +
d) total e - = 2 x 3 e - (por Al) + 4 e - (para la carga negativa) = 10 e-

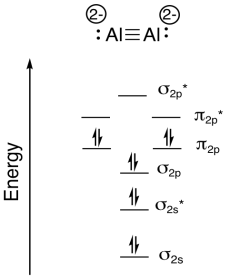
g)\(\textrm{bond order} = \frac{( \# bonding \: e^{-} - \# antibonding \: 3^{-})}{2} = \frac{8-2}{2}= 3\)

