13.16: Deslocalización en Aromáticos
- Page ID
- 80534
Los aromáticos son una clase especial de compuestos deslocalizados. El benceno es el ejemplo común de un compuesto aromático.
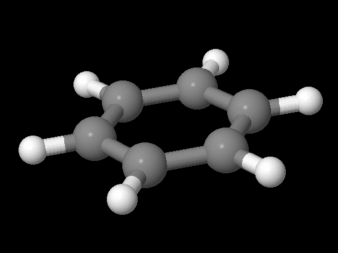
Ir a Animación CA12.6. Un modelo tridimensional de benceno.
Muchos compuestos en la naturaleza contienen “unidades de benceno” dentro de estructuras más grandes. Es tan común que ha recibido mucha atención a lo largo de los años.
Estas unidades de benceno a veces se llaman “fenilos” o, más generalmente, “arenos”.
El benceno es un buen ejemplo de una estructura deslocalizada. Es algo que podría estudiarse utilizando un enfoque de Huckel MO. Una de las pruebas experimentales de que el benceno tiene enlaces deslocalizados proviene de estructuras cristalinas. La primera estructura cristalina de rayos X del benceno fue realizada en 1929 por Kathleen Lonsdale. Este experimento permitió a Lonsdale medir las distancias entre los carbonos en benceno. Un enlace C-C en benceno tiene 1.40 Angstroms de largo. En comparación, un enlace C-C típico es de 1.47 Angstroms de largo, y un enlace C=C típico es de 1.35 Angstroms de largo. Los enlaces C-C en el benceno parecen estar en algún lugar entre un enlace doble y uno sencillo, y todos son iguales. No son alternantes, doble-solo-doble como sugiere la estructura de Lewis.
- El benceno tiene enlaces pi deslocalizados.
- A pesar de lo que dice la estructura de Lewis, todos los enlaces C-C del benceno tienen la misma longitud.
Podemos tratar de demostrar que los enlaces del benceno son todos iguales mediante el uso de dos estructuras de resonancia. Cuando hacemos eso, estamos diciendo que la molécula real se comporta un poco como una estructura de Lewis y un poco como la otra.
Ejercicio\(\PageIndex{1}\)
Dibujar dos estructuras de Lewis que juntas ilustran la deslocalización en benceno.
- Contestar
-

De alguna manera, los aromáticos se comportan de manera diferente a otros compuestos con enlaces C=C. Por ejemplo, hay reacciones que los alquenos experimentan con bastante facilidad, pero el benceno no. El bromo, Br 2 se agrega fácilmente a través de los dobles enlaces alquenos. El eteno, o CH 2 =CH 2, agregaría bromo para formar dibromoetano, BrCh 2 -CH 2 Br. Como resultado, el color rojo-marrón del bromo desaparece instantáneamente si se agrega a un alqueno, debido a que el bromo se consume rápidamente.
Los alquenos también reaccionan con hidrógeno, H 2. El hidrógeno puede agregarse a través de dobles enlaces para formar “hidrocarburos saturados” (hidrocarburos que no tienen dobles enlaces). Hexeno, CH 2 =CHCH 2 CH 2 CH 2 CH 3, podría reaccionar con hidrógeno para formar hexano, CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3. Sin embargo, esta reacción es mucho más lenta que la bromación. La bromación suele ocurrir instantáneamente. Hidrogenar algo requiere mucho trabajo. En general, se debe agregar algún tipo de catalizador, como el paladio metálico en polvo, antes de que ocurra algo, y el alqueno debe colocarse bajo una atmósfera de hidrógeno durante mucho tiempo.
El benceno se puede hidrogenar (para formar ciclohexano, C 6 H 12), pero es aún más difícil de lo habitual. Para un catalizador, el paladio realmente no servirá. Esto requiere platino u óxido de platino, que son un poco más reactivos. Además, pueden ser necesarias altas temperaturas así como altas presiones de hidrógeno (a menudo varias veces mayores que la presión atmosférica).
Tal vez el benceno se pueda bromar si se agrega el catalizador adecuado. El cloruro férrico funciona, pero resulta que tiene lugar una reacción completamente diferente. C 6 H 6 se convierte en C 6 H 5 Br. Todos los dobles enlaces siguen ahí. El átomo de bromo simplemente reemplaza a un átomo de hidrógeno.
- El benceno no experimenta las mismas reacciones que otros compuestos con enlaces C=C.
- De alguna manera, los aromáticos son más estables de lo esperado.
Históricamente, se ha hecho mucho acerca de que el benceno sea un anillo. Cuando fue aislada por primera vez por Michael Faraday en la década de 1820, la gente no tenía mucha idea de su estructura, y lo que podría parecer se debatió durante décadas. Hay una historia que August Kekule informó sobre asentir en un sillón y soñar con una serpiente mordiéndose la cola; dice que se despertó y tuvo la idea de que el benceno estaba compuesto por un círculo de átomos de carbono (confirmado por Lonsdale unos 65 años después). Tal vez la estructura especial del anillo del benceno le da estabilidad adicional.
- El benceno es deslocalizado y cíclico.
Entonces tal vez la estabilidad del benceno viene con tener conjugación y ser cíclico. Pero a lo mejor tampoco es suficiente. Hay otros compuestos que son tanto deslocalizados como cíclicos, pero que no muestran las propiedades del benceno. Por ejemplo, el ciclopentadieno tiene enlaces C-C largos y enlaces cortos C=C, y se comporta como un alqueno. No es aromático. ¿Por qué no? Quizás la diferencia es que el ciclopentadieno no tiene enlaces pi alternantes en todo el anillo. No tiene un orbital p conjugado en cada carbono. Hay una unidad CH 2 tetraédrica entre dos de los dobles enlaces. Ese carbono tetraédrico, o carbono sp 3, no tiene un orbital p libre que pueda usar para hacer dobles enlaces.

Ir a Animación MO16.2. Un modelo tridimensional de ciclopentadieno.
- El benceno está completamente conjugado, todo el camino alrededor del anillo.
El benceno no solo es cíclico, y no solo muestra conjugación, sino que la conjugación va alrededor y alrededor del anillo en un enlace pi sin fin. Eso debe diferenciarlo de otros compuestos con enlaces C=C. Sin embargo, el ciclooctatetraeno es cíclico y completamente conjugado, con cuatro dobles enlaces y cuatro enlaces simples en un anillo de ocho miembros. El ciclooctatetraeno se comporta exactamente igual que otros alquenos. Se hidrogena y se bromina y pierde sus dobles enlaces.
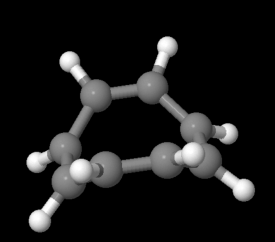
Ir a Animación MO16.3. Un modelo tridimensional de ciclooctatetraeno.
El ciclooctatetraeno es una canasta. Podrías sostener fruta en ella.
- El benceno es plano.
El benceno no solo es cíclico y está completamente conjugado alrededor del anillo, sino que es plano. A lo mejor eso es importante. Después de todo, si es plano, los orbitales p en carbonos adyacentes podrían alinearse uno al lado del otro. Serían perfectamente paralelos, y tendrían muy buena superposición. Para ser aromática, una molécula necesita estas tres características.
Una molécula muy similar debería ajustarse a estos criterios. El ciclobutadieno, C 4 H 4, sería cíclico, conjugado y plano. Debe ser aromático y extraestable, al igual que el benceno
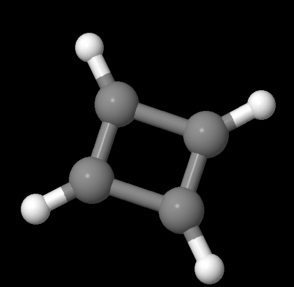
Ir a Animación MO16.4. Un modelo tridimensional de ciclobutadieno.
El problema es que el ciclobutadieno es increíblemente difícil de fabricar. La gente pasó años intentando. Cuando finalmente lograron hacerlo (o compuestos que contenían una unidad de ciclobutadieno), podían simplemente vislumbrarlo fugaz usando métodos espectroscópicos. Entonces se había ido. Reaccionó en cuanto llegó a existir.
- El ciclobutadieno es aún más reactivo que la mayoría de los alquenos (otros compuestos con enlaces C=C).
Las técnicas espectroscópicas que las personas utilizaron para detectar el ciclobutadieno parecían dar alguna información adicional al respecto. El ciclobutadieno no es cuadrado, es rectangular.
- El ciclobutadieno no se comporta como si tuviera enlaces pi deslocalizados. No parece estar conjugada.
¿Cuál es la diferencia? Es una simple cuestión de números.
- El ciclobutadieno tiene un número par de enlaces pi. No es aromático. Se le llama “anti-aromático”.
- El benceno tiene un número impar de enlaces pi. Es aromático.
Un tratamiento con Huckel MO de benceno y ciclobutadieno sí revela algunas diferencias. Antes de mirar eso, deberíamos ver la forma en que la gente suele dibujar las combinaciones de orbitales p en anillos. Debido a que la gente suele tener problemas para dibujar anillos de borde, miran el anillo desde arriba. Si miras el anillo desde arriba, los orbitales p se ven como círculos, porque solo puedes ver el lóbulo que está más cerca de ti. Eso es mucho más fácil de dibujar.
Al observar el benceno desde arriba, obtenemos los siguientes orbitales moleculares (abajo).
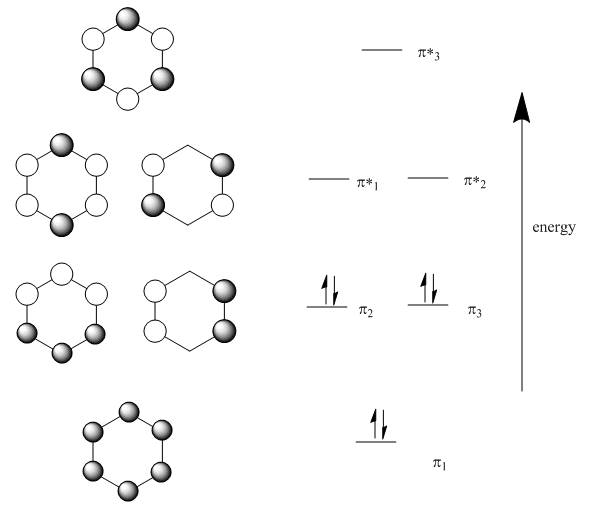
Tenga en cuenta que:
- Hay seis orbitales p involucrados en la unión pi, por lo que resultan seis combinaciones MO.
- Sólo hay una manera de obtener todos los orbitales en fase (o bien están en fase o no lo están).
- Esta combinación tiene las interacciones más vinculantes entre orbitales p vecinos. Produce un nuevo MO que es todo unión.
Hay una órbita molecular de menor energía que no tiene nodos a través de los bordes del anillo. Los electrones en este orbital tienen una longitud de onda mucho más extendida que en un enlace orbital p o en un enlace pi regular.
- Sólo hay una manera de sacar todos los orbitales fuera de fase (o bien están fuera de fase o no lo están).
- Esta combinación tiene seis nodos. Es totalmente antiadherencia.
Debido a que sólo puede haber nodos pares en un anillo (intente dibujar uno en el que p orbitales estén desfasados en un punto pero en ningún otro lugar), también puede haber combinaciones con dos nodos o cuatro nodos. Siempre hay formas alternas de llegar a estas imágenes, y siempre hay dos de cada una de estas combinaciones.
- La combinación con dos nodos sigue siendo mayoritariamente ligada. Tiene más interacciones en fase entre vecinos que interacciones fuera de fase.
- La combinación con cuatro nodos es en su mayoría antiadhesión. Tiene más interacciones fuera de fase entre vecinos que interacciones en fase.
Debido a que sólo hay seis electrones pi en el benceno (contarlos en la estructura de Lewis), todos los electrones pi están en orbitales de enlace. Están deslocalizados.
En el ciclobutadieno, las combinaciones orbitales funcionan de manera similar. Hay una combinación de todo en fase y una combinación de todo fuera de fase. Además, hay dos formas de obtener una combinación que esté igualmente en fase y fuera de fase.
Tenga en cuenta que, al igual que en el benceno, cuando hay múltiples formas de representar una combinación, generalmente se representa un orbital molecular para mostrar interacciones tanto de enlace como de antiunión. El otro suele mostrar el resultado neto, ya sea solo enlazante o antienlace o, en el caso del ciclobutadieno, ninguna interacción directa entre átomos adyacentes porque es un orbital no enlazante. Estas dos representaciones diferentes son parte de cómo se asegura que dos orbitales al mismo nivel de energía sean ortogonales entre sí, al igual que dos orbitales p en un mismo átomo podrían estar a lo largo del eje x o a lo largo del eje y, pero no ambos a lo largo del mismo eje. Necesitan salirse el uno del otro.
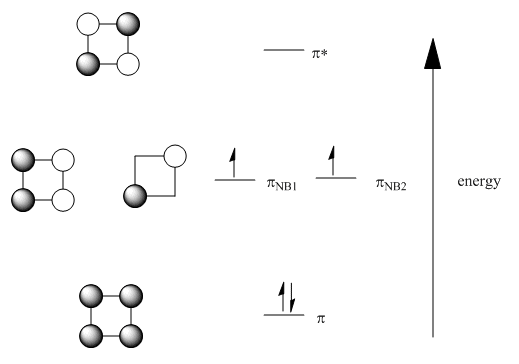
Si se deslocalizan, todos los electrones pi en el benceno son bajos en energía; se están uniendo. Sin embargo, en el ciclobutadieno, solo dos de los electrones pi están realmente enlazando; los otros dos son no enlazantes. Además, el diagrama orbital sugiere que dos de los electrones están desapareados, situación que suele hacer que las moléculas orgánicas sean muy reactivas. Se ha sugerido que el ciclobutadieno se distorsiona en un rectángulo para evitar esta sitiuación.
Los diagramas de nivel de energía para sistemas cíclicos y completamente conjugados se pueden dibujar muy rápidamente utilizando el método del círculo Frost. Para usar el método, dibuja un círculo. Dibuja la forma del compuesto cíclico dentro de este círculo. Una esquina de la forma debe estar en la parte inferior del círculo. Vas a agregar niveles alrededor del borde del círculo, uno por cada lugar donde una esquina toque el círculo.
Si miras suficientes sistemas de este tipo, surge un patrón. La regla de Huckel se utiliza para determinar si un sistema es aromático o “antiaromático”. Para aplicar la regla, la molécula debe ajustarse a los siguientes criterios:
- es cíclico
- está completamente conjugado en todo el camino alrededor del anillo
- es plano
Después de eso, si es aromático o antiaromático depende de las siguientes situaciones:
- Los sistemas aromáticos tienen un número impar de pares de electrones que participan en el sistema pi
- Los sistemas antiaromáticos tienen un número par de pares de electrones que participan en el sistema pi
El sistema pi se refiere a enlaces deslocalizados formados a partir de orbitales p que son perpendiculares al plano del anillo. En una estructura de Lewis, estos pueden ser obvios enlaces pi, o pueden ser pares solitarios o incluso orbitales p “vacíos”.
Ejercicio\(\PageIndex{2}\)
Indicar cuál de los siguientes compuestos sería aromático, antiaromático, o ninguno de los dos. Solo asumamos que todos son planos.
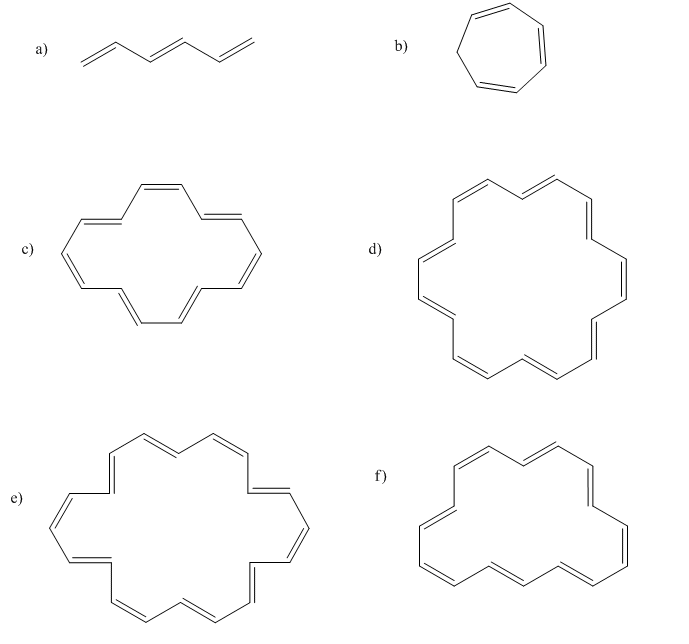
Contestar a-
- Respuesta b
-
- Respuesta c
-

- Respuesta d
-
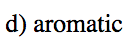
- Respuesta e
-
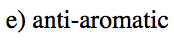
- Respuesta f
-
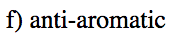
Las reglas de aromaticidad no se aplican únicamente a los hidrocarburos regulares. En ocasiones, los hidrocarburos aniónicos o catiónicos pueden tener propiedades aromáticas. Al igual que con el benceno, las especies aromáticas tienen geometrías regulares alrededor, aunque la estructura de Lewis sugiere que algunos de los enlaces carbono-carbono son dobles y algunos son simples. El anión ciclopentadienilo, C 5 H 5 -, es un ejemplo común. Se observa frecuentemente como ligando en complejos de metales de transición.
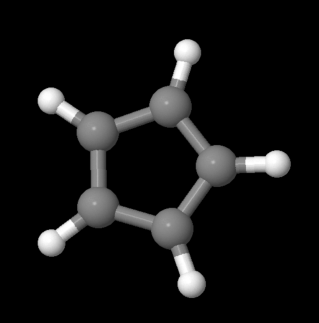
Figura\(\PageIndex{5}\): Modelo de bola y varilla del anión ciclopentadienilo.
Ir a Animación MO16.5. Un modelo tridimensional del anión ciclopentadienilo.
Ejercicio\(\PageIndex{3}\)
Indicar cuál de los siguientes cationes sería aromático, antiaromático, o ninguno de los dos. Solo asumamos que todos son planos.
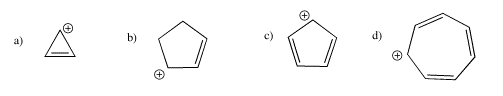
Contestar a-
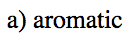
- Respuesta b
-
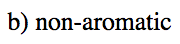
- Respuesta c
-
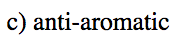
- Respuesta d
-
Ejercicio\(\PageIndex{4}\)
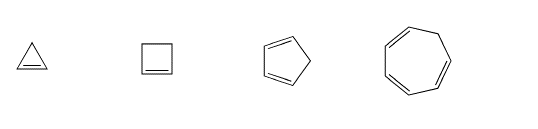
Indicar si los siguientes aniones serían aromáticos, antiaromáticos, o ninguno. Solo asumamos que todos son planos.
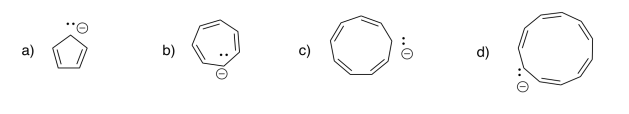
Contestar a-
- Respuesta b
-
- Respuesta c
-
- Respuesta d
-
Ejercicio\(\PageIndex{5}\)
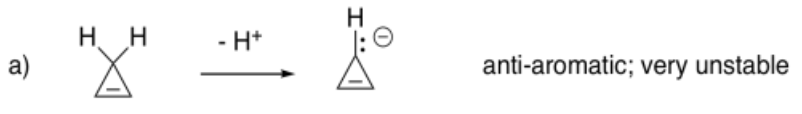
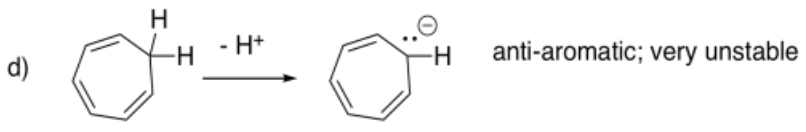
En ocasiones, los hidrocarburos pueden desprotonarse (H+ eliminado por una base muy, muy fuerte) si el anión resultante es particularmente estable. En los siguientes casos, extraer el anión que resultaría al eliminar un protón de un carbono tetraédrico, dejando atrás un par solitario. Predecir si el anión sería especialmente estable.
Contestar a-
- Respuesta b
-

- Respuesta c
-
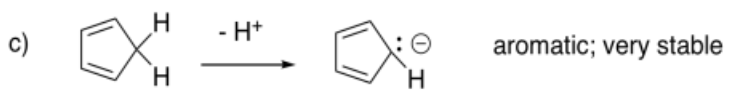
- Respuesta d
-
Ejercicio\(\PageIndex{6}\)
Utilice el método Círculo de escarcha para generar el diagrama MO orbital pi para las siguientes especies. Para E, tendrás que ser creativo en cómo aplicar la idea del círculo Frost. (¿Cuántos niveles de energía deberían haber en el diagrama?)
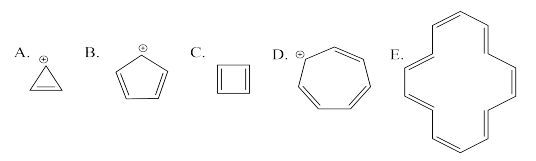
Contestar a-
- Respuesta b
-
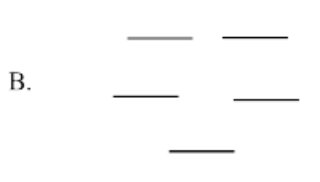
- Respuesta c
-
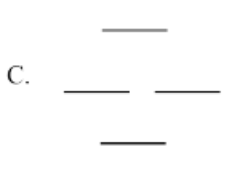
- Respuesta d
-

- Respuesta e
-
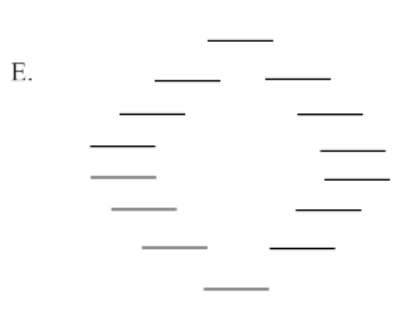
Ejercicio\(\PageIndex{7}\)
Un informe de investigación reciente examinó la influencia de los enlaces de hidrógeno en la aromaticidad. (Adaptado de Judy I. Wu, James E. Jackson, P. v. R. Schleyer, J. Am. Chem. Soc. 2014, 136, 13526-13529. Copyright 2014, Sociedad Americana de Química. Usado con permiso.)
a) Dibujar una estructura de resonancia de tropone en la que hay separación de carga (un catión y un anión).
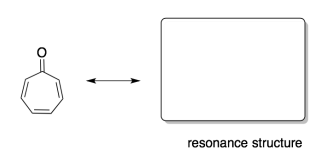
Contestar a-
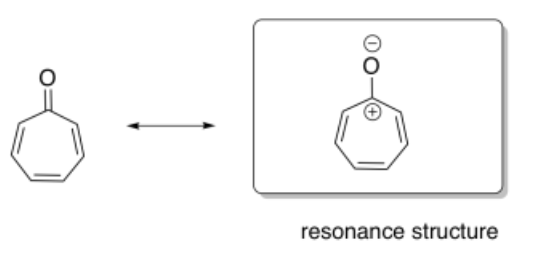
b) ¿Cuál de las dos estructuras muestra carácter aromático: la original, o la que dibujaste?
- Respuesta b
-
En tropone, la estructura de resonancia de la derecha muestra un carácter más aromático, porque muestra claramente un anillo completamente conjugado con un número impar de pares de electrones en el sistema pi. El carbonilo en la imagen de la izquierda hace que esa conjugación sea menos obvia: ¿su enlace carbonilo pi contribuye al sistema conjugado del anillo? Si lo hace, eso significaría cuatro pares de electrones en el sistema pi, y ese sería un número par, por lo que sería antiaromático.
c) Se encontró que la hidroxitropolona tenía más carácter aromático que la tropone. Dibujar una estructura de resonancia para ayudar a explicar por qué.
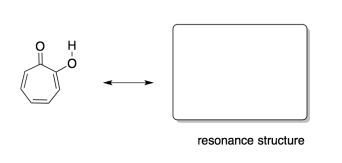
Respuesta c-
 El grupo hidroxi en la hidroxitropolona estabilizaría el compuesto en la estructura mostrada a la derecha, a través de una interacción ión-dipolo con el oxígeno aniónico. Eso hace que la estructura de la mano derecha, explícitamente aromática, sea la dominante.
El grupo hidroxi en la hidroxitropolona estabilizaría el compuesto en la estructura mostrada a la derecha, a través de una interacción ión-dipolo con el oxígeno aniónico. Eso hace que la estructura de la mano derecha, explícitamente aromática, sea la dominante.

