13.15: Polienos
- Page ID
- 80533
La unión en ozono se puede explicar con conjugación. En conjugación, varios orbitales p pueden interactuar entre sí para crear un enlace pi deslocalizado.
La conjugación también puede ocurrir en alquenos u olefinas poliinsaturados. Los alquenos son compuestos que contienen dobles enlaces carbono-carbono. Un doble enlace carbono-carbono a veces se describe como insaturado. Este término distingue a los alquenos de los alcanos o parafinas, que solo tienen enlaces simples carbono-carbono. Los alcanos se pueden hacer a partir de alquenos mediante la adición de gas hidrógeno en presencia de un catalizador de metal de transición. Mientras que los alquenos insaturados pueden absorber hidrógenos adicionales para agregarlos a los carbonos de doble enlace, los alcanos ya están llenos: están saturados de hidrógeno y no pueden aceptar más.
La conversión de cadenas carbonadas insaturadas en cadenas saturadas es muy común. Un ejemplo familiar se refiere a las grasas y aceites de cocina. Muchos aceites vegetales contienen ácidos grasos insaturados, que contienen cadenas largas de átomos de carbono que tienen al menos un doble enlace carbono-carbono. Estos dobles enlaces producen una torcedura en la cadena de carbono, haciendo que estos compuestos sean aceites a temperatura ambiente. Cuando se racionaron los productos lácteos durante la Segunda Guerra Mundial, los aceites vegetales se convirtieron en grasas saturadas mediante hidrogenación catalítica. Las grasas saturadas tienen una forma de zig-zag que se repite regularmente en sus cadenas de carbono y son sólidas a temperatura ambiente. El producto de esta conversión se denominó oleo, o más tarde, margarina. La margarina sigue siendo un sustituto común de la mantequilla hoy en día.
Ejercicio\(\PageIndex{1}\)
¿Por qué un pliegue en la cadena de carbono hace que un compuesto sea un aceite (líquido), cuando de otra manera sería una grasa (sólida) o cera?
- Contestar
-

- Los alquenos poliinsaturados, o polienos, son compuestos que tienen varios dobles enlaces carbono-carbono.
- Los dobles enlaces se pueden separar a lo largo de la cadena de carbono, con varios enlaces simples carbono-carbono que los separan. En este caso se les llama polienos aislados.
- Se podrían unir dos dobles enlaces al mismo carbono, de manera que hay dos dobles enlaces seguidos, pero esta situación es rara. Este compuesto se llamaría cumuleno.
- Dos dobles enlaces podrían estar separados por un enlace sencillo. Alternativamente, una serie de dobles enlaces podrían estar separados por enlaces simples, de modo que una cadena de carbono tuviera enlaces dobles y simples alternantes. Este compuesto es un polieno conjugado.
Los polienos conjugados tienen algunas propiedades inusuales.
- En primer lugar, son un poco más difíciles de hidrogenar que otros polienos. Sus dobles enlaces de alguna manera se resisten a tomar hidrógeno.
- En segundo lugar, estos compuestos tienen “altas barreras rotacionales” alrededor de sus enlaces simples carbono-carbono.
Normalmente, los enlaces simples entre átomos no son difíciles de rotar, y los átomos en un extremo de un enlace pueden girar con respecto al otro extremo. Los dobles enlaces, por otro lado, no rotan fácilmente, debido a que los orbitales p que forman el enlace pi necesitan permanecer paralelos entre sí para unirse. Los enlaces simples en los polienos conjugados no giran libremente; se comportan un poco más como dobles enlaces.
- Finalmente, los polienos conjugados muestran un pronunciado “desplazamiento al rojo” en sus espectros ultravioleta-visibles.
Cuando los alquenos absorben la luz ultravioleta, se promueve un electrón a un nivel de energía más alto. En alquenos, una de las transiciones electrónicas que pueden ocurrir implica la promoción de un electrón de un nivel p a un p *. La frecuencia necesaria para inducir esta transición electrónica suele estar en el rango ultravioleta. Sin embargo, al aumentar el número de dobles enlaces conjugados se mueve esta transición a una frecuencia cada vez más baja, como se muestra en la siguiente tabla. Algunas moléculas, como el caroteno, tienen muchos dobles enlaces conjugados y absroban la luz visible. El caroteno absorbe la luz azul y verde, reflejando rojo y naranja. Es uno de los pigmentos responsables del color naranja y rojo de las hojas en el otoño.
|
Compuesto |
Longitud de onda de absorción (nm) |
|
CH 2 =CH 2 |
180 |
|
CH 2 =CH-CH=CH 2 |
210 |
|
CH 2 =CH-CH=CH-CH=CH 2 |
240 |
Todas estas propiedades de los polienos se pueden explicar mediante cálculos orbitales moleculares cuantitativos. También podemos hacernos una idea de dónde provienen algunos de los resultados tomando un enfoque de MO cualitativo muy aproximado.
Comience con la primera entrada en la tabla anterior.
- El eteno, CH 2 =CH 2, contiene dos carbonos trigonales.
- Como aproximación, diremos que estos dos carbonos planos utilizan cada uno un conjunto de orbitales sp 2 para unirse a los hidrógenos y entre sí.
- Eso deja un orbital p sobrante en cada carbono para formar un enlace pi.
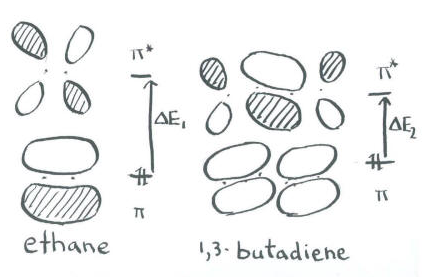
No vamos a molestarnos en dibujar un diagrama de nivel de energía orbital molecular completo para eteno. Solo dibujaremos un diagrama de Huckel, que muestra solo la porción de la molécula involucrada en la unión pi.
- En el diagrama de Huckel, hay una combinación de unión y una combinación antiadhesión.
- A falta de un cálculo completo, adivinaremos a partir de la estructura de Lewis y diremos que hay un par de electrones para poblar este conjunto de orbitales.
- Entrarán en el orbital inferior, uniéndose.
- Estos electrones están deslocalizados en dos carbonos, con media longitud de onda que se extiende sobre ambos carbonos. Una longitud de onda completa se extendería a cuatro carbonos de largo.
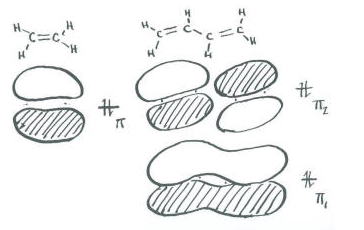
A modo de comparación, podemos ver la siguiente entrada en la tabla. Es butadieno, CH 2 =CH-CH=CH 2.
- Como aproximación, diremos que estos cuatro carbonos planos utilizan cada uno un conjunto de orbitales sp 2 para unirse a los hidrógenos y entre sí.
- Eso deja un orbital p sobrante en cada carbono para formar un enlace pi.
- En el diagrama de Huckel, hay una combinación de unión total (todo en fase con sus vecinos) y una combinación completamente antiadhesión (todo desfasado con sus vecinos, con tres nodos).
Debe haber otras dos combinaciones, porque empezamos con cuatro orbitales p.
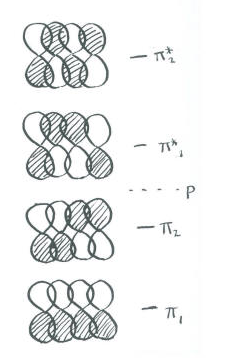
- Los dos pares de orbitales en cada extremo podrían estar en fase, pero fuera de fase en el medio. Esta combinación contiene un nodo.
- Lo contrario podría ser cierto: Los dos en el medio podrían estar en fase, pero fuera de fase con ambos extremos. Esta combinación final contiene dos nodos.
Observe que el número de nodos aumenta uno por uno, desde la combinación de todos los enlaces hasta el todo-antibonding.
- Adivinaremos por la estructura de Lewis y diremos que hay dos pares de electrones para poblar este conjunto de orbitales.
- Entrarán en los dos orbitales inferiores.
- Los electrones de menor energía se deslocalizan en cuatro carbonos. Una longitud de onda completa se extendería a ocho carbonos de largo.
Este par de electrones de baja energía debe ser al menos parcialmente responsable de la estabilidad de los polienos. Estos electrones son mucho más bajos en energía de lo que serían en dos dobles enlaces separados, lo que sería similar en energía a los dobles enlaces en eteno.
Además, este orbital explica la dificultad de rotar alrededor de los enlaces simples en butadieno. En cierto sentido, no hay enlaces simples en butadieno. Sólo hay dobles enlaces.
Los resultados de la espectroscopia requieren mayor atención a las sutilezas. Tenga en cuenta que el siguiente par de electrones entra en un orbital que contiene un nodo. En un cálculo cuantitativo de MO, la presencia de esta interacción antiunión en un orbital que de otro modo se uniría eleva su energía ligeramente por encima de la energía del enlace pi en el eteno. Además, el orbital vacío más bajo tiene una interacción de unión, disminuyendo su energía ligeramente por debajo de la orbital puramente antiadhesión en eteno. La brecha de energía entre los niveles de p a p * es ligeramente menor en butadieno, requiriendo un fotón de menor energía para promover un electrón.
Ejercicio\(\PageIndex{2}\)
Problema MO15.2.
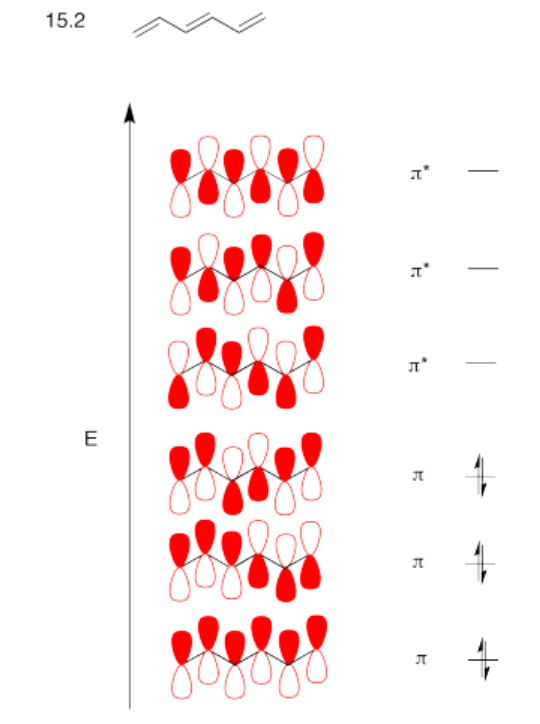
Construir un diagrama MO de Huckel para 1,3,5-hexatrieno, CH 2 =CH-CH=CH-CH=CH 2.
- Contestar
-
Ejercicio\(\PageIndex{3}\)
Problema MO15.3.
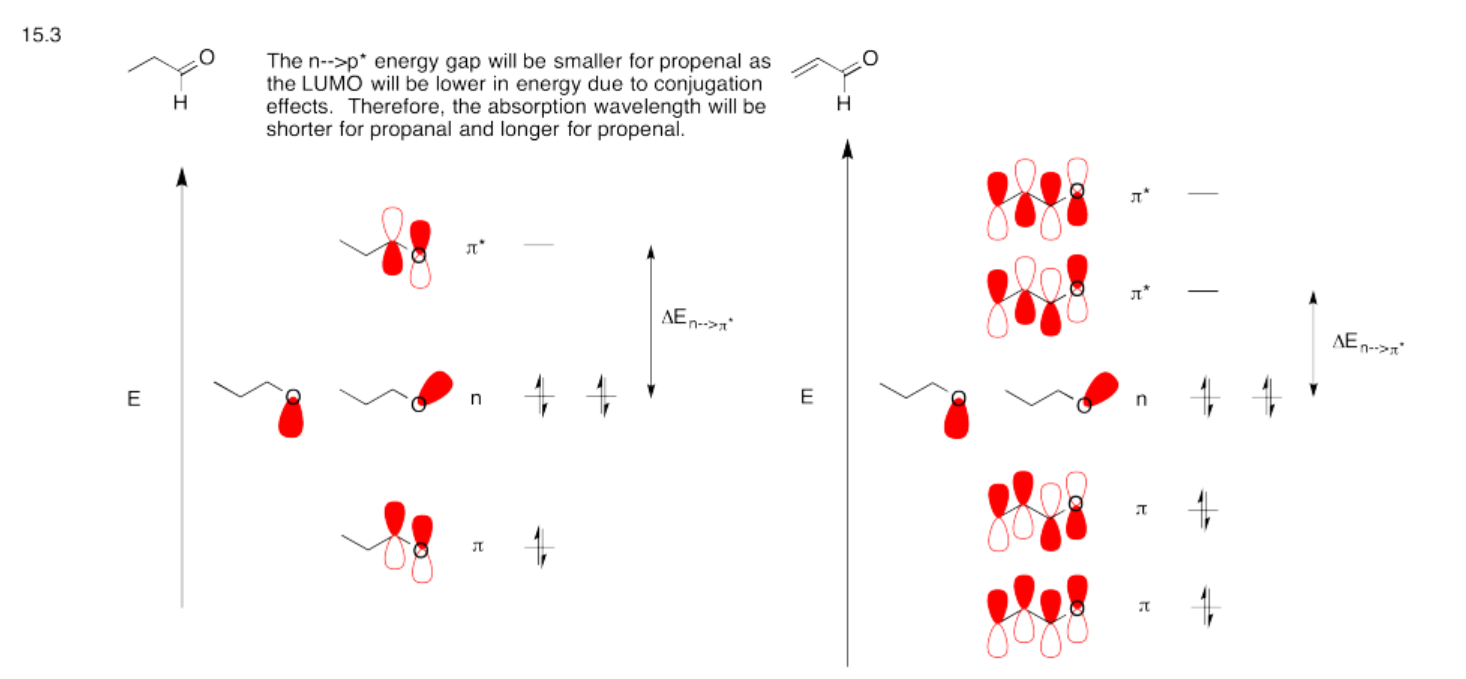
Otra posible absorción UV-visible conduce a una transición de n a p * en compuestos que contienen oxígeno; la n se refiere a un electrón no enlazante en un par solitario sobre oxígeno. Construir diagramas MO de Huckel para CH 3 -CH 2 -CHO (el último C está unido a un H y también a un oxígeno, así como al siguiente carbono) y CH 2 =CH-CHO. Incluya los niveles de energía no ligante de oxígeno en sus diagramas. Compare las brechas de energía n a p * en estos dos compuestos. ¿Cómo esperas que se comparen sus longitudes de onda de absorción?
- Contestar
-
Los polienos, y otros compuestos en los que se conjugan los orbitales, forman patrones de MO de Huckel muy predecibles. Si no hay conjugación, entonces solo tenemos un orbital, todo por sí mismo. Si se conjugan dos orbitales, entonces hay dos combinaciones.

Ejercicio\(\PageIndex{4}\)
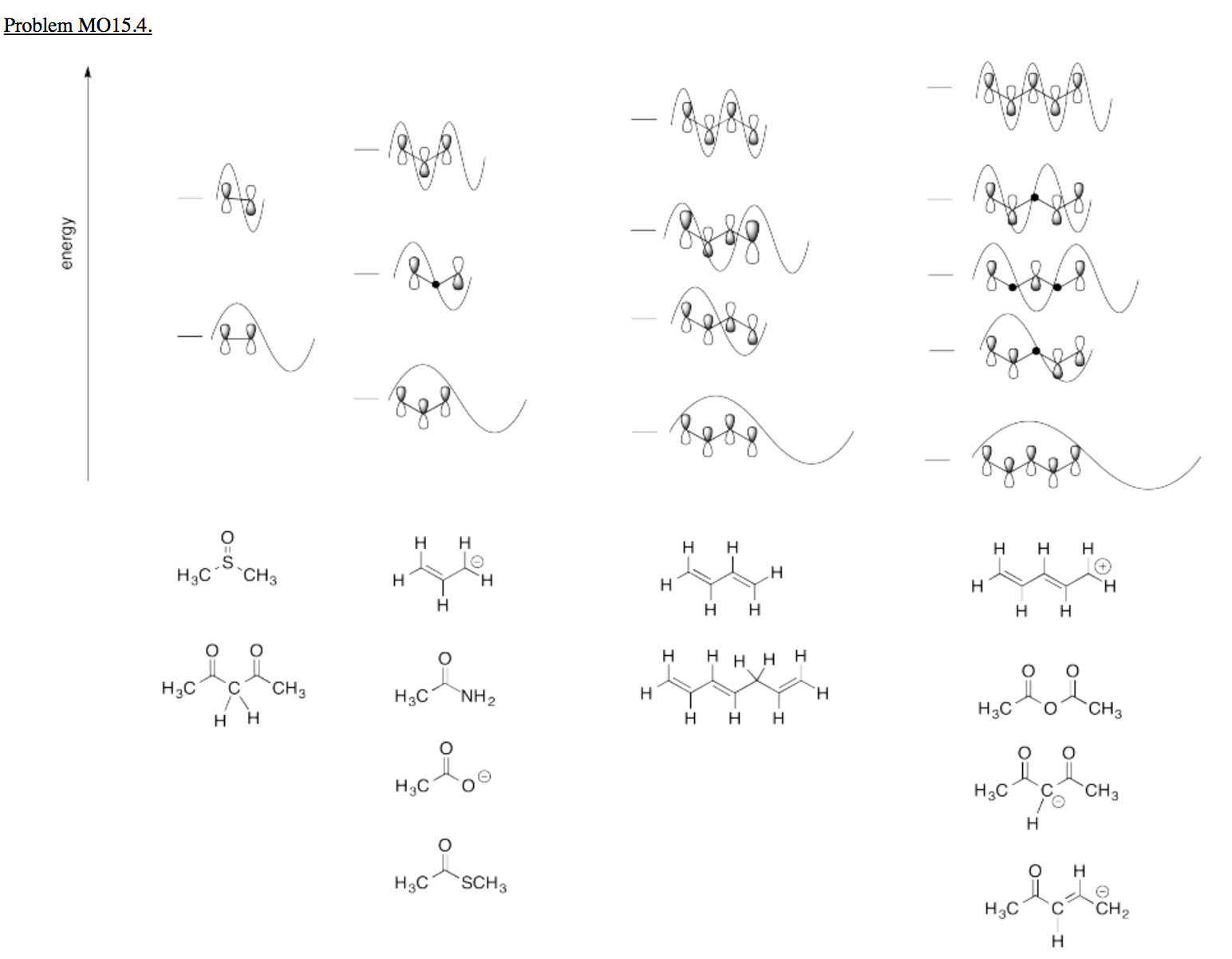
Problema MO15.4.
Haga coincidir cada una de las estructuras a continuación con el diagrama MO de Huckel correcto.
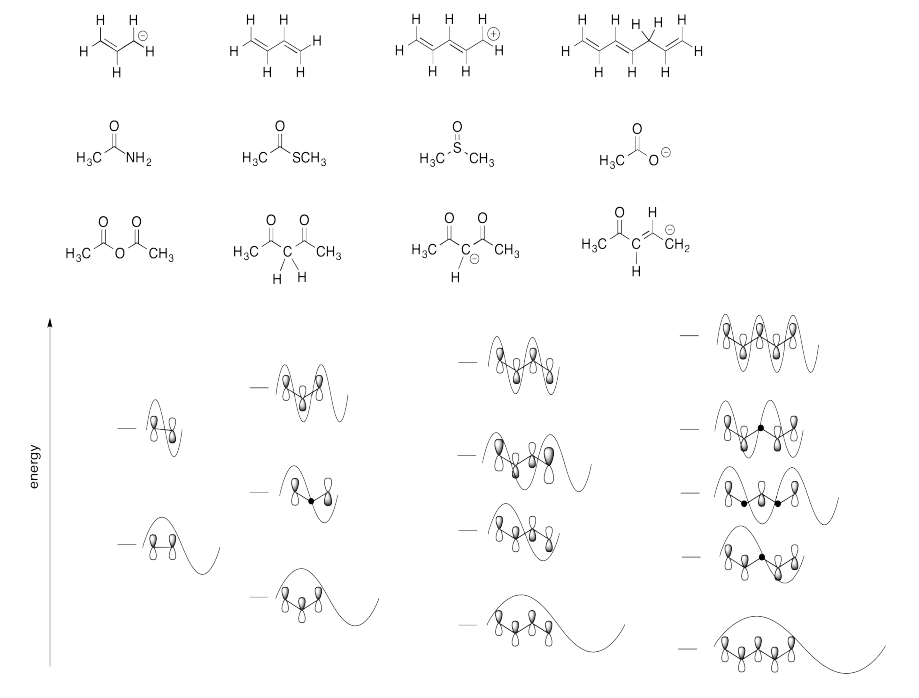
Contestar-