13.19: Soluciones a problemas seleccionados
- Page ID
- 80432
Ejercicio 13.2.1:
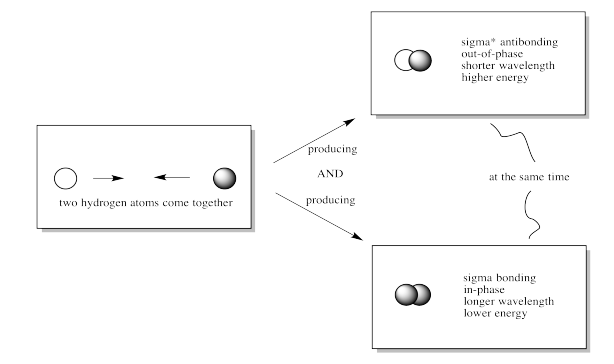
Cuando los orbitales de dos s se combinan fuera de fase, se produce una intereferencia destructiva.
Hay un nodo entre los átomos.
La energía de los electrones aumenta.
Cuando los orbitales de dos s se combinan en fase, se produce interferencia constructiva.
No hay ningún nodo entre los átomos; los electrones se encuentran entre los átomos.
La energía de los electrones disminuye.
Ejercicio 13.3.1:
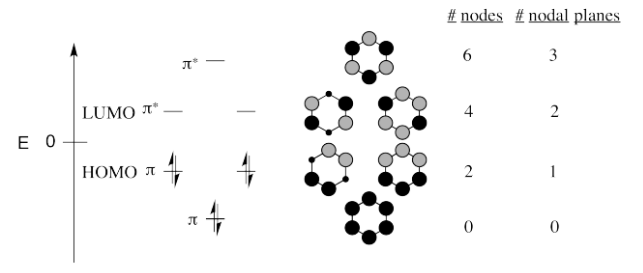
Ejercicio 13.4.1:
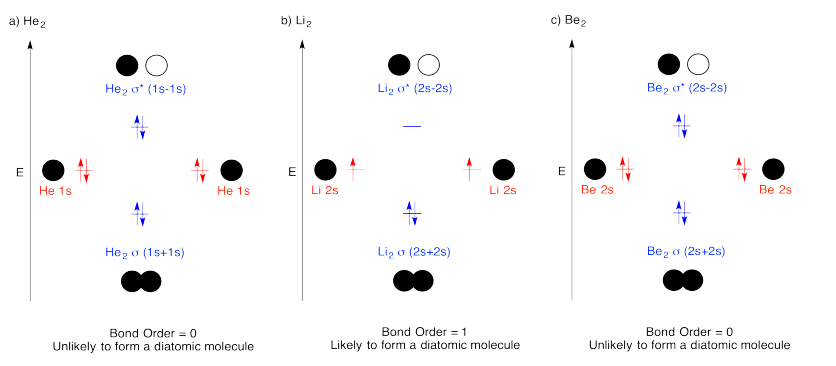
Ejercicio 13.4.2:
Ejercicio 13.5.1:
Cuando se combinan 2 orbitales atómicos, se forman 2 orbitales moleculares: uno orbital de enlace en fase y otro orbital antienlace fuera de fase.
Ejercicio 13.5.2:
Las combinaciones en fase de orbitales atómicos dan orbitales de unión.
Ejercicio 13.5.3:
Las combinaciones fuera de fase de orbitales atómicos dan orbitales antiadhesión.
Ejercicio 13.5.4:
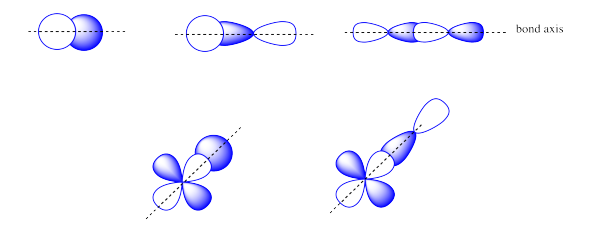
Las combinaciones de s + s OR s + p OR p + p OR s + d OR p + d orbitales atómicos pueden conducir a orbitales σ.
Ejercicio 3.5.5:
Las combinaciones de orbitales atómicos lado a lado p + p o p + d conducen a orbitales π.
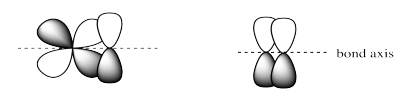
e) σ*
Ejercicio 13.5.7:
Li + y O 2- son más similares en tamaño que K + y O 2-, por lo que el enlace entre Li + y O 2- es más fuerte.
La diferencia de energía entre los orbitales 1s y los orbitales 2s es demasiado grande, por lo que no pueden interactuar. Para que los orbitales interactúen, los orbitales necesitan tener la misma simetría, estar en el mismo plano, y ser similares en energía.
Ejercicio 13.5.8:
Cuando dos orbitales p paralelos se combinan fuera de fase, se produce una intereferencia destructiva.
Hay un nodo entre los átomos.
La energía de los electrones aumenta.
Cuando dos orbitales p paralelos se combinan en fase, se produce interferencia constructiva.
No hay ningún nodo entre los átomos; los electrones se encuentran por encima y por debajo del eje que conecta los átomos.
La energía de los electrones disminuye.
Ejercicio 13.6.1:
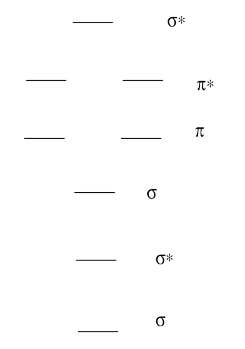
Ejercicio 13.6.2:
• Contar los electrones de valencia en la molécula. Ese es el número de electrones de valencia en cada átomo, ajustados para cualquier carga en la molécula. (por ejemplo, C 2 2- tiene 10 electrones de valencia: 4 de cada carbono —es decir 8— y dos más para la carga 2-).
• Llene primero los electrones en los orbitales de menor energía.
• Los electrones pares después de todos los orbitales al mismo nivel de energía tienen un electrón.
Ejercicio 13.6.3:
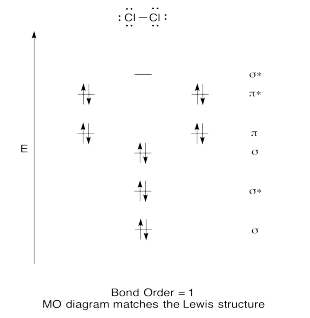
Ejercicio 13.6.4:

Ejercicio 13.6.5:
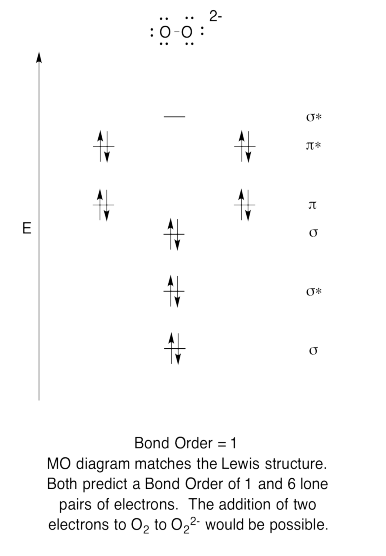
Ejercicio 13.6.6:
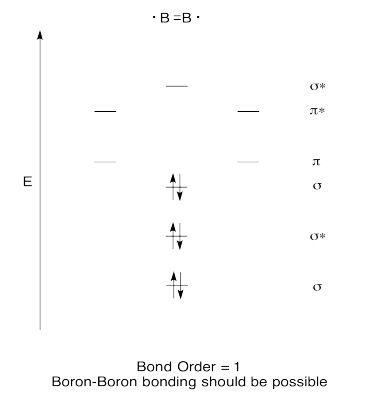
Ejercicio 13.6.7:
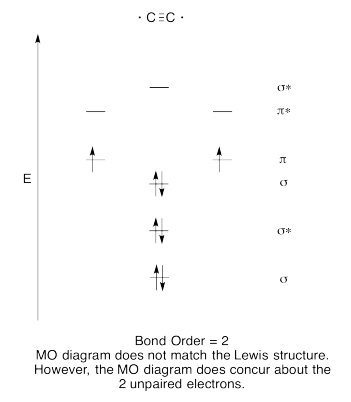
Ejercicio 13.6.8:
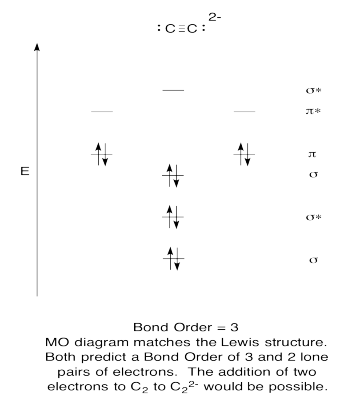
Ejercicio 13.6.9:
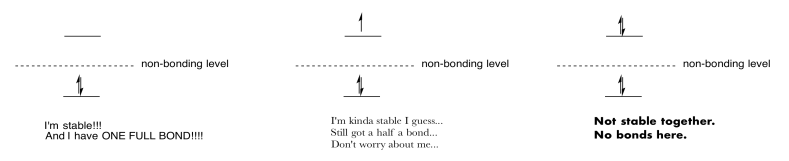
Ejercicio 13.6.10
- Na, porque Na tiene un menor potencial de ionización (y una electronegatividad menor) que Al.
- Al
- 4-, porque hay cuatro Na +
- total e - = 2 x 3 e - (por Al) + 4 e - (para la carga negativa) = 10 e-
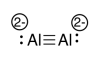
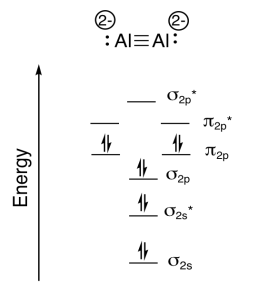
g)\(\textrm{bond order} = \frac{\textrm{# bonding e- - # antibonding e-}}{2} = \frac{8-2}{2}=3\)
Ejercicio 13.7.1:
De MO6:3. Diamagnético (sin electrones desapareados); 4. Paramagnético; 5. Diamagnético; 6. Diamagnético; 7. Paramagnético; 8. Diamagnético
Ejercicio 13.7.2:
a. N 2 +. De los diagramas MO, N 2 + tiene un electrón de enlace menos. Así, el orden de fianza será menor y el bono será más largo que en N 2.
b. N 2 -. De los diagramas MO, N 2 - tiene un electrón más antienlace. Por lo tanto, el orden de la fianza será menor y el bono será mayor que N 2.
Ejercicio 13.7.3:
a. O 2 +. Del diagrama MO, O 2 + tiene un electrón menos antienlace. Así el orden de bonos será mayor y el vínculo será más fuerte que en O 2.
b. o 2. Del diagrama MO, O 2 tiene un electrón menos antienlace. De esta manera el orden de fianza será mayor y el vínculo será más fuerte que en O 2 -.
Ejercicio 13.9.1:
a)
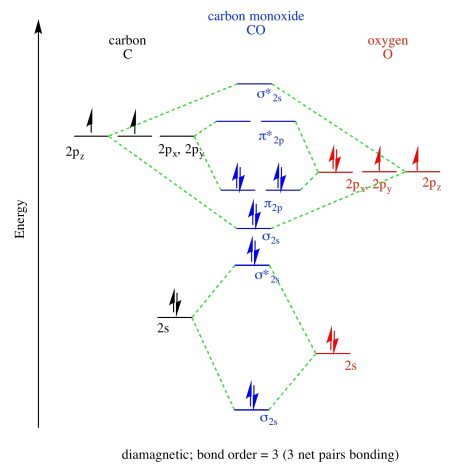
b)
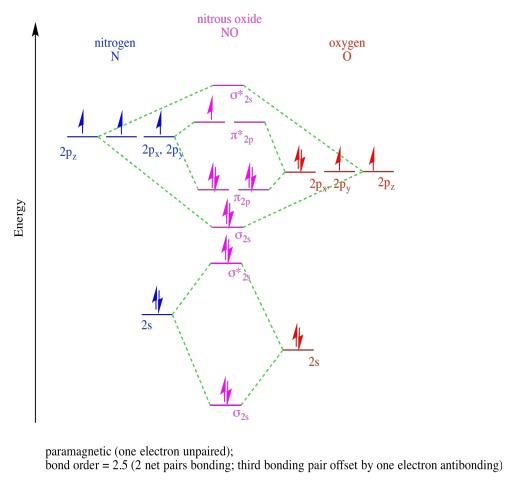
c)
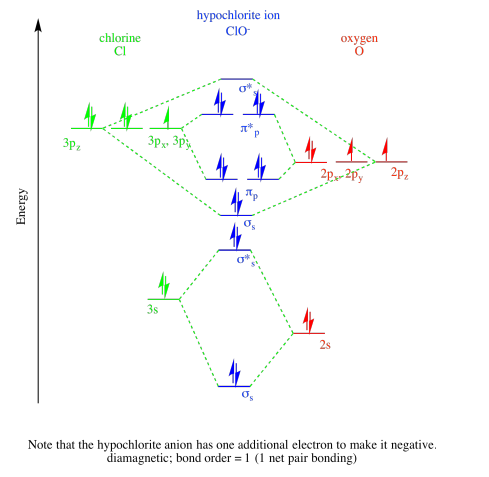
Ejercicio 13.11.1:
a)
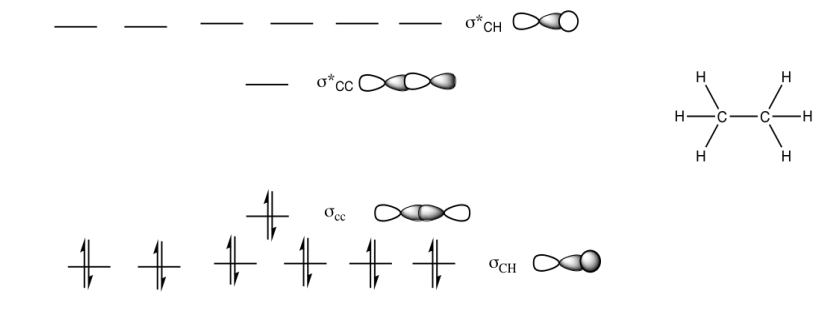
b)
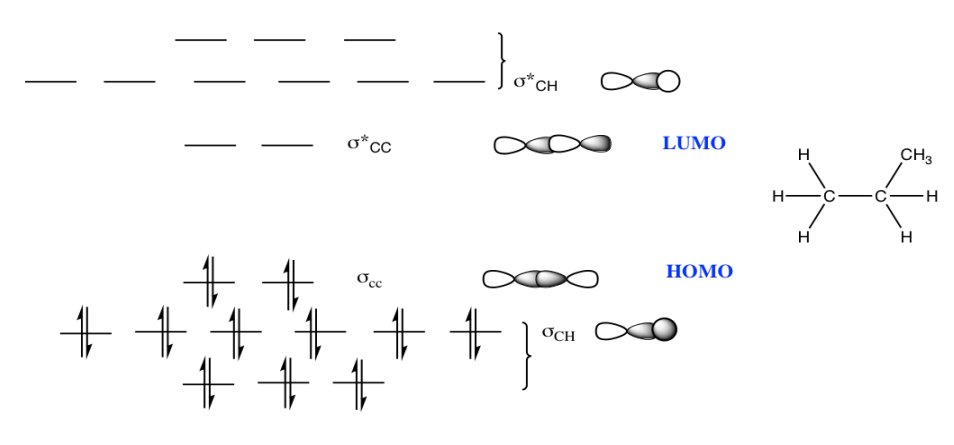
c)
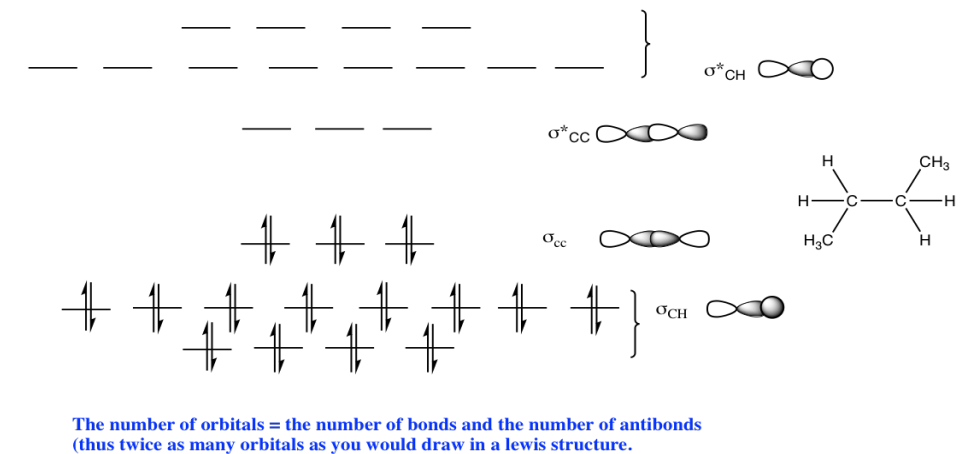
Ejercicio 13.11.2:
a)

b)
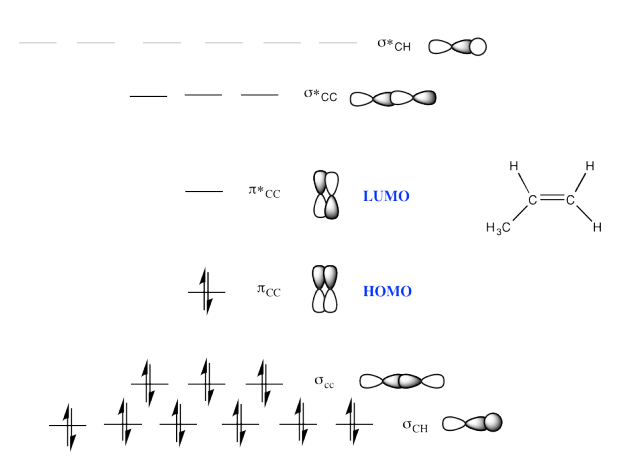
c)
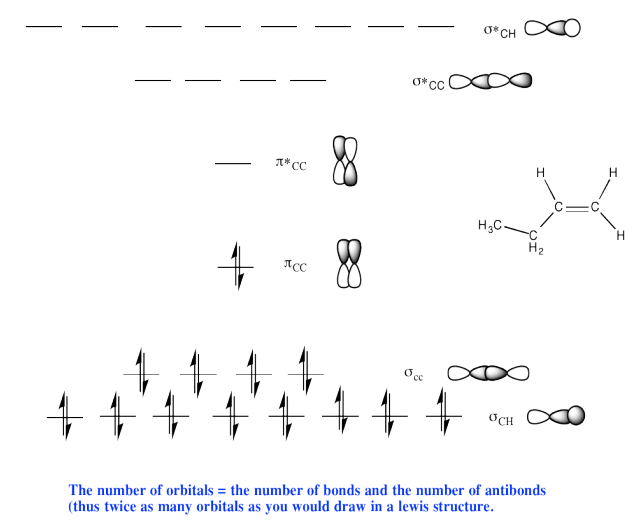
d)
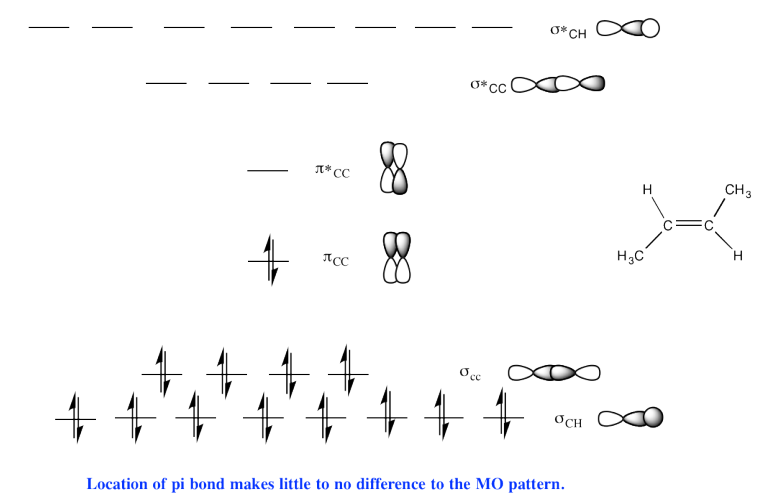
e)
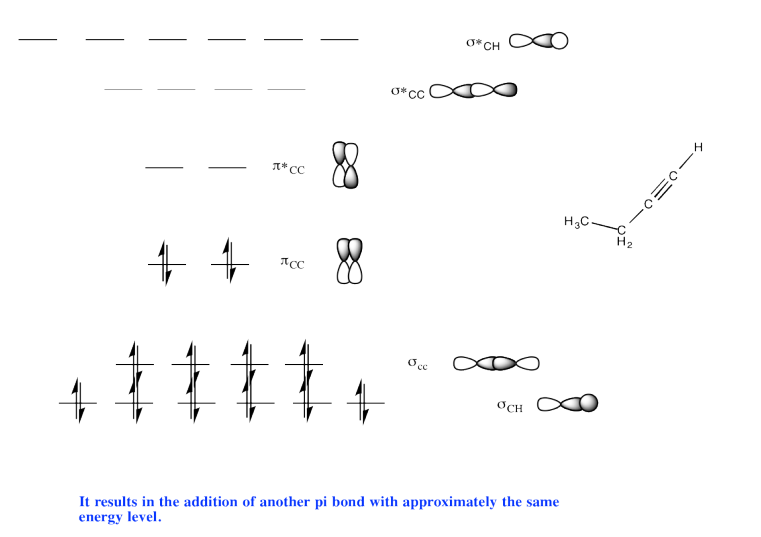
Ejercicio 13.11.3:
a)
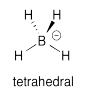
b)

c)
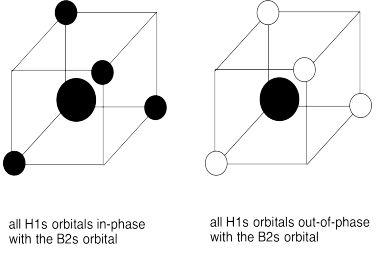
d)
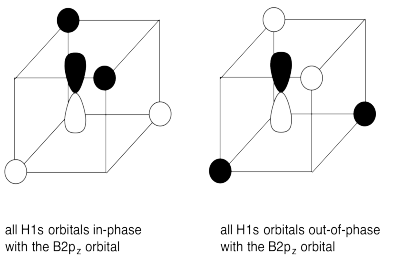
e)
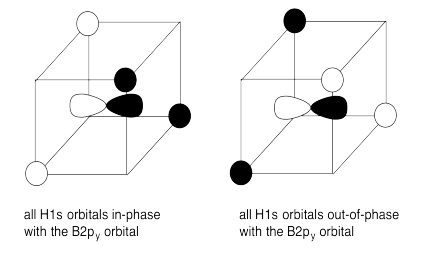
f)
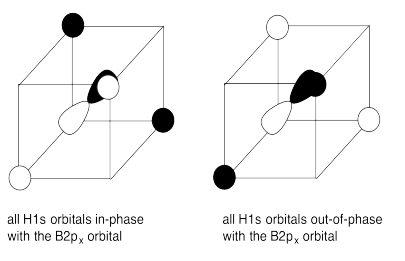
g) En cada caso, los cuatro orbitales H1s interactúan con cada orbital de boro.
h) El solapamiento constructivo de los cuatro orbitales H1s y los orbitales B2s da como resultado la combinación de energía más baja ya que no contiene nodos. (ENERGÍA MÁS BAJA)
La superposición constructiva de los cuatro orbitales H1s con los tres orbitales B2p da como resultado orbitales de unión que contienen un solo nodo. (ENERGÍA MEDIA-BAJA)
El solapamiento destructivo de los cuatro orbitales H1s con los orbitales B2s da como resultado un orbital antienlace. (ALTA ENERGÍA)
La superposición destructiva de los cuatro orbitales H1s con los tres orbitales B2p da como resultado orbitales antiunión. (ENERGÍA MÁS ALTA)
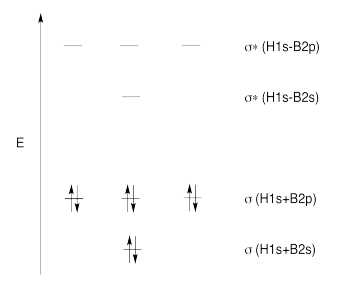
Ejercicio 13.11.4:
a)
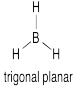
b)

c)
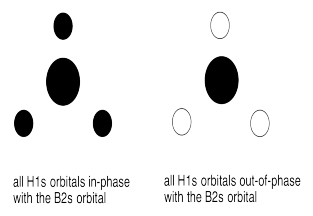
d)
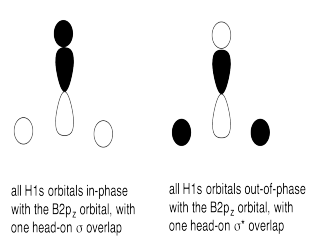
e)
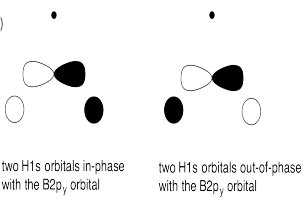
f)
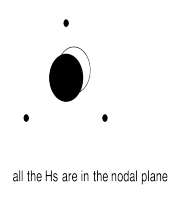
g) En algunos de los casos la una o más Hs pueden estar en un plano nodal
h) El solapamiento constructivo de los orbitales H1s y los orbitales B2s da como resultado la combinación de energía más baja. (ENERGÍA MÁS BAJA)
El solapamiento constructivo de los tres orbitales H1s con el orbital B2p da como resultado un orbital de unión (MEDIO-BAJO ENERGÍA)
El solapamiento constructivo de los dos orbitales H1s con el orbital B2p resulta en un orbital de unión. (ENERGÍA MEDIA-BAJA)
El orbital B2p que es perpendicular al plano de los átomos de hidrógeno da como resultado un orbital no enlazante. (ENERGÍA MEDIA)
El solapamiento destructivo de los dos orbitales H1s con el orbital B2p da como resultado un orbital antienlace (ALTA ENERGÍA)
El solapamiento destructivo de los tres orbitales H1s con el orbital B2p da como resultado un orbital antienlace (ALTA ENERGÍA)
El solapamiento destructivo de los tres orbitales H1s con el orbital B2p da como resultado un orbital antienlace (ALTA ENERGÍA)
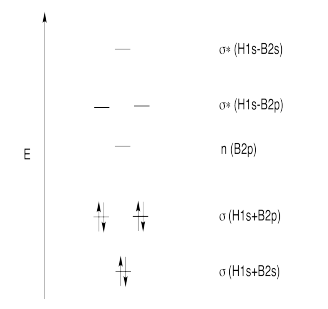
Ejercicios 13.12.1 y 13.12.2:

Ejercicio 13.12.3:
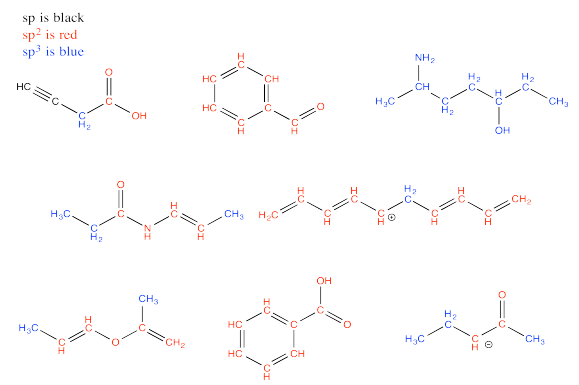
Ejercicios 13.13.1-13.13.3:
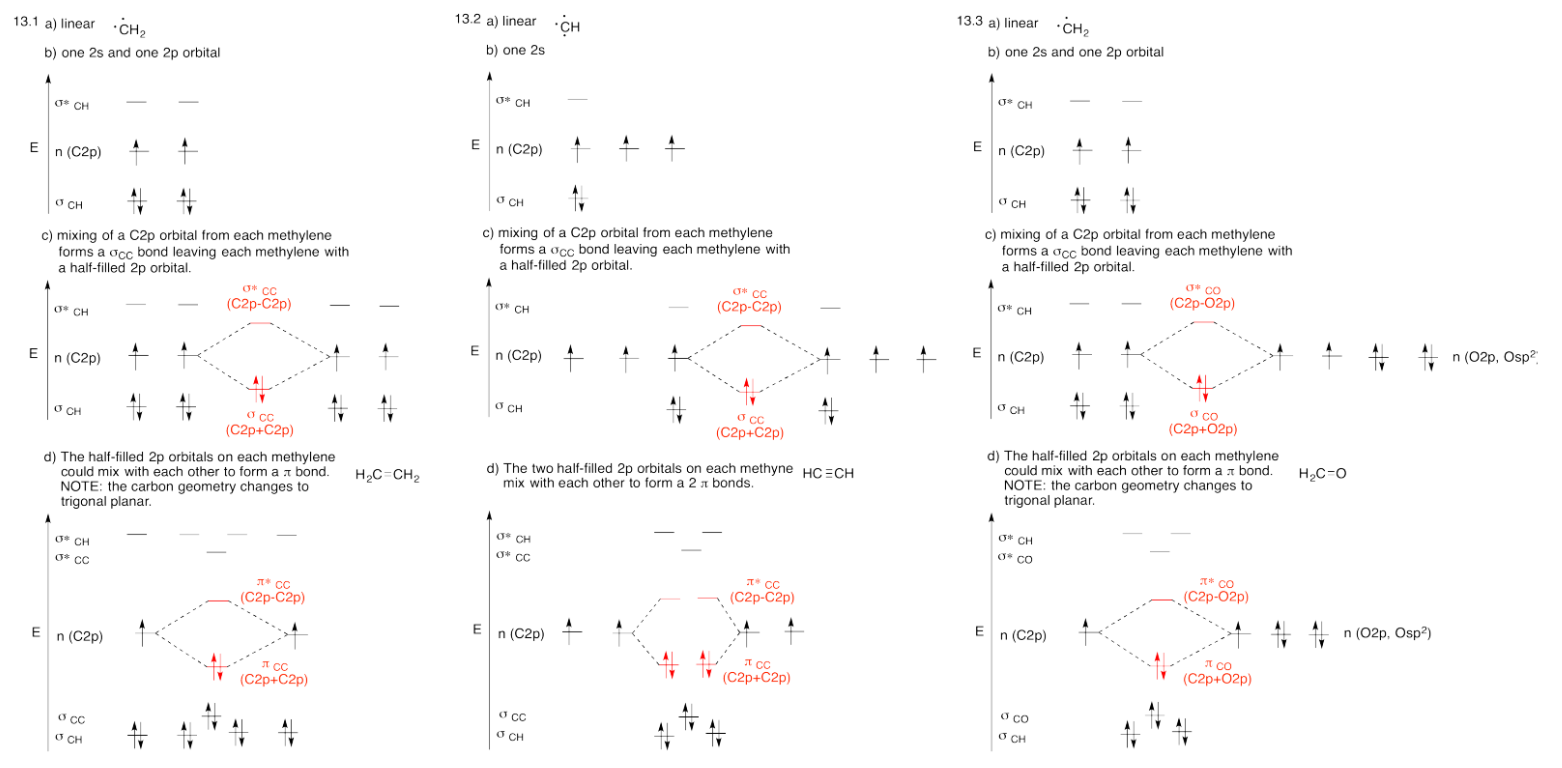
Ejercicios 13.14.1-13.14.5:
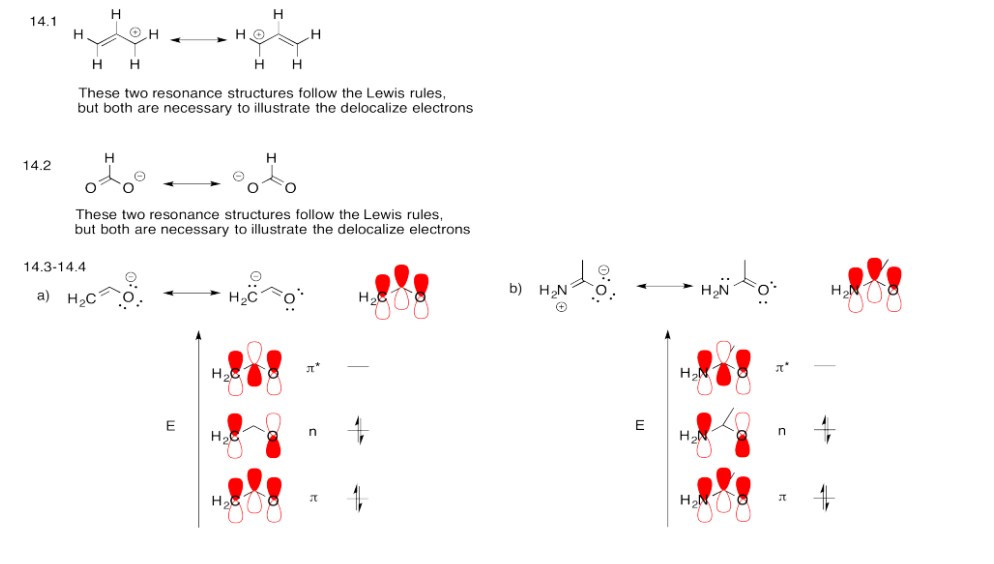
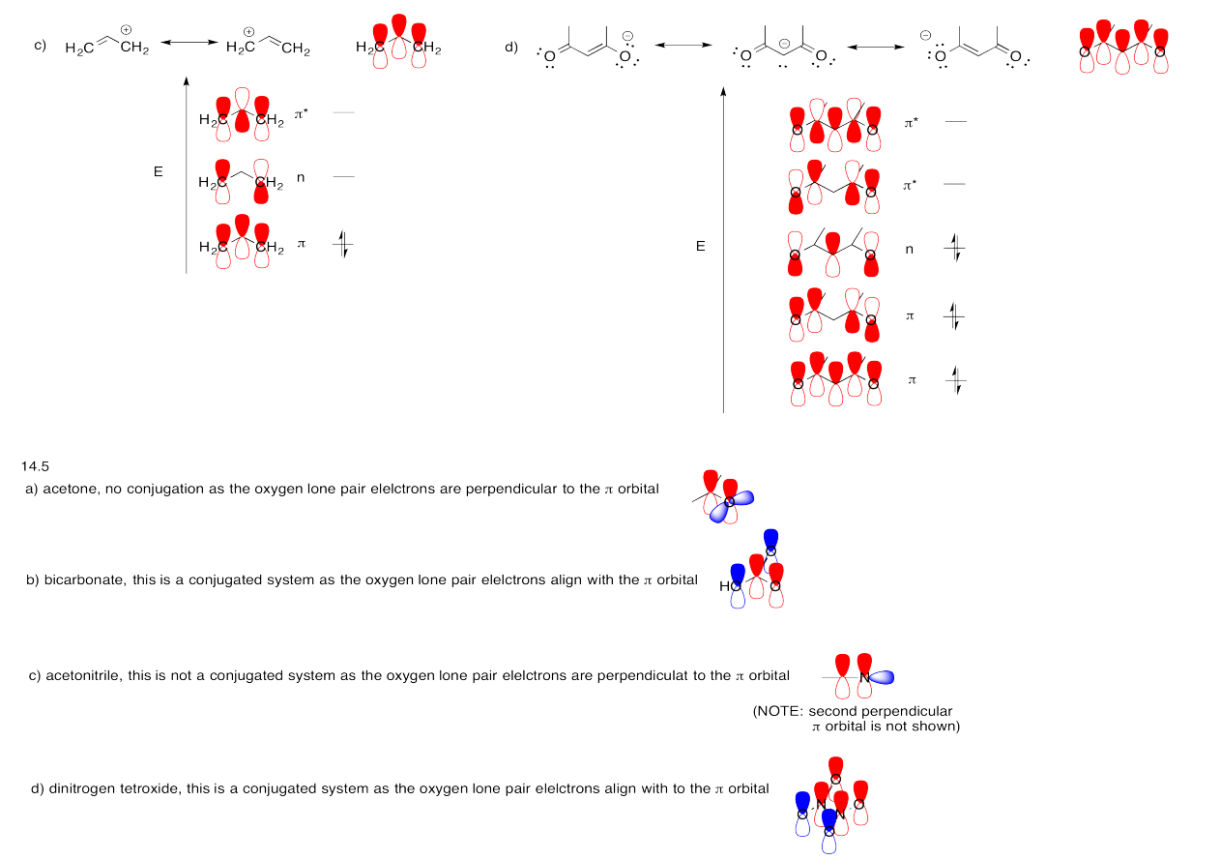
Ejercicio 13.14.6:
Todas las respuestas dependen de una comprensión de las contribuciones de dos estructuras de resonancia al panorama general de la acetamina, o alternativamente, que la actetamida forma un sistema pi conjugado con cuatro electrones deslocalizados sobre el O, C y N.
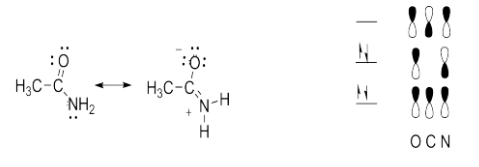
a. La contribución de la segunda estructura de resonancia introduce algún carácter de doble enlace al enlace C-N y algún carácter de enlace sencillo al enlace C-O. Así, ambos enlaces son de longitud intermedia entre enlaces simples y dobles.
b. Dado que los átomos C, N y O están hibridados sp2, el enlace pi C-N solo puede formarse si los orbitales p restantes en estos átomos se alinean. Esto coloca a los átomos que participan en los enlaces sigma sp2 en el mismo plano.
c. Debido al carácter de doble enlace parcial, existe una barrera de rotación mayor que la que se encuentra típicamente en las moléculas con solo enlaces simples.
d. Debido al carácter de doble enlace parcial y la rotación restringida, las dos H no son idénticas. (Uno está más cerca del O y uno está más cerca del CH3 y la rotación restringida impide su interconversión.
Ejercicios 13.15.1-13.15.3:

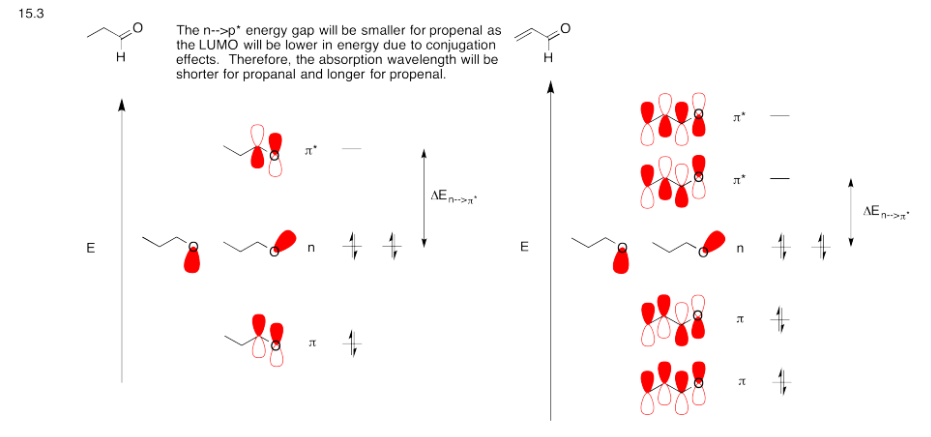
Ejercicio 13.15.4:

Ejercicio 13.16.1:
Debido a que las dos estructuras de resonancia muestran dobles enlaces en dos lugares diferentes, la implicación es que todos los enlaces en benceno tienen algún doble enlace y algún carácter de enlace simple. Se puede pensar en todos ellos como unos 1.5 bonos.
Ejercicio 13.16.2:
a) no aromático b) no aromático c) aromático d) aromático e) anti-aromático f) anti-aromático
Ejercicio 13.16.3:
a) aromático b) no aromático c) anti-aromático d) aromático
Ejercicio 13.16.4:
a) aromático b) anti-aromático c) aromático d) anti-aromático
Ejercicio 13.16.5:
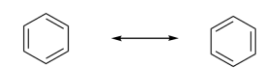
Ejercicio 13.16.6:
Ejercicio 13.16.7:
En tropone, la estructura de resonancia de la derecha muestra un carácter más aromático, porque muestra claramente un anillo completamente conjugado con un número impar de pares de electrones en el sistema pi. El carbonilo en la imagen de la izquierda hace que esa conjugación sea menos obvia: ¿su enlace carbonilo pi contribuye al sistema conjugado del anillo? Si lo hace, eso significaría cuatro pares de electrones en el sistema pi, y ese sería un número par, por lo que sería antiaromático.
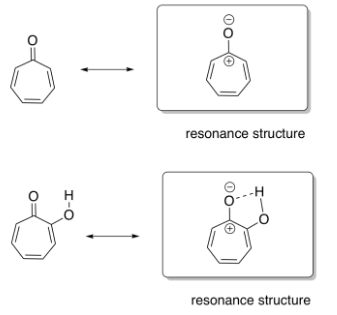
El grupo hidroxi en la hidroxitropolona estabilizaría el compuesto en la estructura mostrada a la derecha, a través de una interacción ión-dipolo con el oxígeno aniónico. Eso hace que la estructura de la mano derecha, explícitamente aromática, sea la dominante.
Ejercicio 13.17.1:
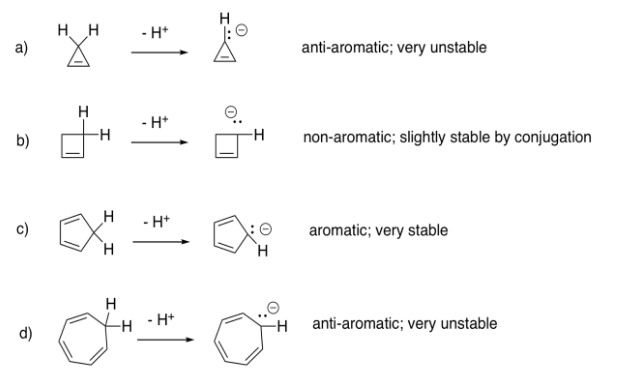
Todos los compuestos son aromáticos y tienen el mismo diagrama Hückel MO.
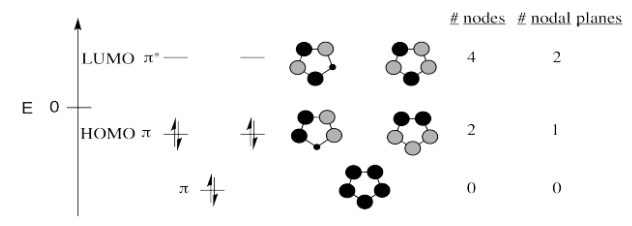
Ejercicio 13.17.2:
Todos los compuestos son aromáticos y tienen el mismo diagrama Hückel MO.