14.1: Acidez general y basicidad
- Page ID
- 80589
Los cambios físicos resultan en la transición de un material molecular de una forma a otra sin ningún cambio en la composición del material. Un compuesto líquido se puede enfriar hasta que se congela o se calienta hasta que se evapore, pero los átomos que componen el material siguen conectados entre sí de la misma manera.
Las reacciones químicas dan como resultado un cambio en la composición de un material. Los átomos se asocian de diferentes maneras. Se producen cambios en la unión. Debido a que la unión implica algún tipo de distribución compartida de electrones entre átomos, una reacción química implica algún cambio en la forma en que los electrones están dispuestos en el material.
- La forma estándar de pensar sobre una reacción química es considerar el movimiento de los electrones en la reacción.
Las reacciones a menudo implican muchos cambios, por lo que un material se transforma en otros a través de numerosas redistribuciones de electrones. Estos pasos individuales dentro de una reacción general a veces se denominan reacciones elementales. Una de las formas más comunes de analizar una reacción elemental es comprender de una manera muy básica hacia dónde se mueven los electrones y hacia dónde se mueven.

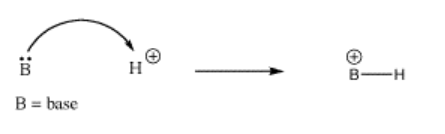
- Un átomo o molécula que suministra un par de electrones para formar un nuevo enlace es un donante de electrones. Un donante de electrones a menudo se llama base de Lewis.
- Un átomo o molécula que acepta un par de electrones para formar un nuevo enlace es un aceptor de electrones. Un aceptor de electrones a menudo se llama ácido de Lewis.
Uno de los ácidos de Lewis más comunes, o aceptores de electrones, es un protón. Es tan común que la gente suele usar el término “ácido” solo para describir compuestos o soluciones que suministran protones.
Una base de Lewis es cualquier cosa con una pareja solitaria. Por ejemplo, el agua es una base de Lewis porque el átomo de oxígeno tiene pares solitarios. Si tomamos una fuente de protones, como el cloruro de hidrógeno (HCl, un gas incoloro) y lo burbujeamos en un matraz de agua, se producirá una reacción. El agua donará electrones al protón en el HCl, produciendo ácido clorhídrico, o cloruro de hidrógeno acuoso: HCl (ac).
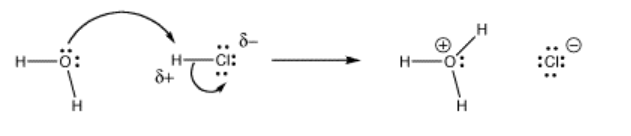
Tenga en cuenta que un átomo de hidrógeno solo puede tener un enlace, por lo que cuando el agua dona sus electrones al hidrógeno, el enlace entre el hidrógeno y el cloro tiene que romperse. Los electrones en el enlace se mueven hacia el cloro, que es más electronegativo que el hidrógeno.
También, observe que el átomo de hidrógeno ni siquiera necesitaba una carga positiva completa para atraer el agua. Una carga positiva parcial seguirá atrayendo electrones.
Los ácidos no tienen que ser protones o donantes de protones. Muy a menudo, los iones metálicos son capaces de atraer electrones, porque los iones metálicos están cargados positivamente. Ca 2+, Sc 2+, Ti 4+ son solo algunos ejemplos comunes.
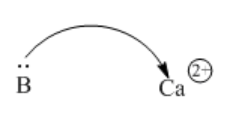
Figura\(\PageIndex{4}\): Un ion calcio puede atraer electrones de un átomo donante.
Estas ideas serán exploradas más a fondo en este capítulo. Son algunas de las ideas más importantes en química, formando la base de la mayor parte de lo que sabemos sobre las relaciones entre estructura, propiedades y reactividad.

