El enlace que se forma entre una base de Lewis y un ácido de Lewis a veces se denomina enlace dativo o enlace coordinado. El término utilizado para la donación de una base de Lewis a un ácido de Lewis, sin ningún otro cambio de vinculación, es coordinación. Otro término para los complejos ácido-base de Lewis, especialmente utilizado en el contexto de la química de metales de transición, son los complejos de coordinación. A veces la base de Lewis es referida como un ligando; más generalmente, un ligando es solo una molécula que se une a otra.
Un ejemplo de un complejo de coordinación es el dicloruro de hexaaquo cobalto, Co (H 2 O) 6 Cl 2 . Este compuesto contiene un ion Co 2+ . Este ion metálico electrofílico está coordinado por seis ligandos nucleofílicos de agua. Debido a que las moléculas de agua son neutras, el complejo todavía tiene una carga de 2+ en general. Hay dos contraiones de cloruro para equilibrar la carga, pero los cloruros no están unidos al ion complejo.
Observe que las convenciones habituales de Lewis suelen ser abandonadas en la elaboración de complejos de coordinación de metales de transición. Con tantos nucleófilos diferentes pegados al ácido de Lewis, el número de cargos formales que deben hacerse se vuelve muy engorroso. Por lo general, se denota el estado de oxidación del catión metálico. El estado de oxidación significa esencialmente la carga en el catión metálico y está escrito en números romanos junto al átomo de metal. Además, se da la carga general sobre el complejo ácido-base de Lewis, con corchetes que indican que la carga pertenece a todo el complejo dentro de los paréntesis. Exactamente donde reside ese cargo depende del lector a considerar.
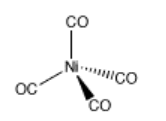
Los complejos de coordinación son frecuentemente útiles en minería y metalurgia. Por ejemplo, el níquel se puede extraer del mineral de níquel convirtiendo el níquel en Ni (CO) 4 mediante la adición de monóxido de carbono. Ni (CO) 4 , o tetracarbonilníquel, es un gas que se puede separar fácilmente del mineral sólido. Cuando se elimina de la presencia de monóxido de carbono, el complejo de coordinación se descompone de nuevo en Ni y CO.
Ejercicio\(\PageIndex{1}\)
Estas preguntas se refieren a la formación de tetracarbonilníquel.
a) En base a lo que sabes sobre los metales de transición, ¿el níquel es probablemente un ácido de Lewis o una base de Lewis?
b) Dibujar la estructura de Lewis para monóxido de carbono, CO. Asegúrate de que cada átomo tenga un octeto. Asegúrate de agregar cargos formales.
c) Con base en consideraciones formales de carga, ¿qué átomo del monóxido de carbono se unirá al níquel?
d) Usando la notación de flecha, mostrar la coordinación de CO a Ni. Haga esto un paso a la vez, mostrándose cada molécula de CO uniéndose al níquel y al nuevo complejo que resulta después de cada paso.
e) ¿Por qué el níquel se une a cuatro ligandos de monóxido de carbono, y no a tres o cinco?
Contestar a
Ácido de Lewis
Respuesta b
Respuesta c
El carbono será nucleofílico debido a los electrones del par solitario y la carga negativa.
Respuesta d
Respuesta e
Ni 0 es d 10 y con 4 ligandos de CO el complejo de níquel tetracarbonilo tiene 18 electrones.
Otro ejemplo se ve en la extracción líquida de metales a partir de minerales. A menudo, un metal es coordinado por algún tipo de ligando que cambia la solubilidad del átomo metálico, de manera que puede extraerse del mineral con un disolvente. El solvente suele ser agua, pero podrían usarse otros líquidos. Uno de los casos más fáciles de imaginar en papel es la lixiviación de oro de minerales de oro con cianuro.
A menudo, la coordinación de un ligando a un metal cambia muchas propiedades del metal, además de cambiar su solubilidad. Los metales de transición tienen diferentes estados de oxidación, lo que significa que pueden renunciar a diferentes números de electrones y convertirse en cationes con diferentes cargas. En ocasiones, este evento ocurre más fácilmente tras la coordinación. En el caso del oro, el átomo de oro puede reaccionar con el aire y convertirse en un catión de oro en presencia de cianuro.
El cianuro es un anión, por lo que se agregaría como una sal, como cianuro de sodio, NaCN, o cianuro de potasio, KCN. El complejo resultante, Au (CN) 2 , es en realidad un anión complejo, y estaría asociado con uno de los contraiones añadidos, como KAu (CN) 2 . No está del todo claro por qué el oro une dos cianuros, pero la unión de dos ligandos es común en la química del oro y la plata, y se basa en consideraciones orbitales moleculares que están más allá del nivel de este curso.
Figura\(\PageIndex{4}\) : Ión complejo de dicianida de oro, mostrado aquí con un contraión de potasio.
Esta sal compleja es soluble en agua, por lo que se puede eliminar del mineral con agua. Posteriormente, debe ser convertido de nuevo en oro puro a través de reacciones electroquímicas. Estas reacciones no están relacionadas con la química ácido-base y no serán cubiertas en este curso.
Ejercicio\(\PageIndex{2}\)
Estas preguntas se refieren a la formación del complejo de dicyano oro de potasio.
a) En base a lo que sabes sobre los metales de transición, ¿el oro es probablemente un ácido de Lewis o una base de Lewis?
b) Dibujar la estructura Lewis para cianuro, CN - . Asegúrate de que cada átomo tenga un octeto. Asegúrate de agregar cargos formales.
c) Con base en consideraciones formales de carga, ¿qué átomo en el cianuro se unirá al oro?
d) Utilizando la notación de flecha, mostrar la coordinación de cianuro a Au + . (Simplificaremos y asumiremos que el oro ya se ha oxidado). Haga esto paso a paso, mostrando cada molécula de cianuro uniéndose al ion oro y el nuevo complejo que resulta después de cada paso.
Contestar a
Ácido de Lewis
Respuesta b
Respuesta c
El carbono será nucleofílico debido a los electrones del par solitario y la carga negativa.
Respuesta d
Quizás algunos de los complejos de coordinación más interesantes involucran metales de transición en biología. El más familiar de estos compuestos es la hemoglobina. La hemoglobina es una proteína compleja que contiene un átomo de hierro crucial. El hierro está presente como un catión 2+, pero el anillo heme que se une al hierro tiene una carga 2, por lo que en general no hay carga en el complejo. El hierro sigue siendo electrófilo, sin embargo, y puede unirse a una molécula de oxígeno. Mucho más oxígeno puede transportarse en el torrente sanguíneo de esta manera que si el oxígeno simplemente se disolviera en la sangre.
Figura\(\PageIndex{5}\) : Hemoglobina. La mayor parte de la molécula no se muestra. La subunidad hemo que contiene hierro se une a una proteína grande a través de un anillo de imidazol en un residuo de aminoácido de histidina.
Ejercicio\(\PageIndex{3}\)
Estas preguntas se refieren a la formación de la oxihemoglobina.
a) En base a lo que sabes sobre los metales de transición, ¿el hierro es probablemente un ácido de Lewis o una base de Lewis?
b) Dibujar la estructura de Lewis para la molécula de oxígeno, O 2 . Asegúrate de que cada átomo tenga un octeto. Asegúrate de ver si hay algún cargo formal.
N.B. esta estructura de Lewis puede no estar completamente de acuerdo con la visión orbital molecular de la molécula, pero es todo lo que tenemos que trabajar para nuestro método actual de comprensión de la coordinación.
c) Utilizando la notación de flecha, mostrar la coordinación de oxígeno a Fe 2+ .
d) Se ha realizado una gran cantidad de investigación sobre la geometría exacta del complejo de dioxígeno. Con base en tu estructura Lewis de oxígeno, muestra cómo crees que el oxígeno está unido al hierro. ¿Cómo describirías la geometría?
Contestar a
Ácido de Lewis
Respuesta b
Respuesta c
Respuesta d
Se predeciría que el oxígeno unido tendría una geometría electrónica plana trigonal (curva molecular) basada en la estructura de Lewis.
Hay otro evento interesante que ocurre cuando el oxígeno se une al hierro en la hemoglobina. Después de unir O 2 , el hierro en realidad transfiere un solo electrón al oxígeno, convirtiéndose en un catión Fe 3+ . Aunque la desoxihemoglobina, la especie Fe 2+ o Fe (II), es púrpura, muchos compuestos de Fe 3+ o Fe (III) son rojos. Así, la oxihemoglobina es roja.
También es interesante señalar que estamos acostumbrados a ver que los materiales que contienen hierro se vuelven una especie de color rojo-marrón cuando llevan mucho tiempo expuestos al oxígeno, especialmente en presencia de agua y sales. Nuestros autos, trenes y puentes eventualmente se oxidan a medida que el hierro en su acero se convierte en óxido de hierro rojizo. A William Tolman, investigador en química bioinorgánica de la Universidad de Minnesota, le gusta plantear la siguiente pregunta: confiamos en los complejos de hierro para transportar oxígeno a través de nuestro torrente sanguíneo de agua salada, entonces ¿por qué no nos oxidamos?
La respuesta es que, en cierto sentido, lo hacemos. Se ha estimado que después de varios pases por nuestro torrente sanguíneo, una molécula de hemoglobina se encuentra con su fin cuando el oxígeno no se desprende y el complejo de hierro se descompone en un óxido de hierro. Esa es una de las razones por las que necesitas comer una dieta que contenga hierro, para reponer tus reservas de hierro con el fin de hacer nueva hemoglobina de forma regular.
Para ver algunos problemas adicionales que te ayudarán a conocer los compuestos de coordinación, dirígete al capítulo principal del compuesto de coordinación . En particular, es realmente útil poder contar electrones en química de coordinación. Contar electrones es como aprender las estructuras de Lewis, excepto que en lugar de ir a una cuenta máxima de ocho electrones, podemos llegar a un máximo de dieciocho electrones. Eso es porque la configuración de gas noble para un metal de transición tendría dieciocho electrones, no ocho. Para aprender a contar electrones en complejos de coordinación, entra aquí .