14.5: Reversión del Enlace Dativo
- Page ID
- 80581
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Un enlace coordinado o dativo es cualquier enlace covalente que surgió porque un átomo trajo un par de sus electrones y los donó a otro.

Cuando el nitrógeno dona un par de electrones para compartir con el boro, el boro gana un octeto. Ambos átomos están saturados electrónicamente. Además, un par de electrones no enlazantes se convierten en enlaces; se deslocalizan sobre dos átomos y se vuelven más bajos en energía. Este desarrollo actúa como una fuerza impulsora para la formación del vínculo dativo.
- La formación de enlaces dativos puede ser impulsada por la saturación electrónica; eso significa que los octetos se llenan.
- La formación de enlaces dativos también está impulsada por el hecho de que la formación de enlaces permite que el par solitario del nitrógeno se deslocalice.
Sin embargo, a veces los vínculos se pueden romper de nuevo. En el caso de los enlaces dativos, eso significa que un par de electrones que fueron donados de un átomo a otro pueden ser recuperados de nuevo. Este evento se llama disociación. En la disociación, dos átomos que estaban conectados entre sí se desconectan.

¿Por qué podría romperse un vínculo dativo? Desde un punto de vista, tal vez la carga positiva del átomo de nitrógeno en el complejo ácido-base de Lewis sea desfavorable. El nitrógeno es un elemento relativamente electronegativo, por lo que es fácil imaginar el nitrógeno arrastrando este par de electrones de vuelta a sí mismo, dejando atrás el boro sin un octeto.
Hay otra razón por la que los complejos de Lewis-ácido pueden disociarse. Esa razón es la entropía, o la distribución de la energía. Una de las leyes fundamentales de la termodinámica es que el aumento de la entropía es favorable. Mirado muy flojo, eso significa que es favorable tener energía distribuida en más estados o paquetes. Una de las formas de lograr este objetivo es dividir la energía disponible entre múltiples moléculas.
A pesar de que cuesta energía romper el enlace B-N en el complejo ácido-base de Lewis, hacerlo aún puede ser energéticamente favorable si esa mayor cantidad de energía se puede distribuir mejor entre dos moléculas que en una molécula. Exactamente cómo se logra esa distribución de energía es el tema de la mecánica estadística, y está más allá del alcance de este curso. Sin embargo, la distribución de energía generalmente está relacionada con la capacidad de movimiento de los átomos. En las moléculas, eso significa que está relacionado con la capacidad de los enlaces para estirarse y comprimirse, de los ángulos de unión para exprimirse y ensancharse, y para que las moléculas se desplacen y se desplacen. Hay más formas de voltear y dar vueltas si dos moléculas lo están haciendo, en lugar de una. Eso significa que la energía puede estar mejor distribuida por dos moléculas que por una.
- Los factores de entropía favorecen la disociación o ruptura de los complejos ácido-base de Lewis.
El hecho de que haya una buena razón para que se formen los complejos ácido-base de Lewis, y también una buena razón para que no se formen, puede ser muy insatisfactorio. Sin embargo, simplemente significa que existe un equilibrio entre un nucleófilo y un electrófilo que se unen (asociación) y se van separando (disociación). En qué dirección irá el sistema depende de la importancia relativa de estos dos factores. La importancia relativa de cada factor variará de un caso a otro. En muchos casos, existe un equilibrio dinámico entre los dos casos posibles. Eso significa que después de que se formen los complejos, volverán a descomponerse. Después de que los complejos se deshagan, volverán a formarse. Este proceso no se detiene, sino que continúa mientras haya suficiente energía alrededor para mantener las cosas en movimiento.

Si fuera posible tomar una foto de una colección de moléculas, la imagen podría mostrar algunas de las moléculas coordinadas entre sí y algunas de ellas vagando por su cuenta. La relación entre los pares asociados y las moléculas disociadas está relacionada con el punto de equilibrio. En el punto de equilibrio, diferentes factores que impulsan la reacción a un lado o al otro se equilibran entre sí.
- El equilibrio es el equilibrio entre dos estados posibles. Por ejemplo, es el equilibrio entre amoníaco disociado y asociado y trifluoruro de boro.
En este caso, el equilibrio favorece fuertemente el complejo ácido-base de Lewis. Una imagen de millones de moléculas de amoníaco y trifluoruro de boro mostraría la mayoría de ellas coordinadas juntas. Sin embargo, algunas moléculas se encontrarían por su cuenta.
Ejercicio\(\PageIndex{1}\)
Utilice flechas y estructuras para mostrar la disociación de un nucleófilo o base de Lewis de cada uno de los siguientes aniones poliatómicos.
a) BF 4 - b) PF 6 - c) AlCl 4 - d) AlH 4 - e) Ag (NH 3) 2 +
- Contestar a
-

- Respuesta b
-

- Respuesta c
-

- Respuesta d
-

- Respuesta e
-

Ejercicio\(\PageIndex{2}\)
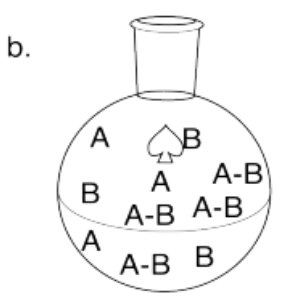
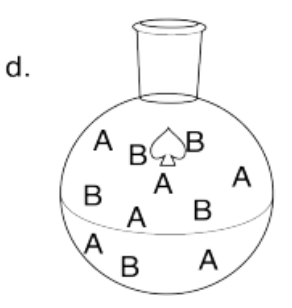
Dibuja imágenes para representar los siguientes casos de equilibrios. Use cuadrados para representar ácidos de Lewis y círculo para representar bases de Lewis.
- El complejo ácido-base de Lewis es muy favorecido.
- El complejo ácido-base de Lewis es ligeramente favorecido.
- El complejo ácido-base de Lewis está muy desfavorecido.
- El complejo ácido-base de Lewis no se forma en absoluto.
- Contestar a
-

- Respuesta b
-
- Respuesta c
-

- Respuesta d
-
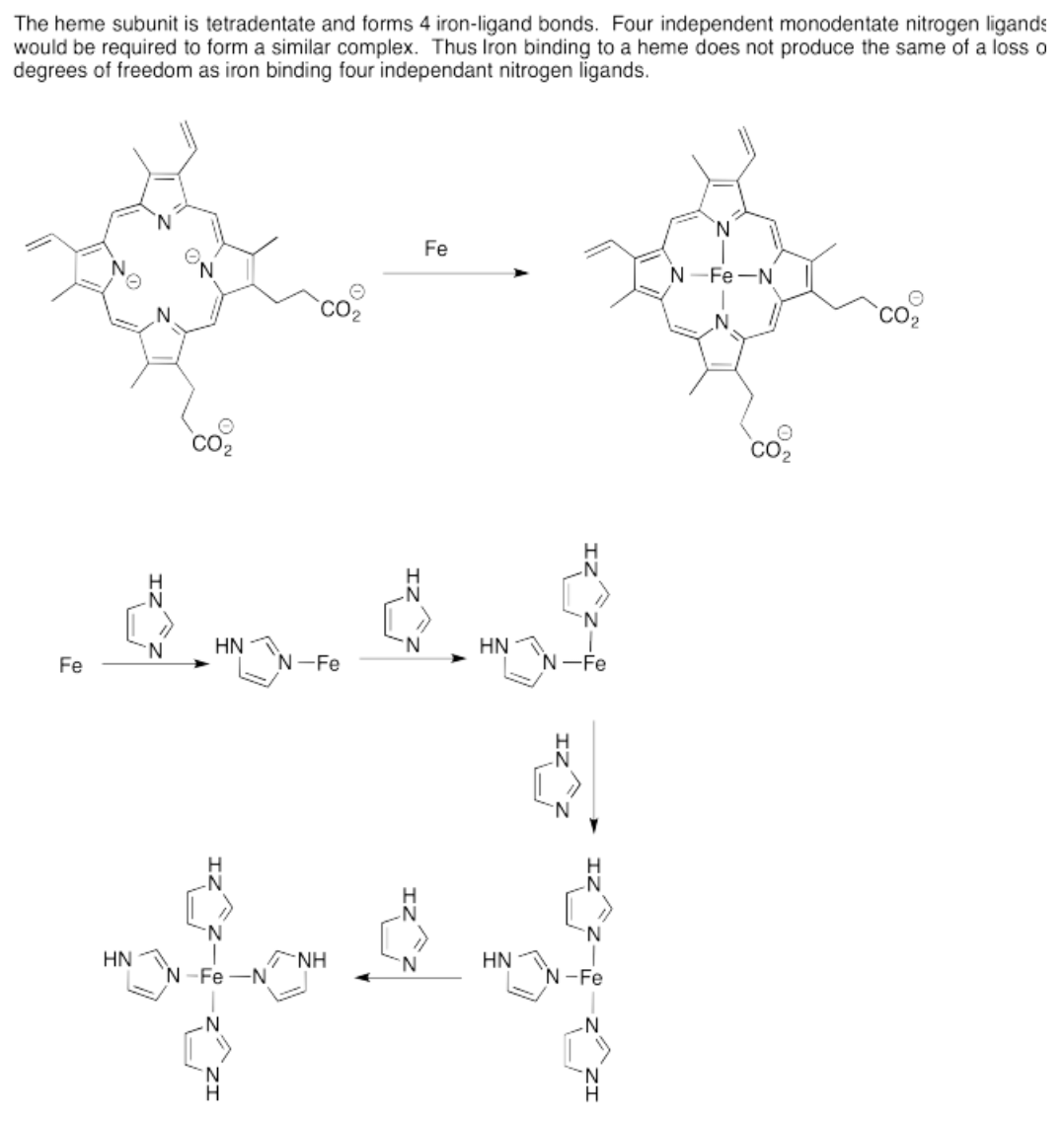
En ocasiones, los complejos ácido-base de Lewis se estabilizan por quelación. Quelación (de la palabra griega, chelos, que significa “cangrejo”) se refiere a la situación en la que una base de Lewis tiene más de un sitio donador de electrones. Eso significa que puede unirse a un ácido de Lewis a través de más que un átomo (así como un cangrejo podría agarrar algo con sus dos garras).

El efecto quelato se refiere al hecho de que los complejos ácido-base de Lewis suelen ser más estables con respecto a la disociación cuando contienen donadores de electrones quelantes. El equilibrio se encuentra mucho más lejos hacia el complejo asociado cuando la quelación es un factor.
La quelación se observa en algunas moléculas biológicas muy comunes que incorporan complejos ácido-base de Lewis. Por ejemplo, la subunidad hemo que se encuentra en las proteínas portadoras de oxígeno, la hemoglobina y la mioglobina, contiene cuatro átomos donadores de electrones que se unen al hierro. Una unidad muy similar se encuentra en otras moléculas, incluyendo el importante cromóforo fotosintético, la clorofila. Las moléculas relacionadas también se encuentran en el importante cofactor biológico, la vitamina B12, y en el citocromo P450, que participa en la desintoxicación del hígado, entre otras tareas.

Ejercicio\(\PageIndex{3}\)
Usando el concepto de entropía, explicar por qué un complejo hierro-hemo es más estable que un ion hierro complejado con cuatro donantes de nitrógeno separados, como histidina o anión pirrol.

- Contestar
-