14.11: Factores que Afectan Bronsted-Acidez Baja- Factores Locales
- Page ID
- 80593
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Un ácido de Brønsted proporciona un protón a un donante de electrones. Al hacerlo, el antiguo ácido de Brønsted se convierte en una base conjugada. Podemos entender mucho sobre la transferencia de protones observando esa base conjugada. Si la base conjugada no es muy estable, entonces probablemente no se donará el protón. Si la base conjugada es muy estable, entonces el protón se puede renunciar más fácilmente.
Electronegatividad y carga nuclear
El primer factor a considerar es ese átomo unido al protón en el ácido de Brønsted. Ese es el átomo que aceptará un par de electrones del enlace covalente que comparte con el protón. ¿Con qué facilidad puede este átomo aceptar un par de electrones?
Un factor obvio a considerar es la electronegatividad. A medida que el átomo unido al protón se vuelve más electronegativo, el par de electrones de unión se vuelve más fuertemente atraído por ese átomo, y menos atraído por el protón. Si el enlace se polariza más lejos del protón, parece probable que el protón se ionice más fácilmente. La molécula que contiene este enlace será un ácido Brønsted más fuerte. No se aferrará al protón con la misma fuerza. Tendrá un pKa inferior.
Los átomos con electronegatividades superiores se encuentran en la parte superior derecha en la tabla periódica. Moviéndose hacia la derecha a través de una fila, la carga del núcleo nuclear está aumentando, por lo que hay más atracción por los electrones.
Además, debemos pensar en lo que sucede después de que el protón se haya ionizado. En la mayoría de los casos, un ácido de Brønsted neutro (sin carga) dará lugar a una base conjugada aniónica. La transferencia de protones es generalmente reversible, por lo que siempre podría volver de donde vino, a menos que algo estabilice el anión que se forma. Sin embargo, si un átomo tiene una mayor carga nuclear del núcleo, será más estable como anión que otros átomos. Eso significa que un compuesto con un hidrógeno unido a ese átomo cederá un protón más fácilmente. Cuando consideramos las estabilidades aniónicas, la tendencia a través de una fila de la tabla periódica es exactamente la misma que la tendencia en la polaridad de los enlaces.

Podemos comparar los pKa de metano (CH 4), amoníaco (NH 3), agua (H 2 O) y fluoruro de hidrógeno (HF) para examinar estas ideas. El carbono, el nitrógeno, el oxígeno y el flúor están todos en fila en la tabla periódica. El flúor, a la derecha, tiene la mayor carga de núcleo y la mayor electronegatividad. El carbono, a la izquierda, tiene el más bajo. El agua debe ser un ácido más fuerte que el amoníaco, que debería ser más ácido que el metano.
De hecho, el pKa del fluoruro de hidrógeno es 4; el del agua es 15; el del amoníaco es 35; y el del metano es de aproximadamente 50. El agua es mucho más ácida que el amoníaco, que es mucho más ácido que el metano. El hidróxido es un ion más estable que el ion amida, NH 2 -, que es un ion más estable que el ion metilo, CH 3 -.
- La electronegatividad se puede usar de manera confiable para comparar acidedades de dos enlaces X-H diferentes en la misma fila.
- Cuanto mayor sea la electronegatividad de un átomo, más fácilmente se ioniza su enlace X-H.
- También, cuanto mayor sea la carga central de un átomo, más estable será como anión, X -, después de que se pierda el protón.
Claramente, ninguno de los compuestos ilustrados anteriormente es altamente ácido. Si has aprendido alguna química antes, es posible que estés familiarizado con la idea de que el ion hidróxido es una base fuerte. El hidróxido tiene una atracción muy fuerte por los protones. Se une a un protón para formar agua, y es mucho más estable en esa forma.
Sin embargo, estas comparaciones son relativas. El ion amida es una base aún más fuerte que el ion hidróxido; se une a los protones muy fuertemente. El anión metílico es una base extremadamente fuerte que une los protones de manera extremadamente fuerte.
Ejercicio\(\PageIndex{1}\)
En cada caso, elija el compuesto con más probabilidades de actuar como donante de protones.
a) H 2 S o SiH 4 b) GaH 3 o Ash 3
c) PH 3 o AlH 3 d) H 2 Se o HBr
- Contestar a
-
H 2 S
- Respuesta b
-
Ash 3
- Respuesta c
-
PH 3
- Respuesta d
-
HBr
Carga sobre el donante de protones
El átomo unido al protón influye en la acidez de otras maneras. Que ese átomo tenga o no una carga formal se vuelve muy importante. La razón es simple: cuando se renuncia a un protón, el protón tendrá una carga positiva, y el átomo que libera el protón se volverá más negativo. En consecuencia, si el átomo unido al protón ya tiene una carga negativa, es menos probable que renuncie al protón. Si lo hiciera, tomaría una carga de 2-. Esa acumulación de cargos no sería muy favorable.
Por otro lado, si el mismo tipo de átomo tuviera una carga positiva, sería mucho más probable que renunciara a un protón. Una vez que lo hiciera, no tendría ningún cargo en absoluto. Eso sería bastante favorable; no habría que gastar energía en estabilizar una carga que ya no está ahí.
Como ejemplo, considere tres especies relacionadas: agua (H 2 O), ion hidróxido (HO -) e ion hidronio (H 3 O +). De los tres, el ion hidronio sería el más probable de donar un protón, con el fin de aliviar el átomo de oxígeno de carga positiva. La estabilización de carga cuesta energía, por lo que no tener ningún cargo suele ser mejor que tener una carga.
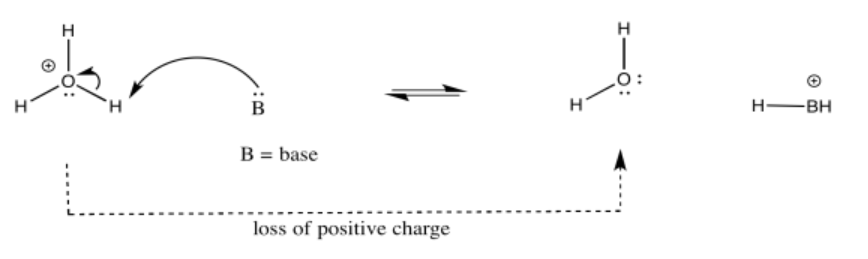
El ion hidróxido tendría menos probabilidades de renunciar a un protón, porque eso dejaría un ion óxido con una carga de 2-. Ese incremento en la carga negativa en un átomo cuesta energía.

El ion agua sería intermedio. Habría un incremento en la carga sobre el átomo, pero no sería lo mismo que una acumulación de una carga 2 en el átomo.

En otras palabras, el ion hidronio es más ácido que el agua, y el agua es más ácida que el ion hidróxido.
Por supuesto, estas reglas generales sobre la acidez no siempre se aplican en diferentes situaciones. Sabemos que los halógenos tienden a ser bastante estables como aniones, en su mayor parte, por lo que su forma aniónica puede ser más estable que su forma neutra. Por el contrario, los iones metálicos positivos pueden ser más estables que el átomo neutro correspondiente. En el caso específico de cuán probable es que un átomo renuncie a un protón, sin embargo, el desarrollo de carga o pérdida de carga sí se convierte en un factor importante. Este factor es especialmente importante cuando estamos comparando dos átomos del mismo tipo, como dos átomos de oxígeno o dos átomos de nitrógeno.
Ejercicio\(\PageIndex{2}\)
En cada caso, valorar si existe un cargo formal. Elija el compuesto con más probabilidades de actuar como donante de protones.
a) + NH 4 o NH 3 b) PH 2 o PH 3 c) H 2 O o + NH 4 d) H 3 O + o CH 4
- Contestar a
-
+ NH 4
- Respuesta b
-
PH 3
- Respuesta c
-
+ NH 4
- Respuesta d
-
H 3 O +
Polarizabilidad
Veamos otro ejemplo, comparando los pKa de los haluros de hidrógeno. Todos estos compuestos son ácidos mucho más fuertes que el agua. El fluoruro de hidrógeno, HF, tiene un pKa de 4. El cloruro de hidrógeno, HCl, tiene un pKa de -1. El bromuro de hidrógeno, HBr, tiene un pKa de -5, y el yoduro de hidrógeno, HI, tiene un pKa de -7.

El fluoruro tiene la electronegatividad más alta de las cuatro bases conjugadas aquí, y el yoduro tiene la menor. Sin embargo, el fluoruro se une a su protón con mayor fuerza, y el HF tiene el pKa más alto. Algo más que la electronegatividad está trabajando aquí.
- Las diferencias de electronegatividad no pueden explicar las diferencias en la acidez de los enlaces H-X en una columna de la tabla periódica.
Una forma de discutir esta tendencia es en términos de polarizabilidad. Un átomo polarizable es generalmente un átomo grande que puede distribuir la carga fácilmente sobre un volumen mayor; la carga está menos concentrada de lo que estaría en un átomo más pequeño. La distribución de la carga se está estabilizando.
- Al comparar átomos aniónicos de la misma columna de la tabla periódica, se puede utilizar la polarizabilidad del átomo (relacionada con su tamaño) para explicar diferentes estabilidades aniónicas.
La razón por la que la polarizabilidad domina las comparaciones dentro de una columna, pero no dentro de una fila, tiene que deberse al cambio relativamente grande en el tamaño de los átomos de una fila a la siguiente. A medida que los electrones ocupan un nivel de energía adicional, el tamaño del átomo aumenta enormemente. Los átomos también cambian de tamaño a medida que nos movemos por una fila de la tabla periódica, haciéndose un poco más pequeños a medida que aumenta la carga nuclear. Sin embargo, este cambio no es tan dramático como el cambio de tamaño de una fila a la siguiente.
Anteriormente, observamos ambos lados de la ecuación, antes y después de la ionización, en términos de carga del núcleo y electronegatividad. Ambas consideraciones llevaron a conclusiones similares sobre qué enlaces serían más ácidos. Hasta el momento, hemos mirado los aniones que se forman cuando los haluros de hidrógeno se ionizan. ¿Hay algún factor (distinto de la electronegatividad) que podamos usar para comparar directamente los haluros de hidrógeno?
Entre estos compuestos, la fuerza de unión aumenta desde la parte inferior de la columna hasta la parte superior (de aproximadamente 70 kcal/mol en HI a aproximadamente 135 kcal/mol en HF). Eso significa que es mucho más fácil romper un átomo de hidrógeno de un átomo de yodo en HI que romper un átomo de hidrógeno de un átomo de flúor en HF. Eso no es lo que estamos haciendo cuando ionizamos estos enlaces; estamos rompiendo un protón lejos de un anión en cada caso, en lugar de alejar un átomo de hidrógeno neutro de otro átomo neutro. Sin embargo, cualquier factor que influya en la fuerza de unión puede estar afectando también la acidez.
Las fuerzas de unión varían de esta manera indirectamente debido a las electronegatividades relativas de los halógenos. Los electrones de valencia sobre el flúor, un átomo más electronegativo, están a una energía menor que los del bromo o del cloro. Cuando los electrones de valencia en un átomo de hidrógeno y un átomo de halógeno se combinan para formar un enlace, la combinación de enlaces está a una energía menor que cualquiera de los originales.
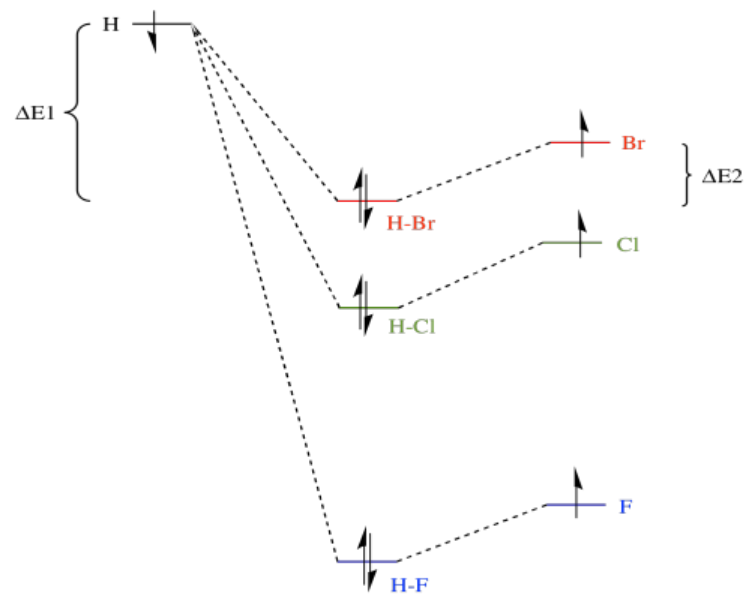
Por supuesto, la combinación antiunión está a una energía mayor que cualquiera de los originales, pero como no hay electrones en ese nivel no tenemos que preocuparnos por eso.
¿Qué es una fuerza de unión? Es solo la cantidad de estabilización tras la formación del enlace. Dicho de manera alegórica, es lo profundo que es el barranco en el que han rodado los electrones cuando se forma el enlace. Para romper el vínculo, los electrones tendrían que volver a subir las colinas de nuevo del barranco. Por ejemplo, la fuerza de enlace de HBr implica la cantidad de energía por la que ha caído el electrón sobre el hidrógeno, ΔE1, más la cantidad en la que ha caído el hidrógeno sobre el bromo, ΔE2. Para volver a romper el vínculo, tendríamos que sumar en la suma de ΔE1 + ΔE2.
La cantidad análoga para HCl es mayor, principalmente porque ΔE1 en ese caso es mucho mayor, e incluso es mayor para HF. Por lo tanto, las fuerzas de unión varían en el orden HF > HCl > HBr.
Mientras estamos viendo esa imagen, vale la pena considerar otro aspecto común de las fortalezas de los vínculos. Como simple aproximación, hay dos componentes importantes que describen un enlace. Un componente es el solapamiento (qué tan bien se comparten los electrones; es decir, qué tan covalente es el enlace). El otro componente es el intercambio (cuánta atracción electrostática hay entre los átomos; es decir, qué tan polar es el enlace). De hecho, el bromo es mejor para compartir sus electrones con hidrógeno que el flúor, pero el enlace H-F es más polar que el enlace H-Br. Este último hecho es otra consecuencia de la electronegatividad del flúor. Una vez más, la mayor electronegatividad del flúor en realidad conduce a un vínculo más fuerte en este caso.
- Al comparar dos átomos en una columna de la tabla periódica, la fuerza del enlace con el hidrógeno es un buen índice de cuán ácido será el enlace.
Tenga en cuenta que la fuerza de unión no funciona como comparación de los enlaces H-X en una fila de la tabla periódica. Un enlace HF es más fuerte que un enlace OH (aproximadamente 110 kcal/mol) o enlace CH (aproximadamente 100 kcal/mol en promedio), pero es mucho más ácido.
Ahora, en resumen, necesitamos pensar en ambos lados de la ecuación. El enlace H-F es el más fuerte; es decir, es el más bajo en energía. Sin embargo, tras la ionización, el bromuro es el anión más estable, ya que es el más grande y más polarizable. En general, la reacción del HBr al bromuro es la más descendente en energía; esa ocurrirá con mayor facilidad. En contraste, la reacción del HF al fluoruro es en realidad cuesta arriba en energía; esa será la más difícil de ionizar.

Ejercicio\(\PageIndex{3}\)
En cada caso, elija el compuesto con más probabilidades de actuar como donante de protones.
a) H 2 S o H 2 Te b) GeH 4 o SnH 4 c) HCl o HBr d) NH 3 o Ash 3
- Contestar a
-
H 2 Te
- Respuesta b
-
SnH 4
- Respuesta c
-
HBr
- Respuesta d
-
Ash 3
Ejercicio\(\PageIndex{4}\)
Clasificar los siguientes grupos de compuestos de los más ácidos a los menos ácidos.
a) PH 3, NH 3, Ash 3 b) PH 3, H 2 S, SiH 4, HCl c) BH 3, SiH 4, SeH 2, HI
- Contestar a
-
aSH 3 > PH 3 > NH 3
- Respuesta b
-
HCl > H 2 S > PH 3 > SiH 4
- Respuesta c
-
HI > SeH 2 > SiH 4 > BH 3
Ejercicio\(\PageIndex{5}\)
Las acidedades relativas de los compuestos en algunos de los siguientes pares pueden explicarse por la polarizabilidad. En otros, no pueden. Explique por qué la polarizabilidad es o no una comparación útil para hacer en cada caso.
a) CH 3 OH, (CH 3) 2 CHOH b) SH 2, sEH 2 c) GeH 4, SiH 4 d) GeH 4, Gah 3
- Contestar a
-
La polarizabilidad no sería útil ya que el átomo que será aniónico en la base conjugada es el mismo (oxígeno).
- Respuesta b
-
Se es más grande y por lo tanto más polarizable, lo que lleva a que H 2 Se sea más ácido en comparación con H 2 S.
- Respuesta c
-
Ge es más grande y por lo tanto más polarizable, lo que lleva a que GeH 4 sea más ácido en comparación con SiH 4.
- Respuesta d
-
La polarizabilidad no sería útil ya que los átomos están uno al lado del otro en la misma fila y, por lo tanto, es probable que tengan la misma polarizabilidad
Hibridación
Existe un caso especial relacionado con el factor de afinidad electrónica descrito anteriormente. Generalmente se manifiesta en discusiones sobre compuestos de carbono o nitrógeno, y específicamente trata de comparaciones de dos átomos del mismo elemento que tienen diferente geometría. Por ejemplo, el enlace C-H que involucra un carbono tetraédrico es extraordinariamente no ácido (pKa cerca de 50), pero un enlace C-H que involucra un carbono lineal es mucho más ácido (pKa de aproximadamente 25).

En el etano, que tiene carbonos tetraédricos, se hace un argumento similar. La diferencia es que un tetraedro es una forma tridimensional. El orbital s aún puede vincularse a los vecinos en cualquier dirección debido a su simetría esférica. Sin embargo, para vincularse con vecinos en las tres dimensiones, se necesitaría todo el conjunto de orbitales p, porque cada orbital p se encuentra a lo largo de una sola dimensión.
La energía de los electrones en esta situación de unión será un promedio de la energía de un electrón s y tres electrones p. En cuanto a la contribución energética del carbono, la energía de los electrones en el enlace C-H será tres cuartas partes del camino entre lo que se esperaría si el enlace se formara entre un átomo de H y un electrón de carbono 2s y si el enlace se formara entre un átomo de H y un orbital de carbono p. Eso se debe a que la energía debe ser un promedio de las energías de los cuatro orbitales que podrían contribuir a ese vínculo.
Debido a que los electrones s son menores en energía que los electrones p, la energía de la combinación (s + p) será menor que la energía de la combinación (s + p + p + p). Un electrón en un “orbital sp” en carbono lineal es menor en energía que un electrón en el “orbital sp3" en carbono tetraédrico. Si el electrón está a menor energía en un carbono lineal que un carbono tetraédrico, entonces un carbono lineal tiene una mayor afinidad electrónica que uno tetraédrico.
Esta comparación es muy parecida a la comparación de la afinidad electrónica sobre un oxígeno frente a un carbono. El oxígeno, con una mayor afinidad electrónica, generalmente forma anión más estable que el carbono. Por lo tanto, un enlace O-H es más ácido que un enlace C-H. Un enlace C-H de revestimiento es más ácido que un enlace C-H tetraédrico.
Ejercicio\(\PageIndex{6}\)
Predecir cuál de estos dos compuestos nitrogenados será más básico.

- Contestar
-


