14.12: Factores que afectan a Bronsted-Acidez Baja- Factores Distales
- Page ID
- 80602
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
A veces hay factores más alejados del protón que afectan la acidez de Brønsted. Además de considerar el átomo al que está directamente unido el protón, es posible que necesitemos considerar otras partes de la molécula para entender la estabilidad aniónica.
Un primer factor a considerar es la deslocalización por conjugación. En términos de estructura de Lewis, eso significa resonancia. La deslocalización de carga se estabiliza, por lo que si una carga negativa puede distribuirse a través de múltiples átomos vía resonancia, una base conjugada será más estable.
- la resonancia puede deslocalizar la carga negativa y estabilizar un anión.
- una base conjugada más estable se forma más fácilmente. Un ácido de Brønsted cederá un protón más fácilmente si da lugar a una base conjugada estable.
Muchos compuestos orgánicos contienen grupos hidroxilo u OH, algunos de los cuales son ácidos y otros no. Tres tipos de compuestos que contienen este grupo son alcoholes, fenoles y ácidos carboxílicos. Ejemplos de estos grupos funcionales incluyen ciclohexanol, fenol y ácido benzoico.
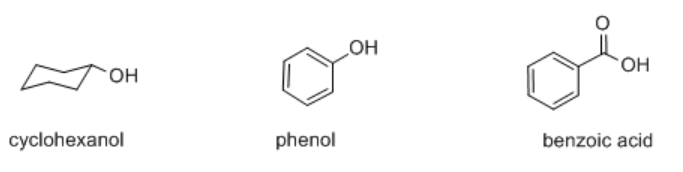
El ciclohexanol es un alcohol. Un alcohol contiene un grupo OH conectado a un carbono tetraédrico.
El fenol es ligeramente diferente; contiene un grupo OH conectado a un carbono plano trigonal que forma parte de un anillo aromático. Los anillos aromáticos son grupos cíclicos de átomos, generalmente carbonos, con enlaces pi deslocalizados alrededor del anillo. El benceno es el ejemplo más común de un anillo aromático. Es un anillo de seis carbonos y todos los carbonos son planos trigonales. En la estructura de Lewis, se dibuja con enlaces simples y dobles alternantes entre los carbonos.
El ácido benzoico contiene un grupo funcional muy diferente en el que el OH está conectado a un carbonilo. Un carbonilo es una unidad carbono-oxígeno con un doble enlace, C=O; el carbono en un carbonilo es plano trigonal, como en un fenol, pero la presencia del doble enlace al oxígeno hace una gran diferencia.
El ciclohexanol tiene un pKa de aproximadamente 18. Es menos ácido que el agua. Puede renunciar a un protón, pero es mucho más probable que el protón esté ligado al oxígeno que discociado. El fenol tiene un pKa de aproximadamente 9 y se considera ligeramente ácido. El ácido benzoico tiene un pKa de aproximadamente 5; su acidez es similar a la del ácido fluorhídrico, aunque no tan ácida como otros haluros de hidrógeno.


La comparación de las bases conjugadas de ciclohexanol, fenol y ácido benzoico revela algunas diferencias.
- En el ciclohexanol, el anión formado por la pérdida de un protón se localiza en el oxígeno. No hay estabilización de resonancia.
- En fenol, el anión formado por la pérdida de un protón se deslocaliza. Las estructuras de resonancia muestran que la carga negativa puede ser compartida entre el átomo de oxígeno y tres de los carbonos en el anillo de benceno.
- En el ácido benzoico, el anión también se deslocaliza. Esta vez la carga negativa se comparte entre dos átomos de oxígeno diferentes.
La deslocalización por resonancia juega un papel claro en la estabilización de la base conjugada formada después de la pérdida de un protón. A pesar de la polaridad de enlace similar en ciclohexanol y fenol, el protón está mucho más fuertemente unido en ciclohexanol. La mayor estabilidad del anión fenolato en comparación con el anión ciclohexanóxido hace que sea más fácil eliminar un protón del fenol que el ciclohexanol.
- Los átomos sobre los que se deslocaliza la carga aún juegan un papel importante en la determinación de la estabilidad. La deslocalización en un átomo de oxígeno adicional puede ser más estabilizante que la deslocalización en varios carbonos.
Ejercicio\(\PageIndex{1}\)
Algunos compuestos tienen enlaces C-H ácidos, a pesar de que muchos hidrocarburos tienen pKa extremadamente altos (como metano, CH4, pKa = 50). Explicar la razón de la tendencia en pKa entre los siguientes compuestos.
ciclopentadieno, pKa 25 ciclopentanona, pKa 18 2,4-hexanodiona, pKa 12
- Contestar
-

Ejercicio\(\PageIndex{2}\)
Comparar la acidez de los siguientes pares de compuestos.
- etanol, CH 3 CH 2 OH, y alcohol vinílico, CH 2 =CHOH.
- trimetilamina, (CH 3) 3 N, y nitrometano, CH 3 -NO 2.
- acetonitrilo, CH 3 -CN y trimetilamina, (CH 3) 3 N
- Contestar a
-
El alcohol vinílico sería más ácido ya que su anión se estabiliza por resonancia mientras que la carga aniónica sobre el etóxido se localizaría en el átomo de oxígeno.
- Respuesta b
-
El nitrometano sería más ácido ya que su anión se estabiliza por resonancia, mientras que la carga aniónica del anión trimetilamina se localizaría en el átomo de carbono.
- Respuesta c
-
El acetonitrilo sería más ácido ya que su anión se estabiliza por resonancia mientras que la carga aniónica de la trimetilamina se localizaría en el átomo de carbono.
Hay otra manera en que los átomos distantes pueden influir en la estabilidad aniónica. Tiene que ver con la electronegatividad.
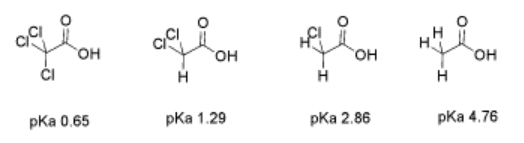
Considere el pKa de estos tres ácidos carboxílicos halogenados similares: ácido bromoacético, ácido cloroacético y ácido fluoroacético. El pKa del ácido fluoroacético es menor que el del ácido cloroacético, que es menor que el del ácido bromoacético. El ácido fluoroacético es más ácido que el ácido cloroacético, que es más ácido que el ácido bromoacético.

Cuando el protón se une directamente a estos tres halógenos, el pKa corre en dirección opuesta. El HBr es más ácido que el HCl, que es más ácido que el HF. Eso se debió a la mayor polarizabilidad del bromuro frente al cloruro y fluoruro.
En estos ácidos haloacéticos, el halógeno puede estabilizar el anión conjugado mediante deslocalización inductiva. En un efecto inductivo, los átomos electronegativos pueden atraer la densidad de electrones hacia ellos mismos. Eso significa que el halógeno comparte la carga negativa parcial de los átomos de oxígeno en el anión carboxilato.
- los átomos electronegativos pueden atraer carga negativa hacia ellos mismos a través de enlaces.
- a este fenómeno se le llama efecto inductivo.
- los efectos inductivos dispersan la carga negativa y estabilizan aniones.
El efecto es aditivo. Si hay más de un halógeno cerca, hay más efecto aceptor de electrones. Hay más carga positiva en el protón, y cuando se libera el protón, el anión resultante tiene más deslocalización de carga.
Ejercicio\(\PageIndex{3}\)
Predecir el orden de acidez en los siguientes compuestos.
a) CF 3 CO 2 H, CFH 2 CO 2 H, CF 2 HCO 2 H b) CF 3 CHCl 2, CF 3 CHCLF, CF 3 CHF 2
- Contestar a
-
CF 3 CO 2 H > CF 2 HCO 2 H > CFH 2 CO 2 H
- Respuesta b
-
CF 3 CHF 2 > CF 3 CHCLF > CF 3 CHCl 2
Se observa una limitación importante en los efectos inductivos al comparar una serie de derivados del ácido clorobutanoico. En el ácido 2-clorobutanoico, la presencia de un cloro junto al carbonilo, cuatro enlaces del protón ácido, hace que este compuesto sea mucho más ácido que el ácido butanoico; los pKa son aproximadamente 2.9 y 4.8, respectivamente.

En el ácido 3-clorobutanoico, el pKa es 4.0, mientras que en el ácido 4-clorobutanoico, con el flúor completamente al final de la cadena, a seis enlaces lejos de la posición ácida, el pKa es 4.5. El flúor en estos dos últimos casos tiene relativamente poco efecto.
- Los efectos inductivos caen rápidamente al aumentar la distancia desde el sitio ácido.
Sin embargo, en sistemas aromáticos el efecto de la distancia es ligeramente más débil. En el ácido 2-clorbenzoico, el efecto del cloro es sustancial, a pesar de su distancia del protón ácido. El pKa del ácido 2-clorbenzoico es de 2.94, en comparación con 4.2 para el ácido benzoico, a pesar de que el cloro está a 5 enlaces del protón ácido. Esta mayor influencia de los efectos inductivos es común en sistemas aromáticos como el benceno.
- Los efectos inductivos se transmiten fácilmente a través de sistemas conjugados como el benceno.

Los sistemas aromáticos contienen conjuntos de electrones deslocalizados y polarizables. A diferencia de los enlaces sigma, en los que los electrones se deslocalizan entre dos átomos pero todavía se encuentran de manera bastante confiable entre esos dos átomos, los enlaces pi mantienen la densidad de electrones más lejos de los núcleos y se distorsionan o polarizan más fácilmente.
Ejercicio\(\PageIndex{4}\)
Para cada uno de los siguientes compuestos:
a. Determine el protón más ácido y proporcione una razón para su elección.
b. Dibujar la base conjugada.


- Contestar
-


