14.20: Soluciones a Problemas Seleccionados
- Page ID
- 80612
Con contribuciones de Nicholas Jones y Kate Graham, College of Saint Benedict/Saint John's University
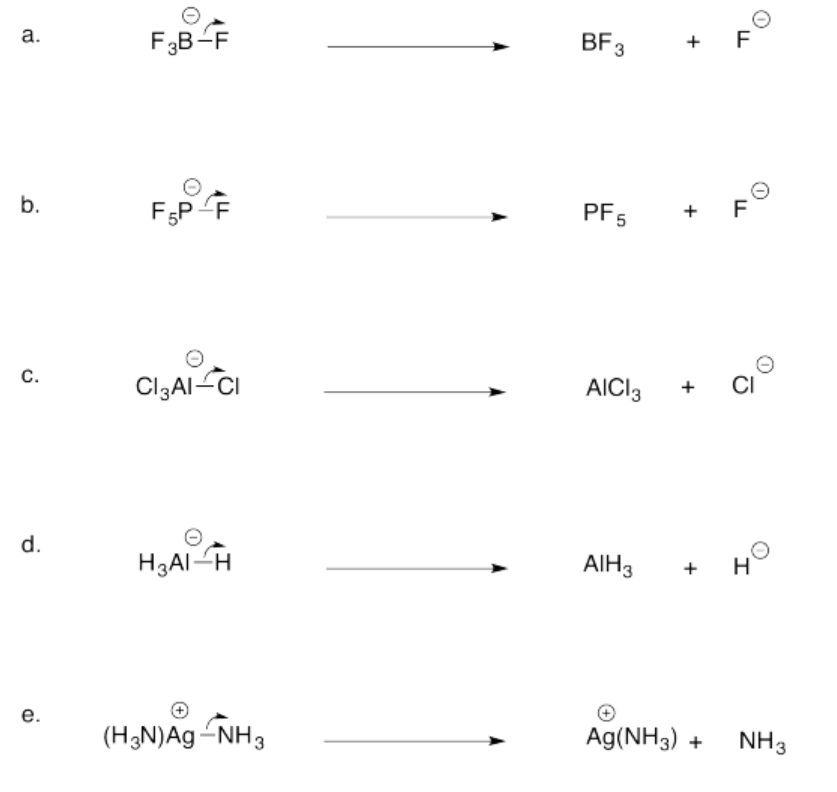
Ejercicio 14.2.1:
Una base de Lewis debe tener pares solitarios o pares de electrones no enlazantes para que pueda donarlos a un ácido de Lewis.
Alternativamente, en algunos casos los electrones en un enlace π pueden ser donados en su lugar, por lo que a veces los compuestos con enlaces π pueden ser básicos de Lewis.
Ejercicio 14.2.2:
a. no una base Lewis
b. no una base Lewis
c. Base Lewis
d. Base Lewis
e. Base Lewis
Ejercicio 14.3.1:
Un átomo de ácido de Lewis atrae electrones de una base de Lewis.
La característica más común de un ácido de Lewis es un átomo que no está “saturado electrónicamente” o que no ha llenado su octeto. Por ejemplo, un aluminio con sólo seis electrones en lugar de ocho es ácido de Lewis.
Otros átomos, como los metales de transición, tienen “octetos” de dieciocho electrones, por lo que tener menos de dieciocho electrones en su caparazón de valencia puede hacer que estos átomos Lewis sean ácidos.
Ejercicio 14.3.2:
a. Ácido de Lewis
b. Ácido de Lewis
c. no un ácido de Lewis
d. Ácido de Lewis
e. no un ácido de Lewis
Ejercicio 14.3.3:
a)
b) cationes
c) posiblemente fuerzas ión-dipolo; alternativamente, los átomos de oxígeno podrían actuar como bases de Lewis, donando pares solitarios a un catión.
d)
e) aniones
f)
g)
h) Cuando el ion cloruro se une a la molécula sensora, le da al complejo general una carga negativa y la adición del ion potasio cancela esta carga.
Ejercicio 14.4.1:
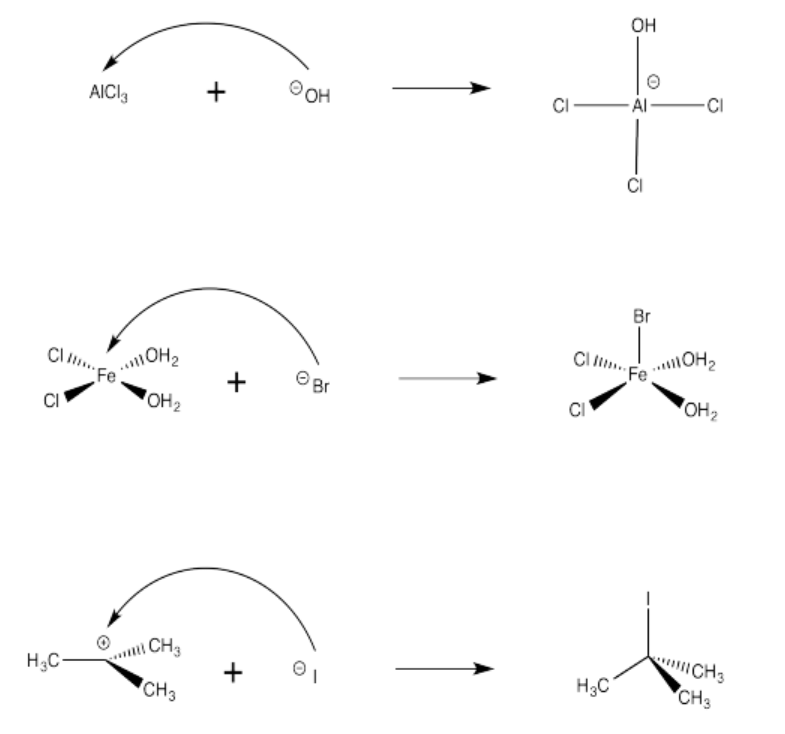
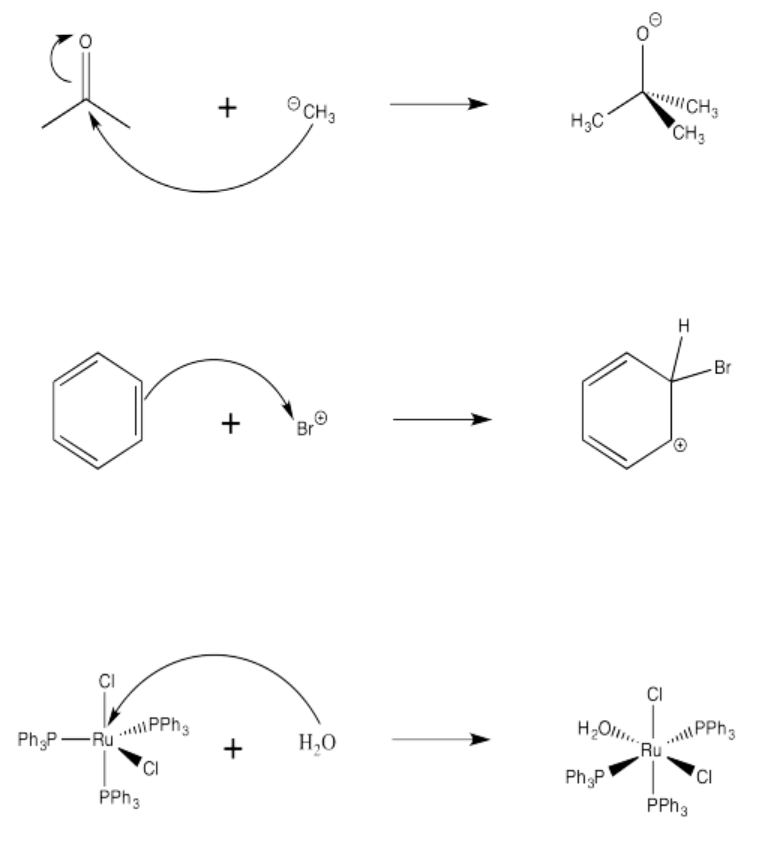
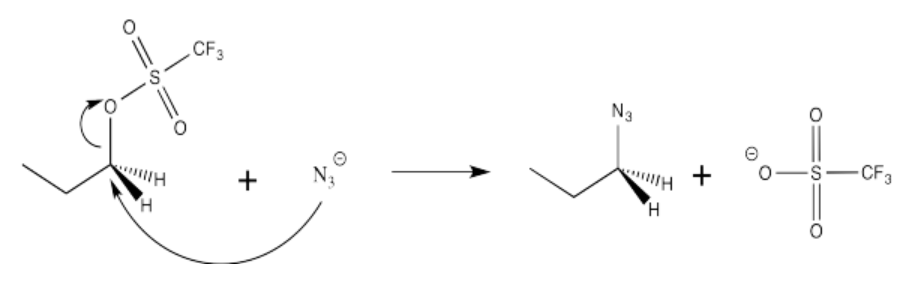
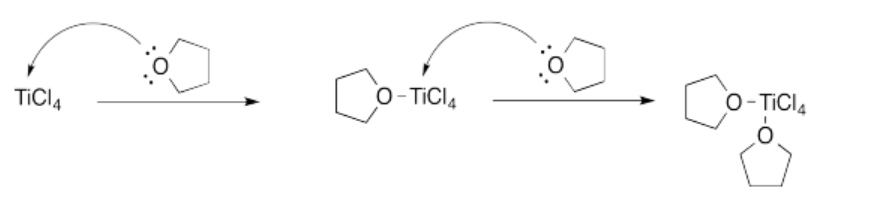
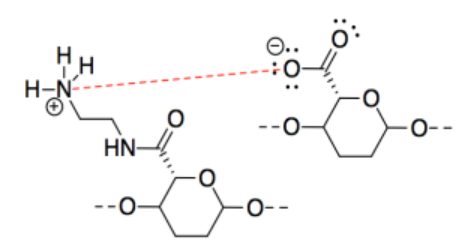
Ejercicio 14.4.3:
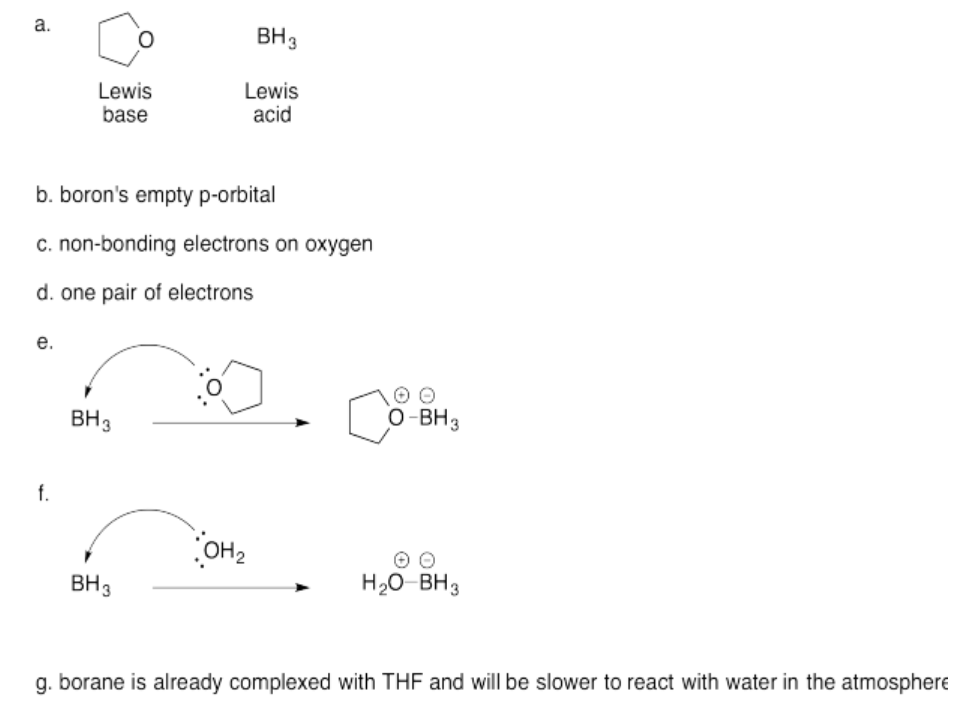
Ejercicio 14.4.5:
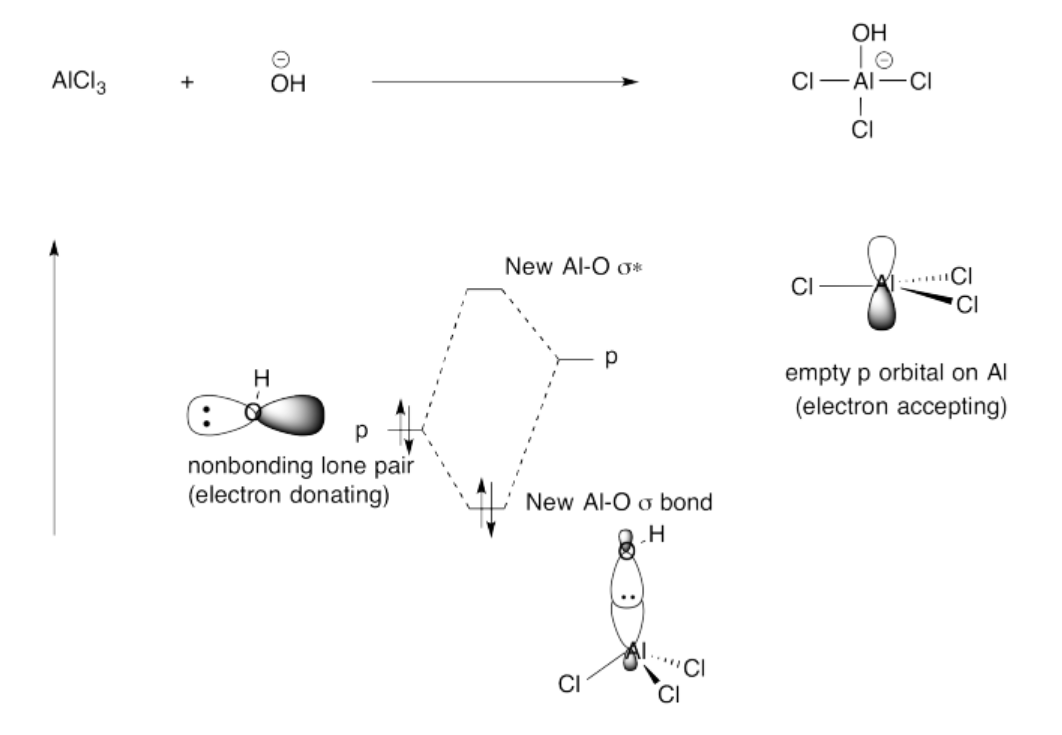
Ejercicio 14.4.6:
a)
b)
- Los anillos de benceno ocupan más espacio que un átomo de flúor; pueden interponerse en el camino, lo que dificulta el acercamiento de la molécula de agua.
Además, los anillos aromáticos pueden formar un sistema conjugado con el orbital p vacío; si ese orbital p está parcialmente lleno, el átomo de boro se vuelve menos ácido de Lewis.
- Un grupo mayor que el flúor puede causar más impedimento estérico. Reemplazar los dos flúor más cercanos al boro en cada areno (anillo aromático) por un grupo CH 3 o CF 3 ralentizaría la formación de un aducto. Alternativamente, un grupo menos electronegativo que el flúor también haría que el boro pareciera menos positivo; un CH 3 u OCH 3 son dos posibilidades.
- Un grupo aún más atrayente de electrones que el flúor haría que el ácido de Lewis fuera más reactivo. Los ejemplos incluyen grupos nitro (NO2) y carbonilo (tales como CH3C=0); estos grupos son extractores de resonancia. Alternativamente, un grupo más pequeño como hidrógeno disminuiría la resistencia estérica, pero también conduciría a una menor electrofilicidad en el boro, debido a la menor electronegatividad del hidrógeno en comparación con el flúor.
Ejercicio 14.4.7:
a) i
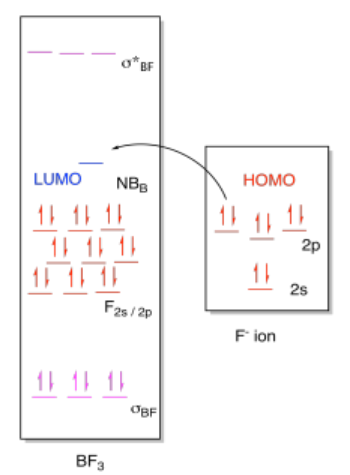
ii)
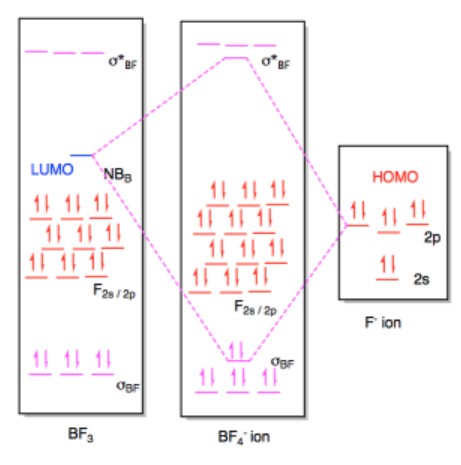
b) i
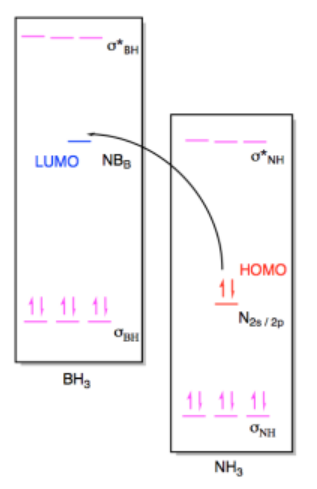
ii)
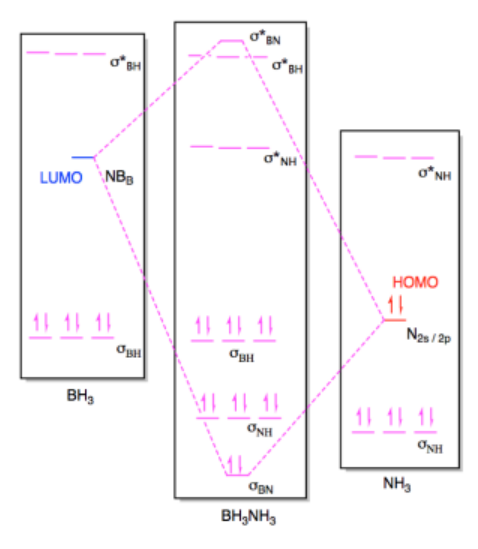
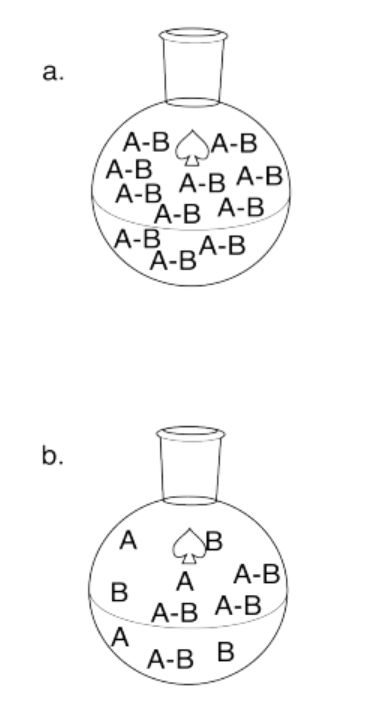
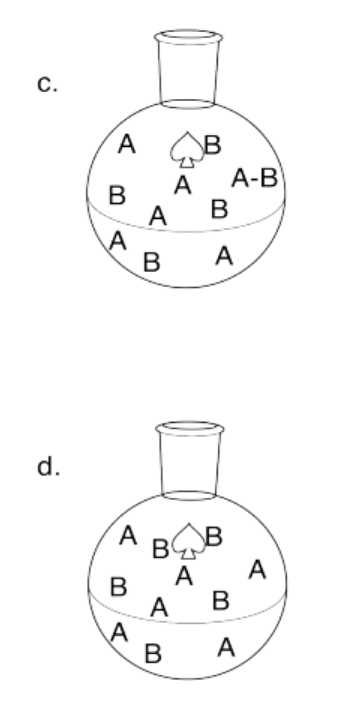
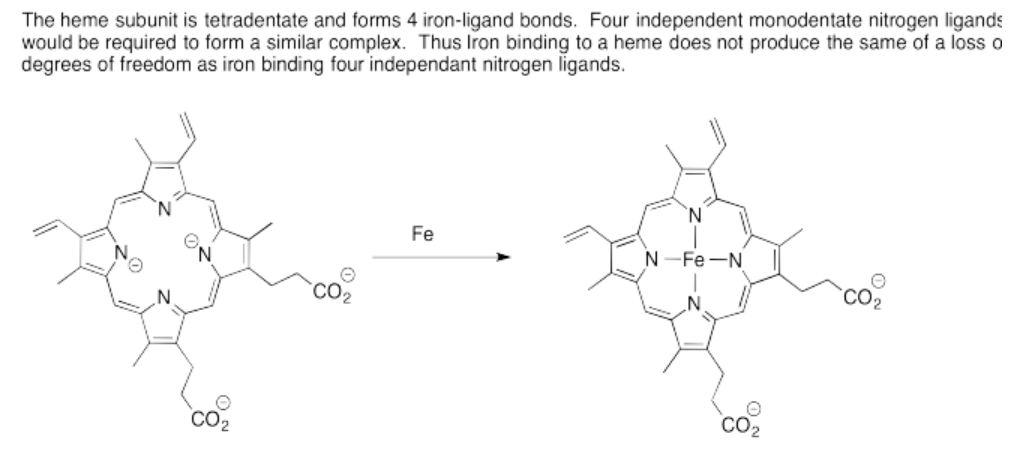
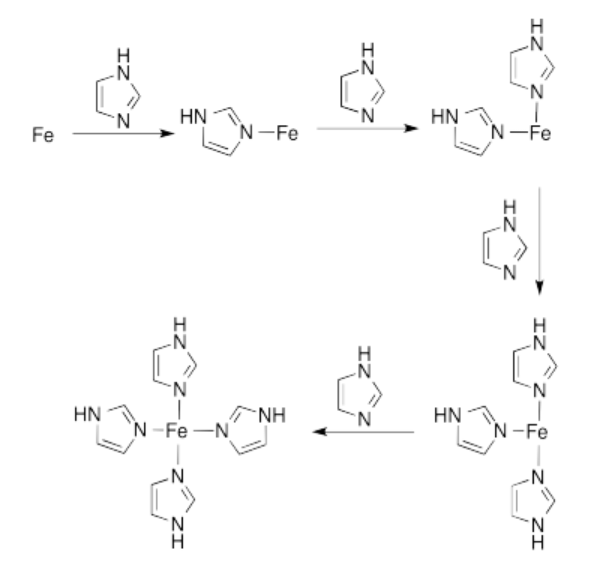
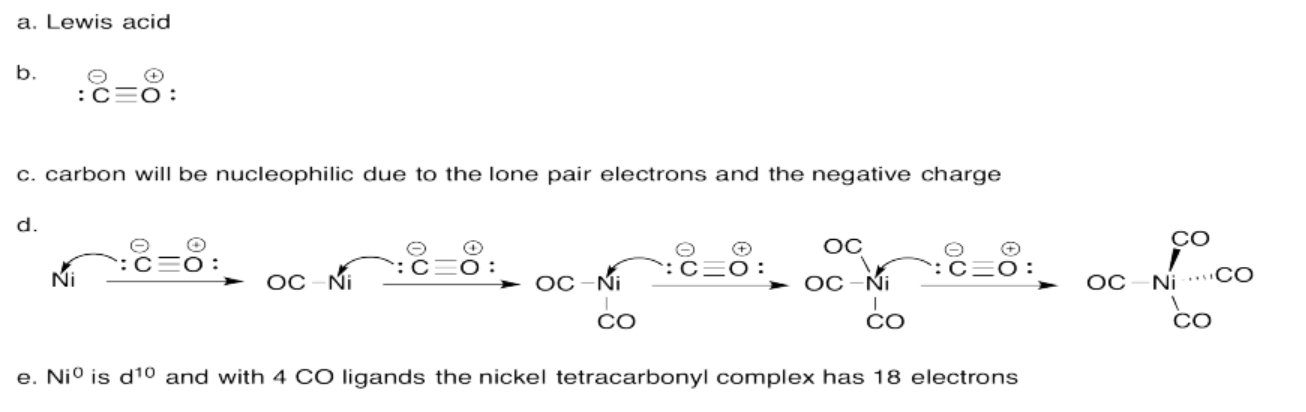
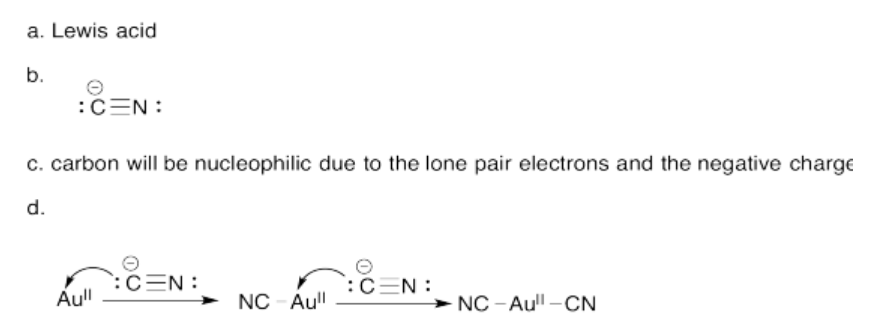

Ejercicio 14.7.3:
a)
b)
c)
d)
e) aromático
f)
g)
h) Este átomo de nitrógeno puede donar un par solitario de electrones sin perturbar el carácter aromático de la molécula.
i)
j)
k) Cada cadena lateral tiene una base Lewis con un par solitario de electrones para donar el ion cobre.
l)
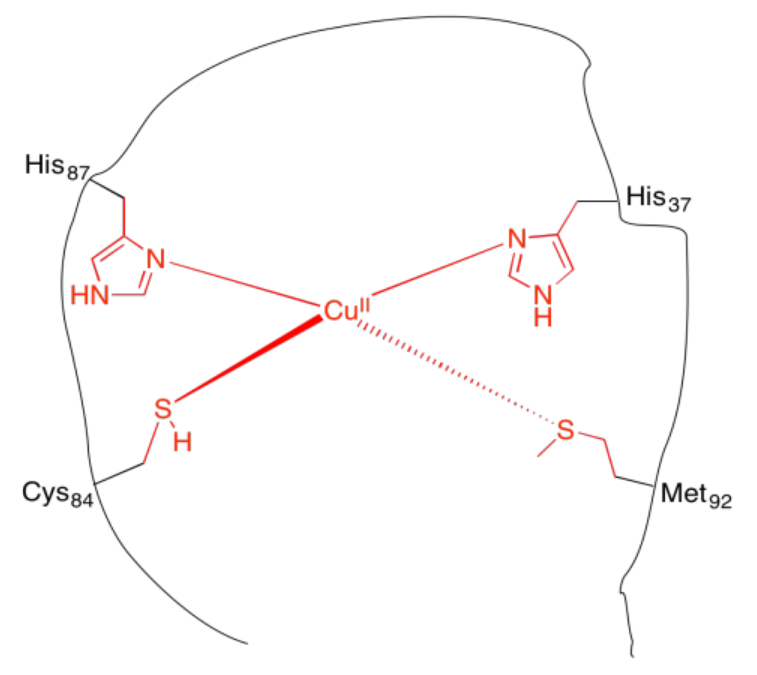
m) CN = 4
n) tetraédrico
o) Cu: 11 e -
Cu (II): 9 e -
\[4 \times 2e^{-} = 8 e^{-} \nonumber\]
\[8e^{-} + 9 e^{-} = 17 e^{-} \nonumber\]
p) Si el imidazol queda ocupado por un protón, entonces el imidazol ya no tiene el par solitario para donar al ion cobre.
q) trigonal
Ejercicio 14.8.1:
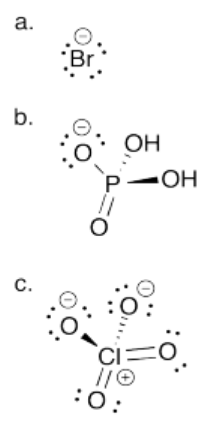
Ejercicio 14.8.2:
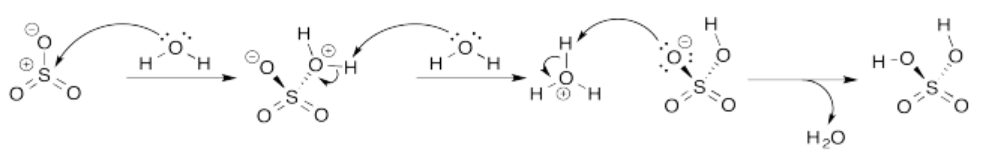
Ejercicio 14.8.3:
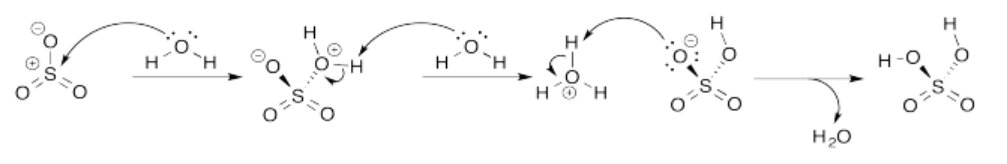
Ejercicio 14.8.4:
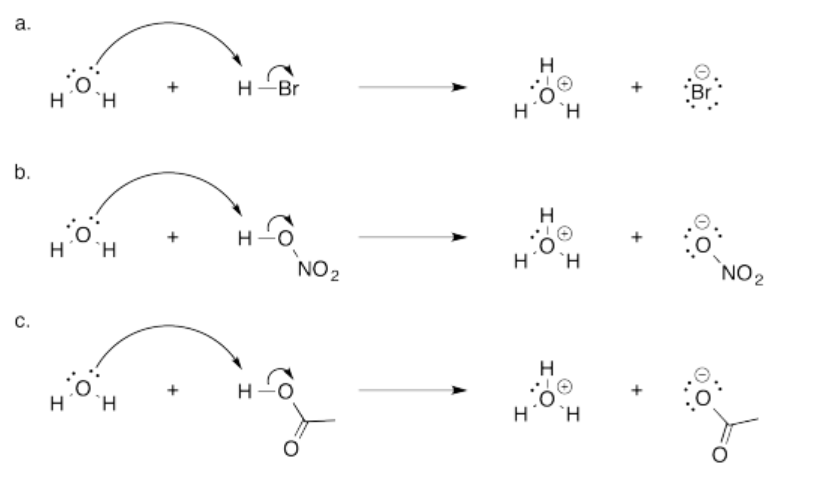
- El enlace O-H es covalente polar. El oxígeno es mucho más electronegativo que el hidrógeno, por lo que el enlace se ioniza fácilmente para dar H +.
- En un caso como el NaOH, la diferencia de electronegatividad entre el sodio y el oxígeno es mucho mayor que la electronegatividad entre el oxígeno y el hidrógeno. El enlace Na-O es iónico. La eliminación de un protón del ion hidróxido es más dura que la eliminación de un protón del hidróxido. Se haría un anión óxido, O 2-; esa acumulación de carga negativa es más difícil que la formación de - OH.
Ejercicio 14.8.5:
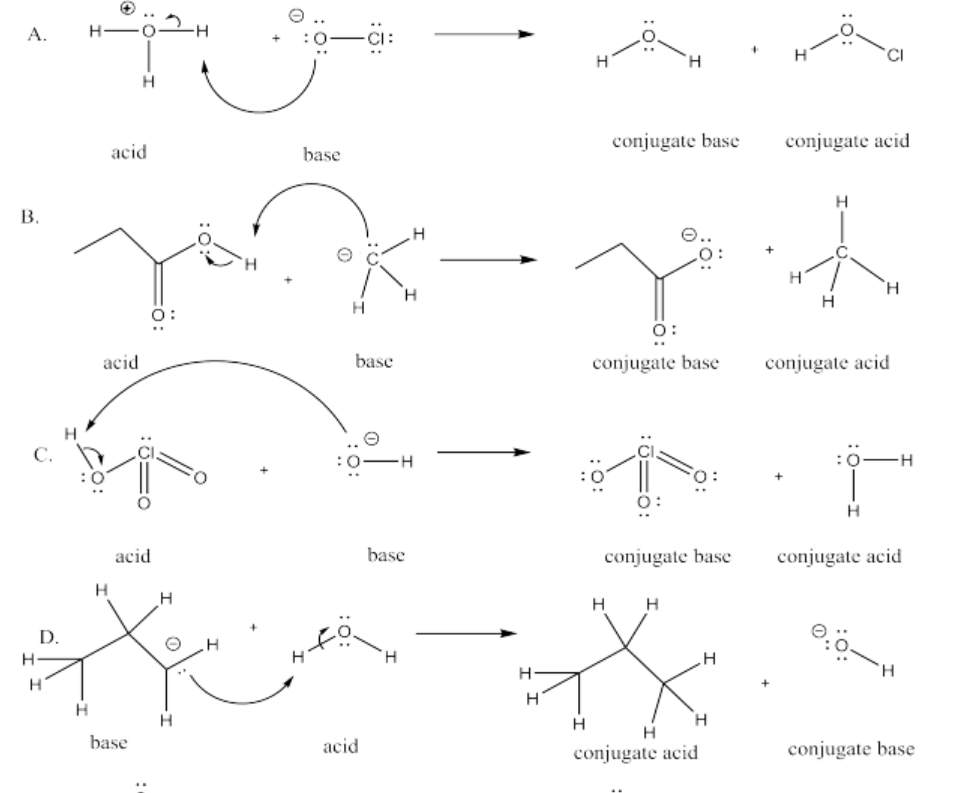
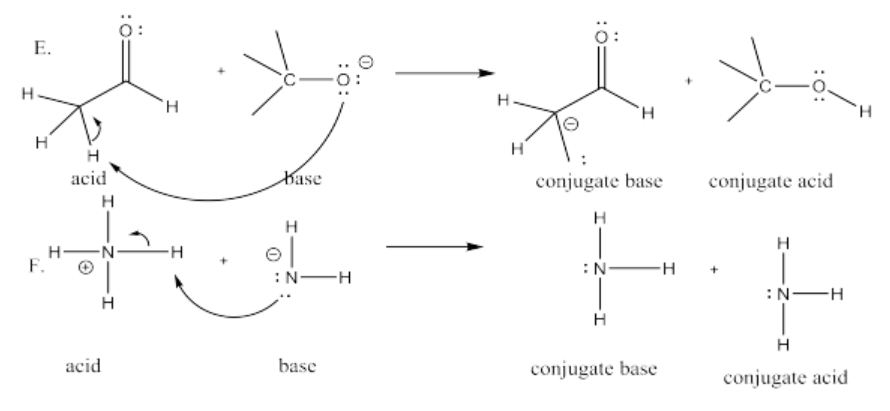
Ejercicio 14.8.6:
a) i)
ii)
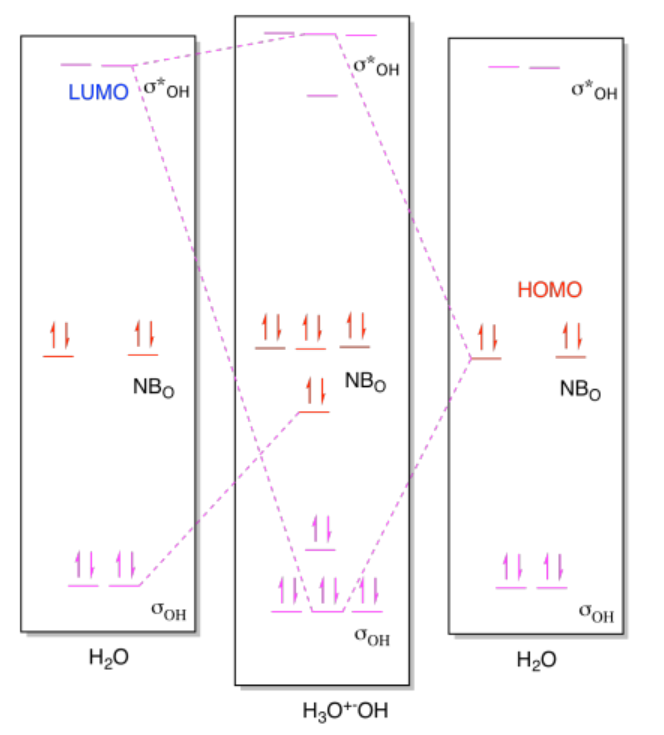
b) i)
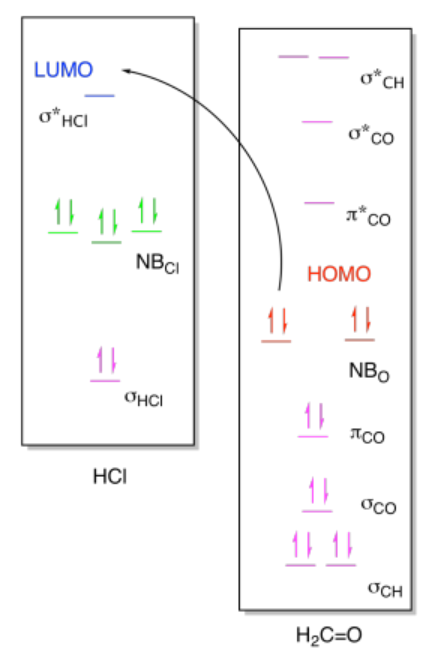
ii)
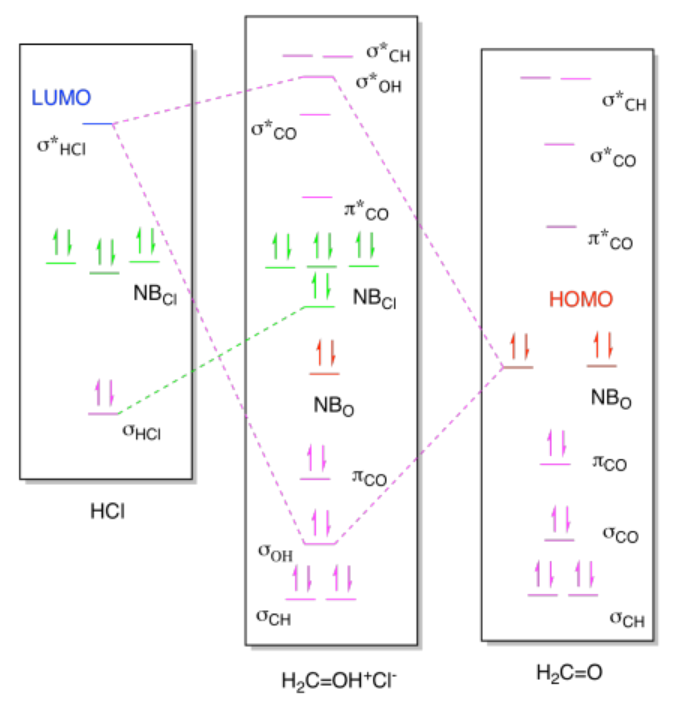
Ejercicio 14.9.1
a) HNO 3 (pK a = -1.3); HNO 2 (pK a = 3.3)
El HNO 3 es un ácido Brønsted más fuerte en comparación con el HNO 2
b) H 2 Se (pK a = 3.9); H 2 O (pK a = 14)
H 2 Se es un ácido Brønsted más fuerte en comparación con H 2 O
c) HCl (pK a = -8); H 2 SO 4 (pK a = -3)
HCl es un ácido más fuerte en comparación con H 2 SO 4
d) Ba (OH) 2 (pKa > 50); HSeO 3 (pKa = 6.6)
HSeO 3 - es un ácido Brønsted más fuerte en comparación con Ba (OH) 2
Ejercicio 14.9.2:
a) NH 4 + (pK a = 9.2); HN 3 (pK a = 4.7)
NH 3 es una base Brønsted más fuerte en comparación con N 3 -
b) HCN (pK a = 9.4); HSCN (pK a = 4)
- CN es una base Brønsted más fuerte en comparación con - SCN
c) NH 3 (pK a = 35); H 2 O (pK a = 14)
- NH 2 es una base Brønsted más fuerte en comparación con HO -
Ejercicio 14.10.1
- HClO 4
- H 3 PO 4
Ejercicio 14.11.1:
a) H 2 S o SiH 4 b) GaH 3 o A sH 3
c) PH 3 o AlH 3 d) H 2 Se o HBr
Ejercicio 14.11.2:
a) + NH 4 o NH 3 b) - PH 2 o PH 3
c) H 2 O o + NH 4 d) + H 3 O o CH 4
Ejercicio 14.11.3:
a) H 2 S o H 2 Te b) GeH 4 o SnH 4
c) HCl o HBr d) NH 3 o Ash 3
Ejercicio 14.11.4:
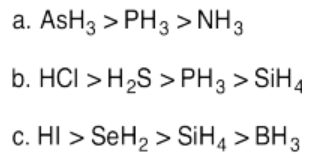
Ejercicio 14.11.5:
a. La polarizabilidad no sería útil ya que el átomo que será aniónico en la base conjugada es el mismo (oxígeno).
b. Se es más grande y por lo tanto más polarizable, lo que lleva a que H 2 Se sea más ácido en comparación con H 2 S.
c. Ge es más grande y por lo tanto más polarizable, lo que lleva a que GeH 4 sea más ácido en comparación con SiH 4 .
d. La polarizabilidad no sería útil ya que los átomos están uno al lado del otro en la misma fila y por lo tanto es probable que tengan la misma polarizabilidad.
Ejercicio 14.11.3:

Ejercicio 14.12.1:
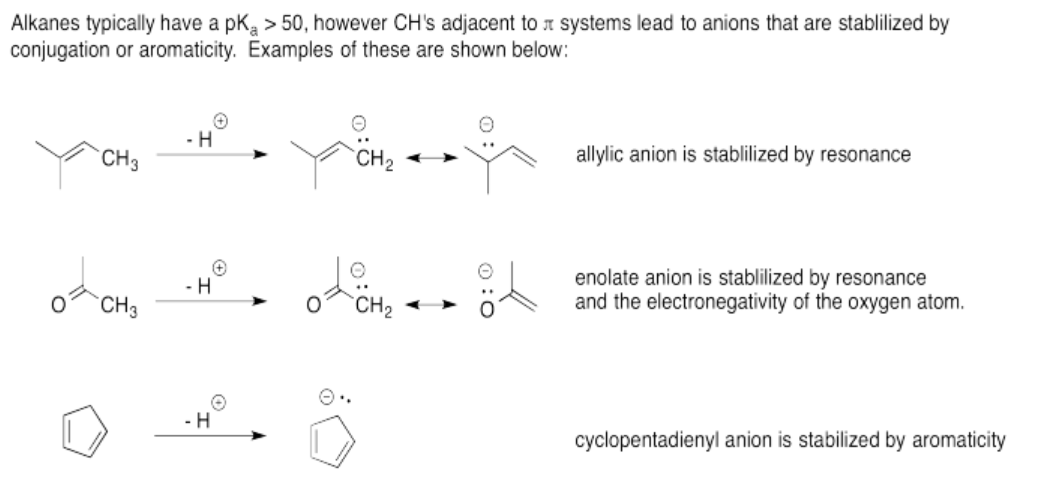
Ejercicio 14.12.2:
a. El alcohol vinílico sería más ácido ya que su anión se estabiliza por resonancia mientras que la carga aniónica sobre el etóxido se localizaría en el átomo de oxígeno.
b. El nitrometano sería más ácido ya que su anión se estabiliza por resonancia, mientras que la carga aniónica del anión trimetilamina se localizaría en el átomo de carbono.
c. El acetonitrilo sería más ácido ya que su anión se estabiliza por resonancia mientras que la carga aniónica de la trimetilamina se localizaría en el átomo de carbono.
Ejercicio 14.12.3:
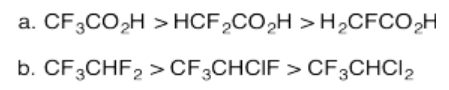
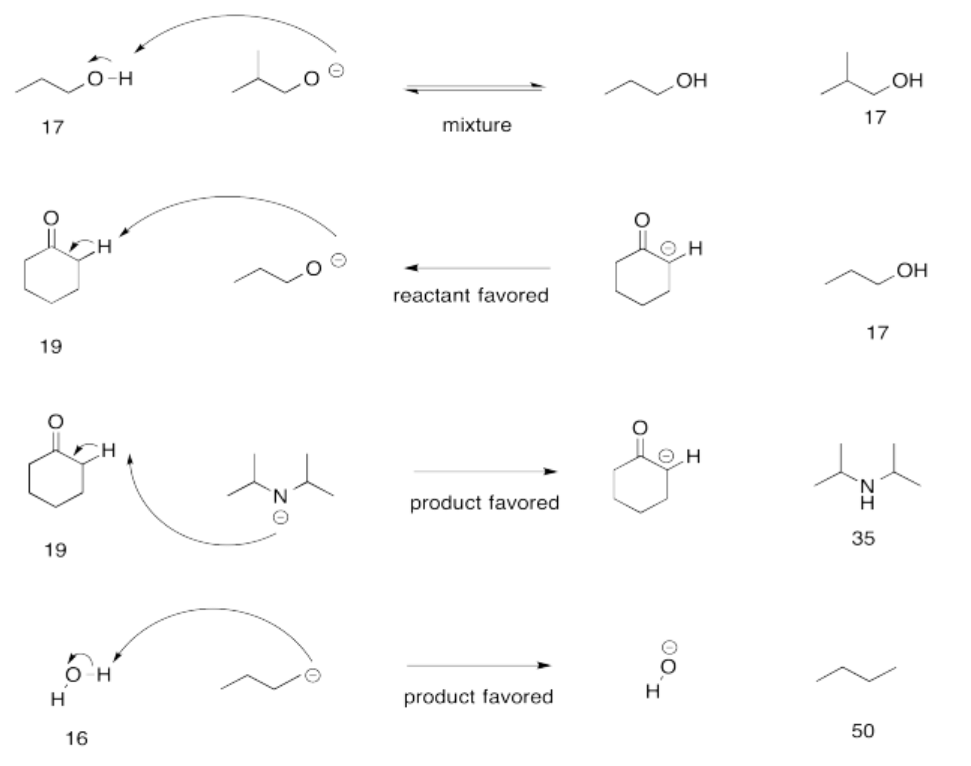
Ejercicio 14.12.4:
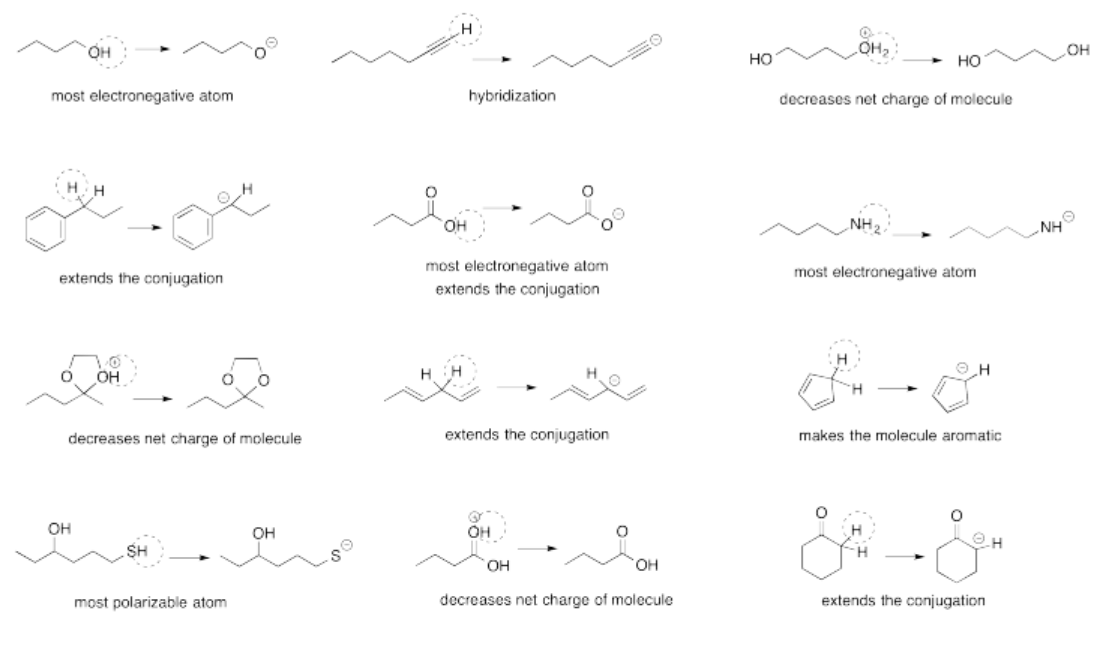
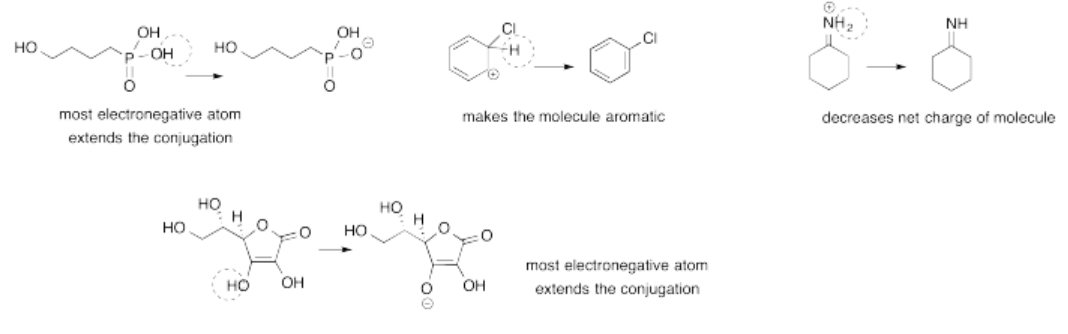
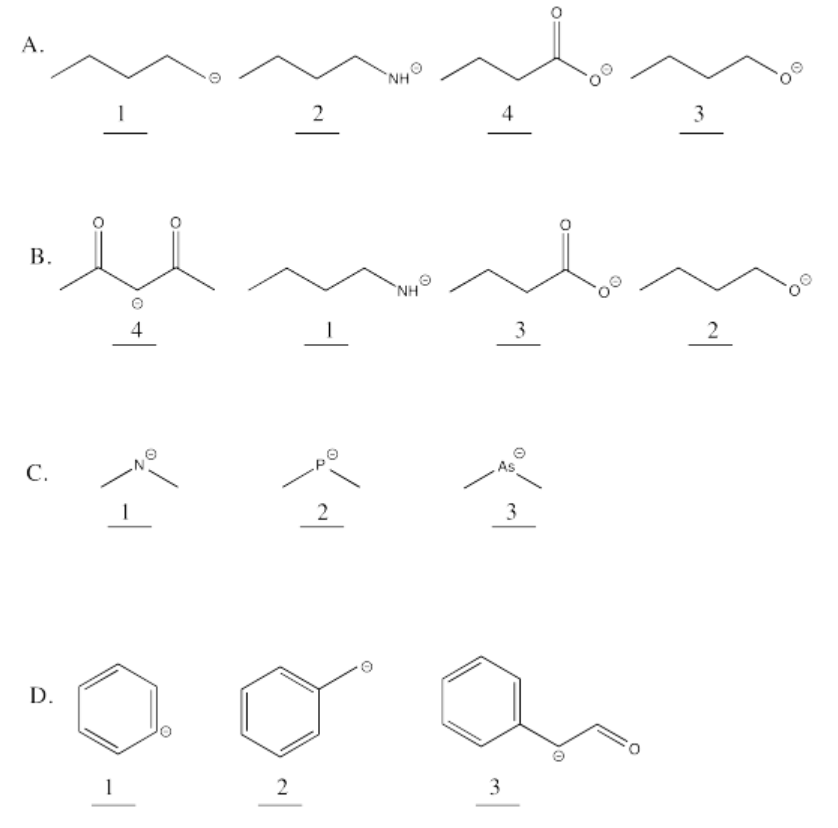
Ejercicio 14.14.2:
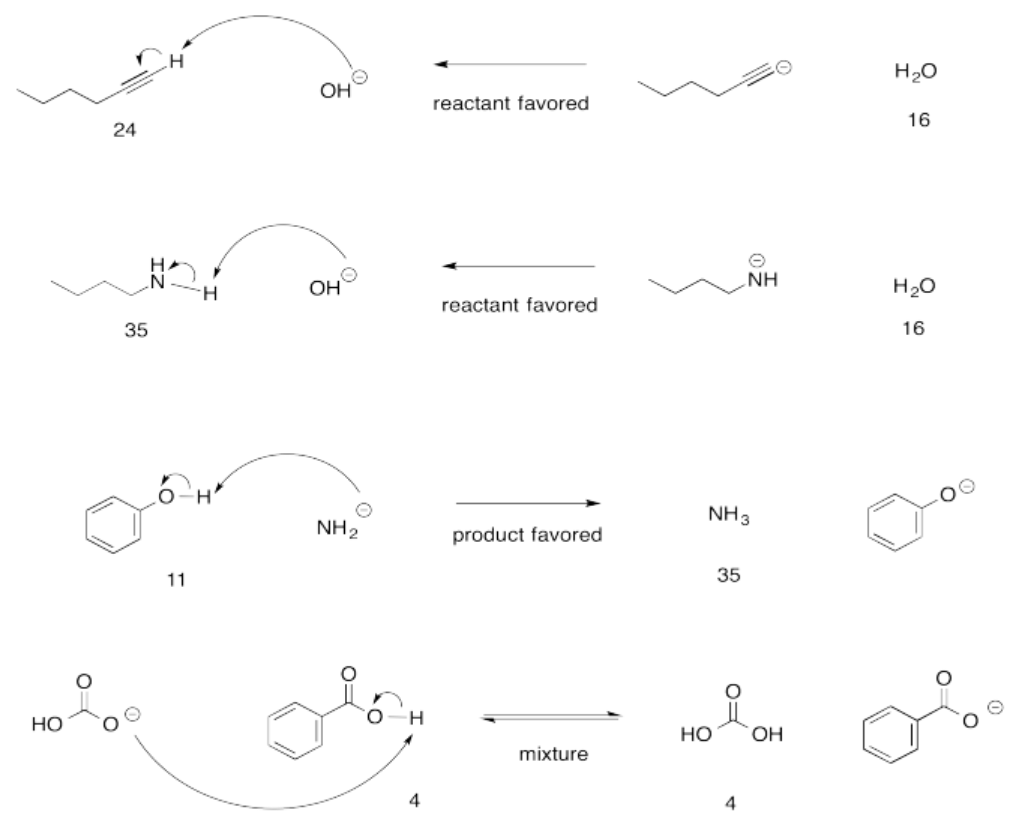

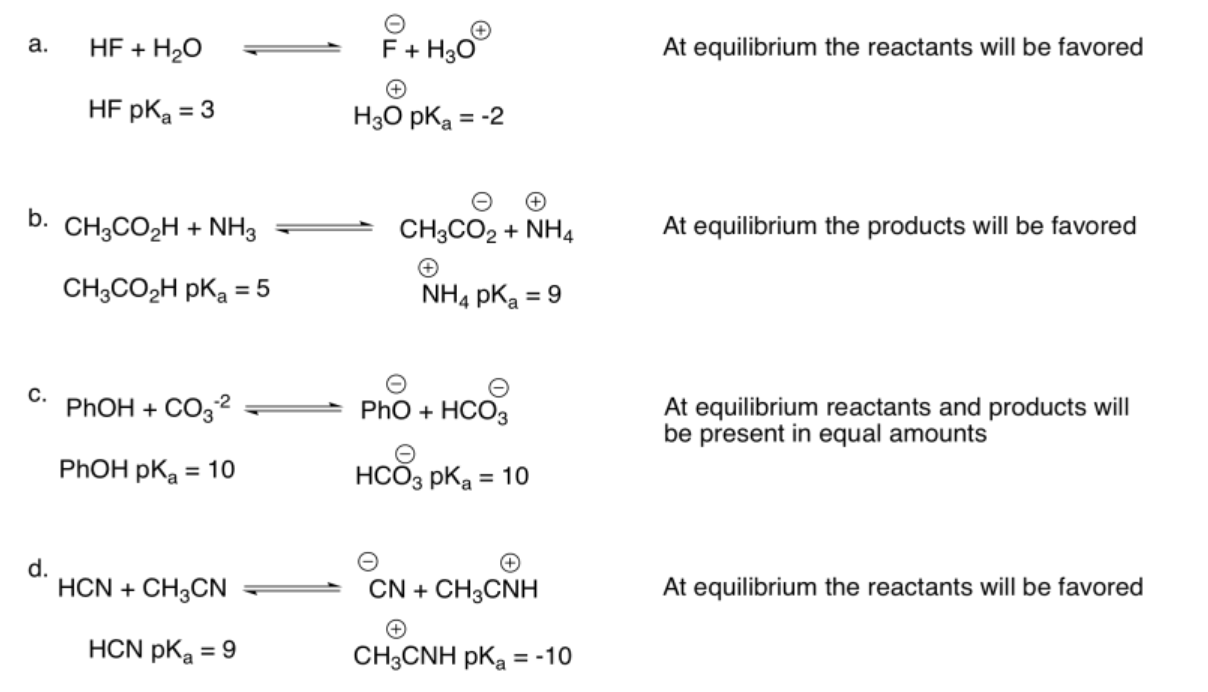
Ejercicio 14.15.1:
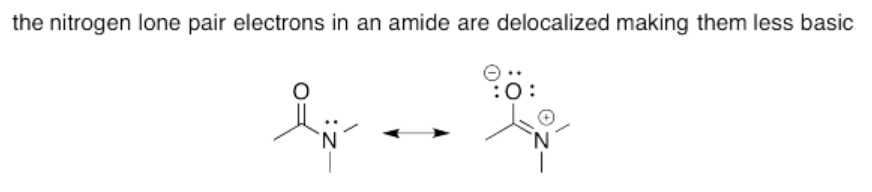
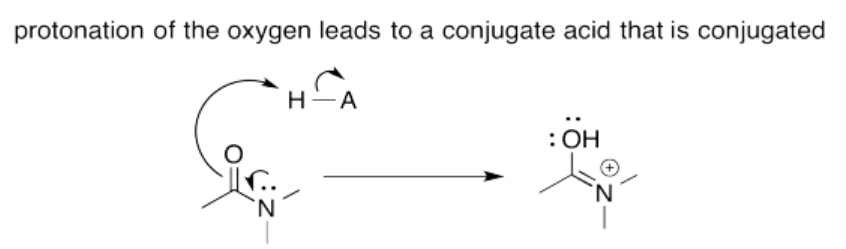
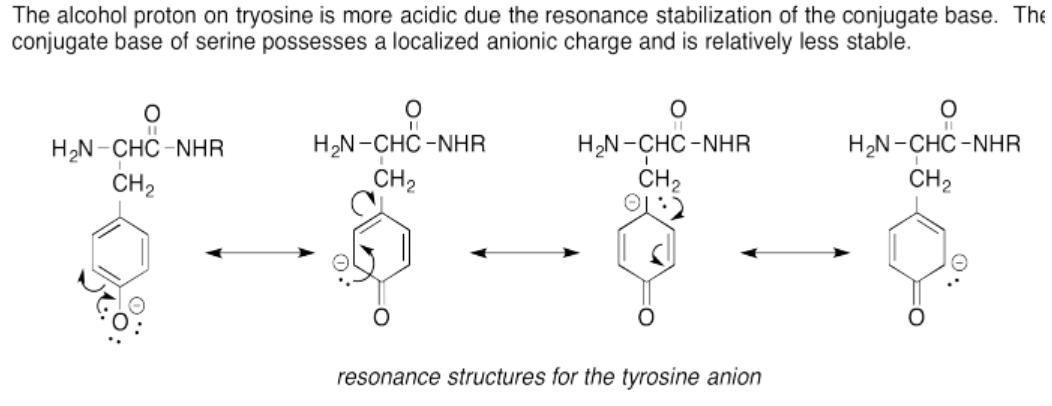
Ejercicio 14.15.4:
El protón tiol sobre la cistina es más ácido debido a la polarizabilidad del anión azufre estabilizando la carga aniónica de la base conjugada. El anión de oxígeno es menos polarizable y por lo tanto menos estable, haciendo que el protón del alcohol sea menos ácido.
Ejercicio 14.15.5:
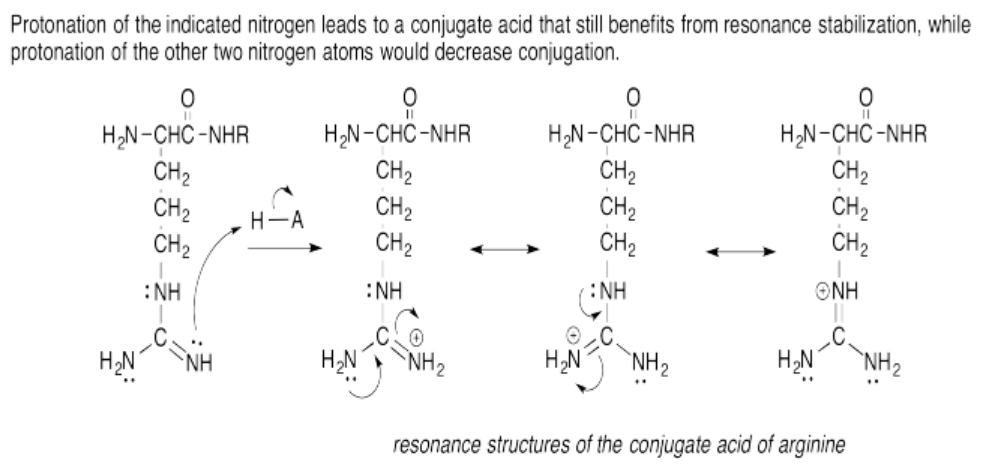
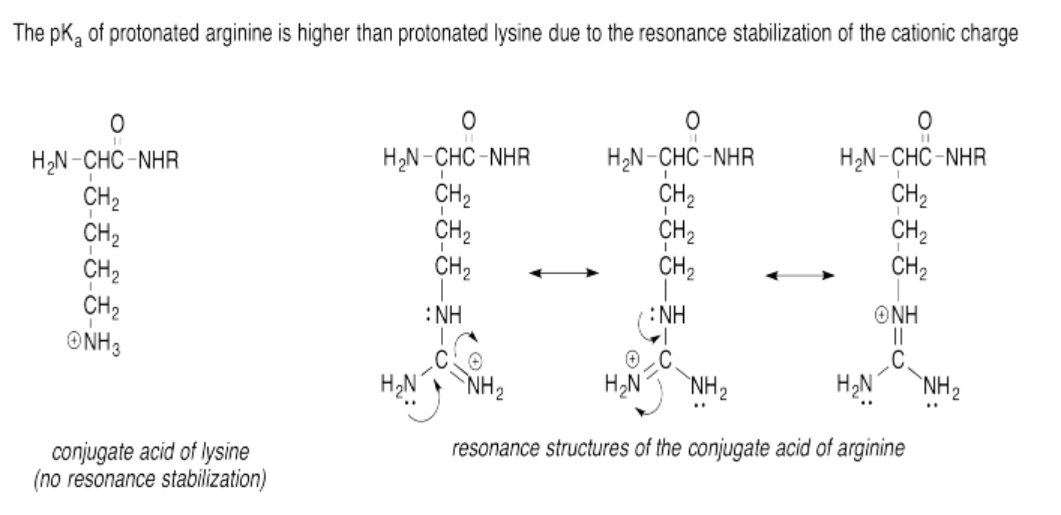
Ejercicio 14.15.6:
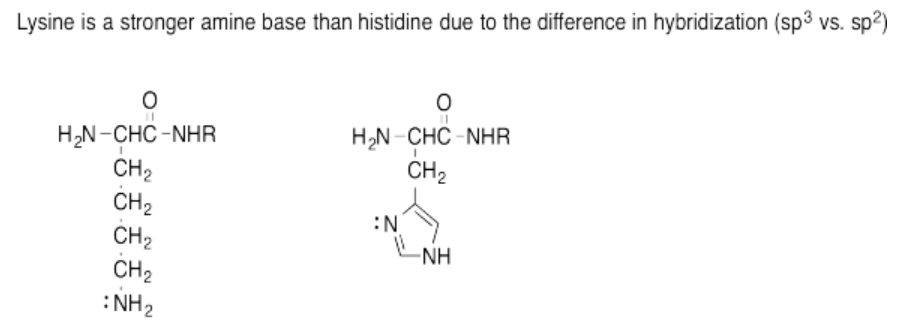
Ejercicio 14.15.7
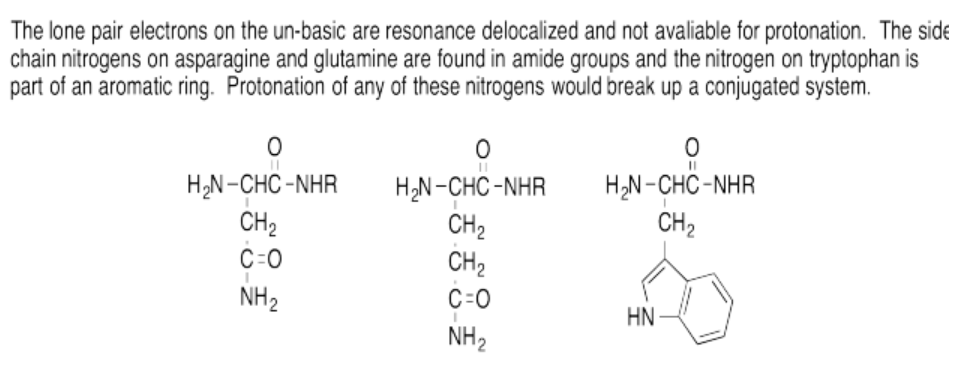
Ejercicio 14.16.1:
El bromuro de amonio es más soluble porque en el agua puede participar tanto en el dipolo iónico como en los enlaces de hidrógeno, mientras que el bromuro de sodio solo se beneficia de las interacciones ión-dipolo.
Ejercicio 14.16.2:
El cianuro de hidrógeno tendrá un pKa más bajo en agua ya que el anión cianuro resultante se estabilizará mediante interacciones ión-dipolo y enlaces de hidrógeno. El cianuro de hidrógeno tendría un pK a mayor en pentanos ya que el anión cianuro resultante solo experimentaría interacciones dipolares inducidas por iones que son relativamente débiles.
Ejercicio 14.17.1:
a.\(K_{a} = \frac{[NC^{-}][H_{3}O^{+}]}{[HCN]}\)
b.\(K_{a} = \frac{[HS^{-}][H_{3}O^{+}]}{[H_{2}S]}\)
c.\(K_{a} = \frac{[H_{2}N^{-}][(CH_{3})_{2}SOH^{+}]}{[HCN]}\)
Ejercicio 14.17.2:
a. pKa = -6
b. pKa = 9
c. pKa = 24
d. pKa = 16
Ejercicio 14.17.3:
a. Ka = 10 3.5
b. Ka = 10 -4.3
c. Ka = 10 -25
d. Ka = 10 -9
Ejercicio 14.17.4:
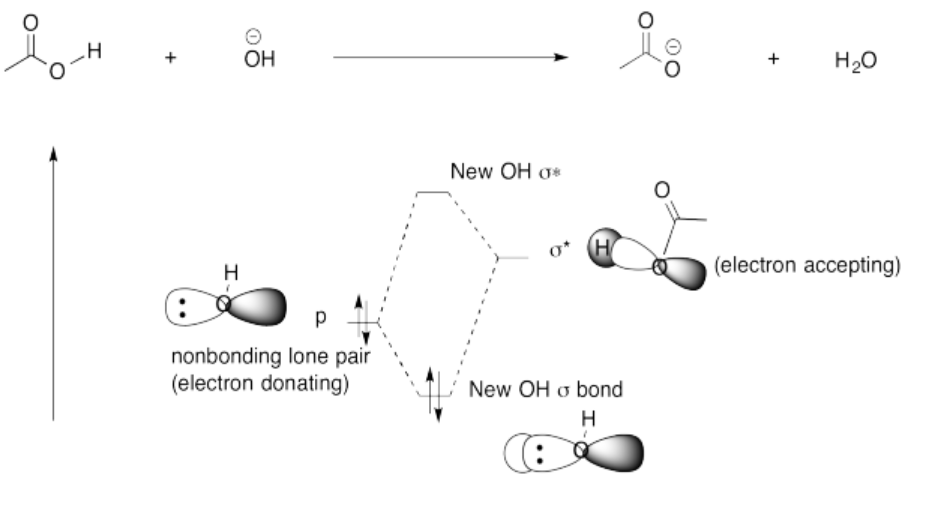
En el equilibrio se favorece ligeramente la formación del complejo ácido-base de Lewis.
Ejercicio 14.17.5:
En equilibrio, la formación del complejo ácido-base de Lewis de dimetiléter y BF 3 es más favorecida que el correspondiente complejo de dietiléter BF 3. Esto probablemente se deba a la disminución del volumen estérico de los grupos methy en comparación con los grupos etilo.
Ejercicio 14.17.6:
a.\(K_{eq}= \frac{[(NH_{3})_{2}PtCl_{2}]}{[(NH_{3})PtCl_{2}][NH_{3}]}\)
b.\(K_{eq} = \frac{[Mo(CO)_{6}]}{[Mo(CO)_{5}][CO]}\)
c.\(K_{eq}= \frac{[FeCl_{4}^{-}]}{[FeCl_{3}][Cl^{-}]\)
Exercise 14.18.1:
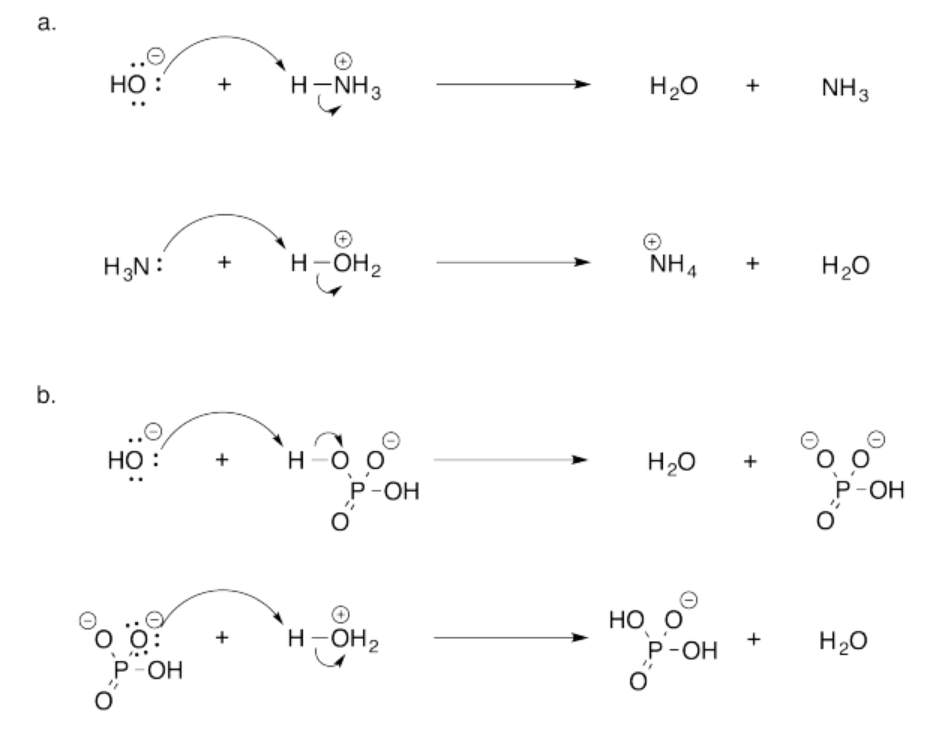
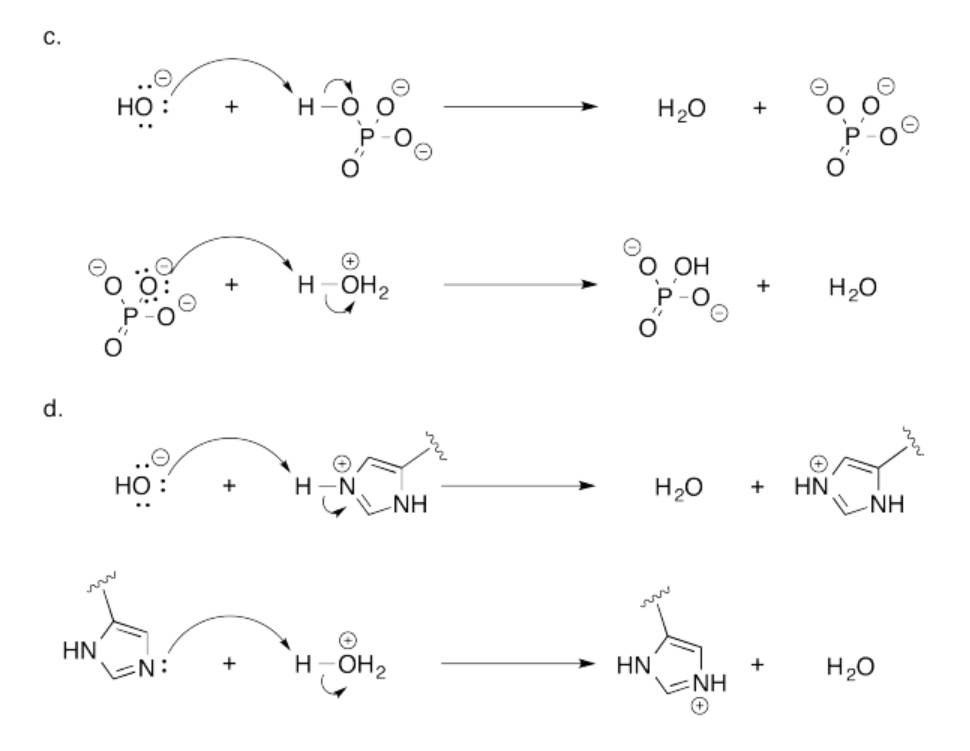
Ejercicio 14.19.1:
- todas las bases tienen pares solitarios.
- F, N y O tienen pares solitarios. Pueden ser bases.
Su orden de basicidad sería N > O > F.
Estos tres elementos provienen de la misma fila de la tabla periódica y por lo tanto son de tamaños similares. Sin embargo, N es el menos electronegativo y F es el más electronegativo. El N es más capaz de donar electrones y más capaz de soportar una carga positiva, en comparación con los otros dos.
c)
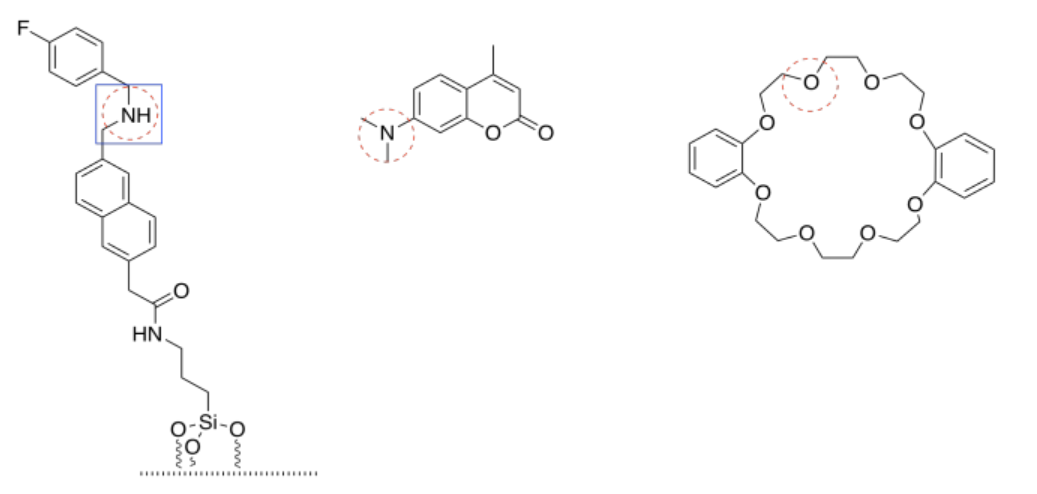
Si es posible, se hace un círculo de nitrógeno en cada molécula. La tapa solo tiene átomos de oxígeno básicos. Si hay una elección entre dos nitrógenos (en la atadura) o dos oxígenos (en la tapa), el par solitario no conjugado sería el más básico. Los pares solitarios conjugados se mantienen en su lugar por su interacción estable con sus vecinos.
El más básico de todos es el nitrógeno amínico (no conjugado) en el amarre.
d)
e) La tapa y el amarre estarían unidos por enlaces de hidrógeno. Sin embargo, los enlaces de hidrógeno se vuelven mucho más fuertes si hay un componente iónico. No es un enlace iónico completo porque la tapa no contiene un anión, pero su fuerza está entre la de un enlace de hidrógeno normal y un enlace iónico.
f) El hacinamiento estérico atrapa el tinte entre la tapa de arriba y la superficie de sílice debajo. El tinte es demasiado grande para exprimirse más allá de la tapa.
g) El tinte ha sido liberado, y ahora está en el agua.
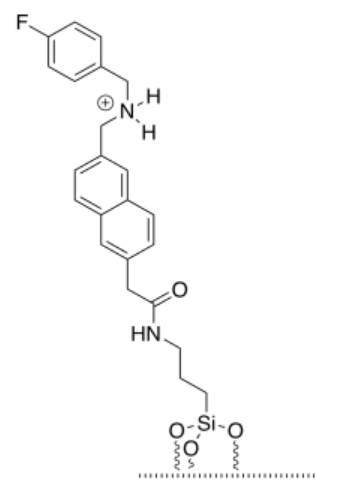
h) Existe un equilibrio entre el amarre protonado y la trietilamina protonada.
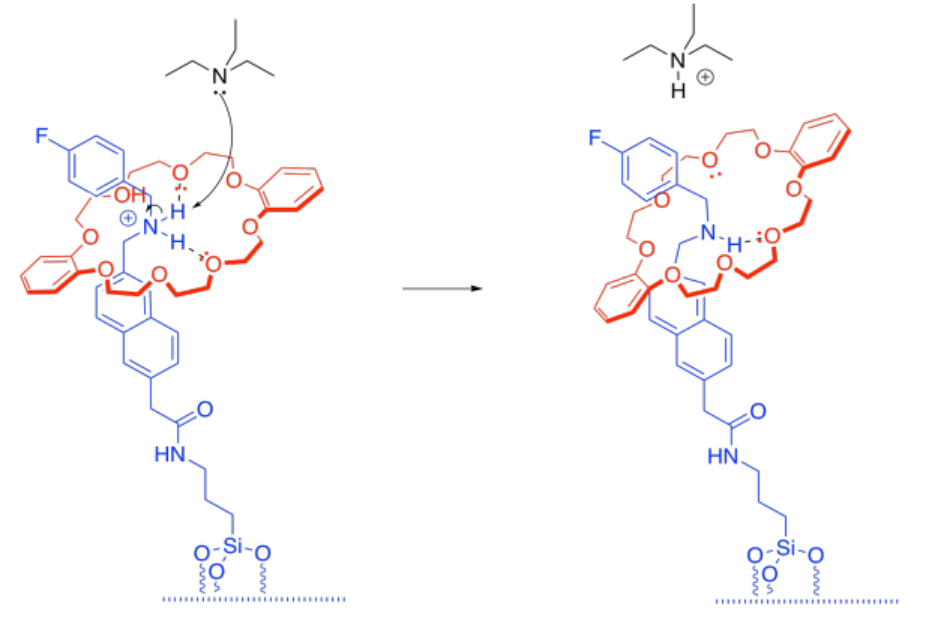
i) Una vez que el amarre ha sido desprotonado, la interacción tether-cap es solo un enlace de hidrógeno normal. Sigue siendo fuerte, pero no tan fuerte como el enlace de hidrógeno potenciado por iones que teníamos antes.
j) N, N-diisopropiletilamina o base de Hunig:
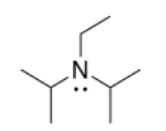
k) El par solitario en la base de Hunig está mucho más abarrotado que el de trietilamina, por lo que no puede quitar el protón tan rápido.
Ejercicio 14.19.2:
a)
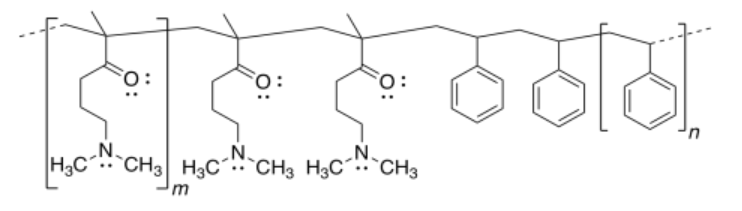
b)
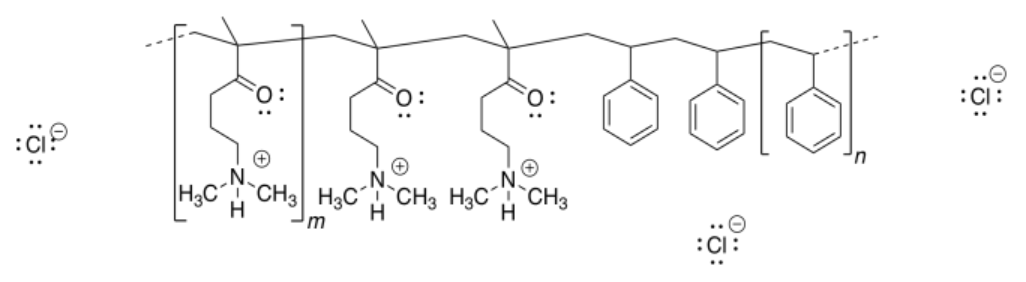
c)
d) La repulsión entre los grupos amonio cuaternario cargados positivamente (poli-CH 2-N (H) (CH 3) 2 +) provocaría que la nanopartícula se desenrolle.
e)
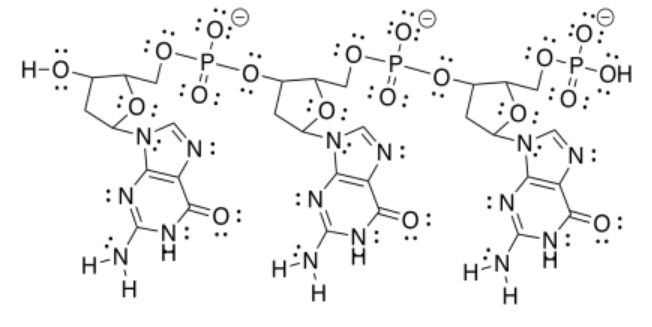
f)
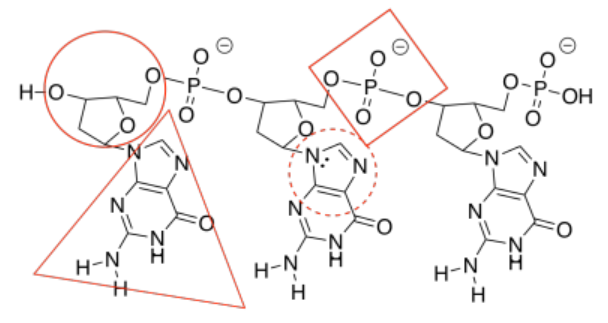
g)
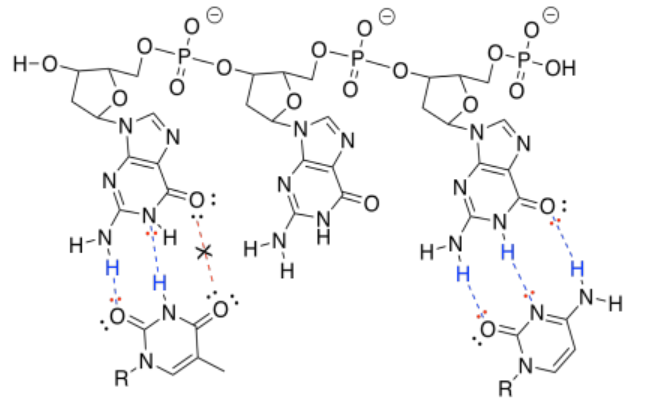
h) El de la derecha forma tres enlaces de hidrógeno con el ADN y se une más fuertemente que el de la izquierda, que forma solo dos enlaces de hidrógeno con el ADN.
i) El polímero se carga positivamente después del tratamiento ácido. Se une al ADN cargado negativamente a través de interacciones ión-ion.
j) Si hay suficientes de ellos, los aniones cloruro podrían “lavar” el ADN aniónico. Estos aniones individuales reemplazarían al anión de ADN previamente unido a la nanopartícula.
k) La trietilamina podría eliminar el protón de la cadena polimérica. Si la cadena polimérica ya no estuviera cargada, ya no se uniría al ADN aniónico.
l) Además, debido a que las nanopartículas ya no se cargarían, ya no habría fuerzas repulsivas que provocarían que el polímero se desenrolle.
m)
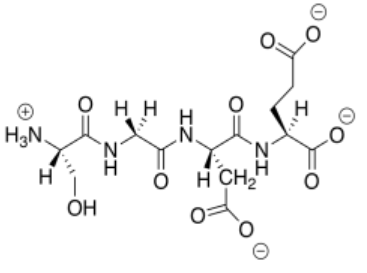
n) Este péptido aniónico (global) se uniría a las nanopartículas catiónicas, reemplazando al ADN.
o)
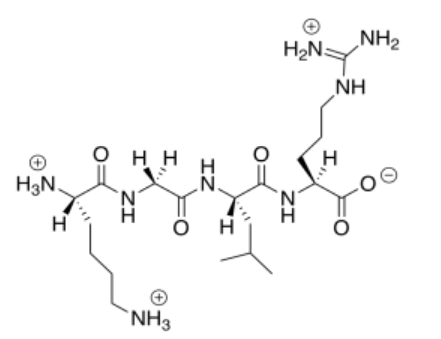
Este péptido catiónico (global) no se uniría a las nanopartículas catiónicas, por lo que no desplazaría al ADN.
Ejercicio 14.19.4:
a)
b)
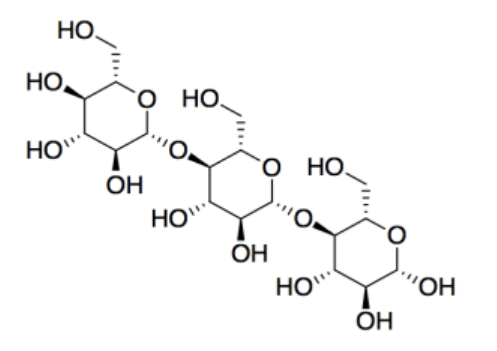
c) carbohidratos
d) La celulosa es el componente principal del algodón (textiles y dinero) y del papel.
e)
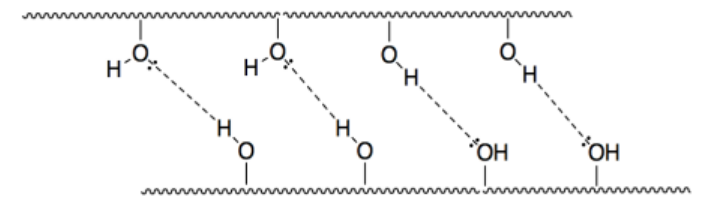
f) éster
g)
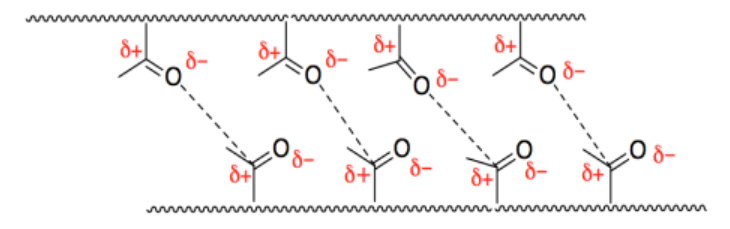
h) La temperatura corporal está más cerca de 40% grados; C, por lo que la cadera sería suave y gomosa. Eso haría que caminar fuera un poco impredecible.
i)
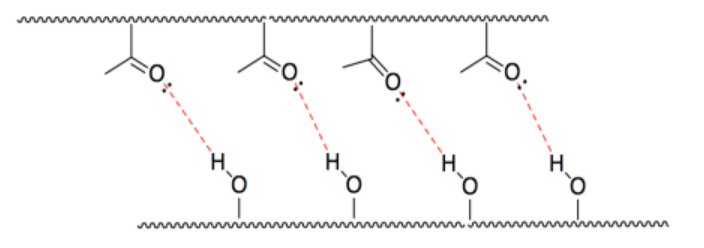
j) El HCl es ácido porque el enlace H-Cl está polarizado con electrones más cercanos a Cl.
k) El NaOH es básico porque el enlace Na-O está más polarizado, con electrones más cercanos a O.
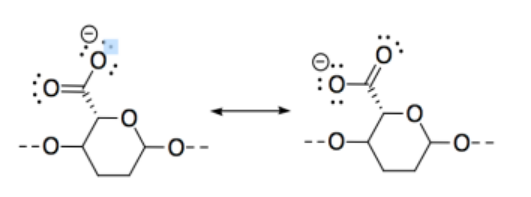
l) CNC-CO 2 H es más ácido debido al anión estabilizado por resonancia en la base conjugada.
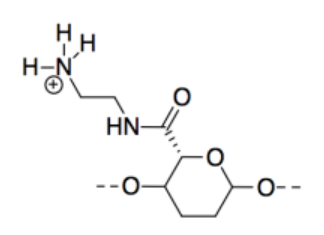
m) CNC-NH 2 es lo más básico porque, aunque los tres compuestos poseen pares solitarios, el par solitario en el nitrógeno está en un átomo menos electronegativo que los pares solitarios en oxígenos, por lo que se dona más fácilmente a un protón.
n) Esta puede parecer contraintuitiva. Las fuerzas intermoleculares a pH 11 son iónicas, las cuales deben ser más fuertes que los enlaces de hidrógeno. Sin embargo, las interacciones entre dos cadenas aniónicas son repulsivas, lo que disminuiría la atracción entre cadenas CNC vecinas.
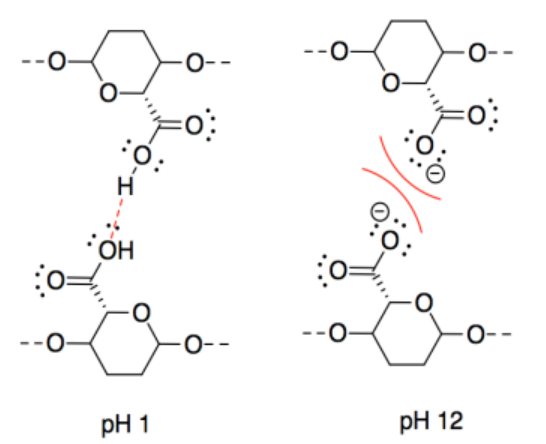
o) Las fuerzas intermoleculares a pH 3 son iónicas, las cuales deben ser más fuertes que los enlaces de hidrógeno. Sin embargo, las interacciones entre dos cadenas catiónicas son repulsivas, lo que disminuiría la atracción entre cadenas CNC vecinas.
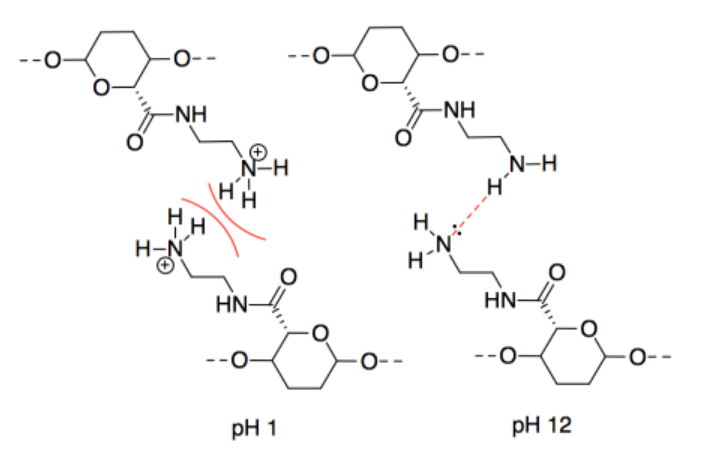
p) Un protón se transferiría del sitio ácido al sitio básico. Las cadenas CNC con carga de oposición se atraerían fuertemente entre sí.