14.19: Problemas de aplicación
- Page ID
- 80607
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Ejercicio\(\PageIndex{1}\)
Fraser Stoddart (Northwestern University) compartió el Premio Nobel de Química 2016 por el desarrollo de “máquinas moleculares”. Aquí se muestran los componentes de una válvula molecular simple. (Adaptado con permiso de Nguyen, T. D.; Leung, K. C.-F.; Liong, M.; Pentecostés, C. D.; Stoddart, J. F.; Zink, J. I. Org. A lett. 2006, 8, 3363-3366. Copyright 2006 American Chemical Society).
a) ¿Qué característica estructural tienen en común todas las bases?
b) Qué átomos en las moléculas que se muestran a continuación podrían ser potencialmente básicos: F C N O Si H
Ordena estos átomos básicos de los más básicos a los menos básicos.
Explique el motivo de esta orden.

c) Circular el sitio más básico en cada una de las tres moléculas (una en la atadura, una en el tinte, otra en la tapa).
Box el sitio más básico de todos.
Exponer la razón de su basicidad superior.
d) Modificar el dibujo anterior para mostrar ese sitio en su estado protonado.
El atador está unido a una superficie de sílice. Cuando el sistema está protonado, la tapa permanece unida a la correa (abajo, izquierda).

e) ¿Qué fuerza intermolecular une la tapa y la atadura?
f) ¿Por qué queda atrapado el tinte?
Cuando se colocan en agua, las nanopartículas permanecen de color amarillo brillante y el agua permanece incolora. Si se agrega trietilamina, las nanopartículas se vuelven blancas y el agua se vuelve amarilla.
g) Después de agregar trietilamina, ¿dónde está el tinte?
h) Dibujar trietilamina.
Mostrar, con flechas curvas, lo que le hace la trietilamina a la válvula molecular. No necesitas todas las estructuras; puedes abreviar solo a la parte que estás usando.
i) Indicar cualquier cambio en las fuerzas intermoleculares después de la adición de trietilamina.
La N, N-Diisopropiletilamina también puede liberar el tinte, pero más lentamente. La trietilamina provoca que el colorante se libere con una semivida de 100 segundos; la vida media para la liberación con N, N-diisopropiletilamina es de 300 segundos.
j) Dibujar N, N-diisopropiletilamina.
k) ¿Por qué la liberación es mucho más lenta con N, N-diisopropiletilamina?
Este sistema tiene el potencial de ser utilizado en una serie de aplicaciones, como la administración de fármacos: la liberación lenta de productos farmacéuticos en el torrente sanguíneo a partir de nanopartículas de sílice.
Si es posible, se hace un círculo de nitrógeno en cada molécula. La tapa solo tiene átomos de oxígeno básicos. Si hay una elección entre dos nitrógenos (en la atadura) o dos oxígenos (en la tapa), el par solitario no conjugado sería el más básico. Los pares solitarios conjugados se mantienen en su lugar por su interacción estable con sus vecinos.
El más básico de todos es el nitrógeno amínico (no conjugado) en el amarre.
- Contestar a
-
todas las bases tienen pares solitarios.
- Respuesta b
-
F, N y O tienen pares solitarios. Pueden ser bases.
Su orden de basicidad sería N > O > F.
Estos tres elementos provienen de la misma fila de la tabla periódica y por lo tanto son de tamaños similares. Sin embargo, N es el menos electronegativo y F es el más electronegativo. El N es más capaz de donar electrones y más capaz de soportar una carga positiva, en comparación con los otros dos.
- Respuesta c

- Respuesta d
-

- Respuesta e
-
La tapa y el amarre estarían unidos por enlaces de hidrógeno. Sin embargo, los enlaces de hidrógeno se vuelven mucho más fuertes si hay un componente iónico. No es un enlace iónico completo porque la tapa no contiene un anión, pero su fuerza está entre la de un enlace de hidrógeno normal y un enlace iónico.
- Respuesta f
-
El hacinamiento estérico atrapa el tinte entre la tapa de arriba y la superficie de sílice debajo. El tinte es demasiado grande para exprimirse más allá de la tapa.
- Respuesta g
-
El tinte ha sido liberado, y ahora está en el agua.
- Respuesta h
-
Existe un equilibrio entre el amarre protonado y la trietilamina protonada.

- Contestar i
-
Una vez que el amarre ha sido desprotonado, la interacción tether-cap es solo un enlace de hidrógeno normal. Sigue siendo fuerte, pero no tan fuerte como el enlace de hidrógeno potenciado por iones que teníamos antes.
- Responder j
-
N, N-Diisopropiletilamina o base de Hunig:

- Respuesta k):
-
El par solitario en la base de Hunig está mucho más abarrotado que el de trietilamina, por lo que no puede quitar el protón tan rápido.
Ejercicio\(\PageIndex{2}\)
Los laboratorios de Teresa Reineke y Tim Lodge de la U MN colaboraron para estudiar el uso de un polímero como posible dispositivo de administración de fármacos para terapia génica (Adaptado con permiso de Laaser, J. E.; Jiang, Y.; Sprouse, D.; Reineke, T. M.; Lodge, T. P. Macromolecules 2015, 48 , 2677-2685. Copyright 2015 American Chemical Society).
Aquí hay una sección de su polímero:
- Contestar
-
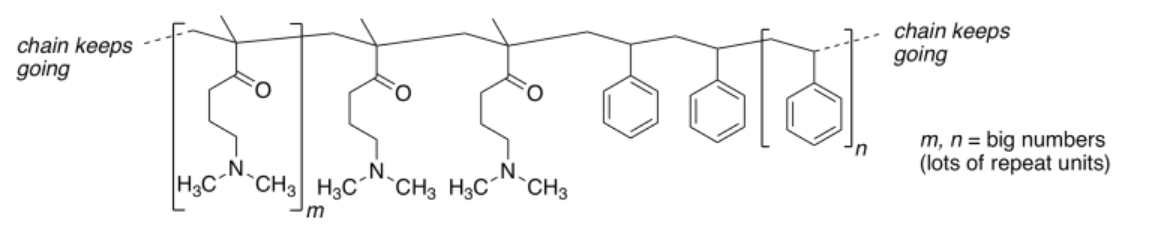
Estas cadenas poliméricas se enrollan formando nanopartículas esféricas.
a) Agregar cualquier par solitario a la estructura anterior.b) Mostrar lo que sucede con la estructura del polímero cuando se agrega HCl acuoso.
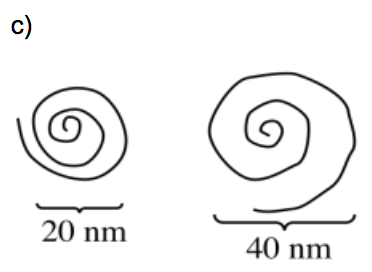
Después del tratamiento con HCl, las nanopartículas poliméricas se expanden, desde esferas con radios de aproximadamente 20 nm hasta esferas con radios de aproximadamente 40 nm.
c) Mostrar caricaturas de una larga cadena polimérica enrollada hasta formar (i) una esfera de radio 20 nm; (ii) una esfera de radio 40 nm.
d) ¿Por qué las nanopartículas se expanden cuando se agrega HCl?
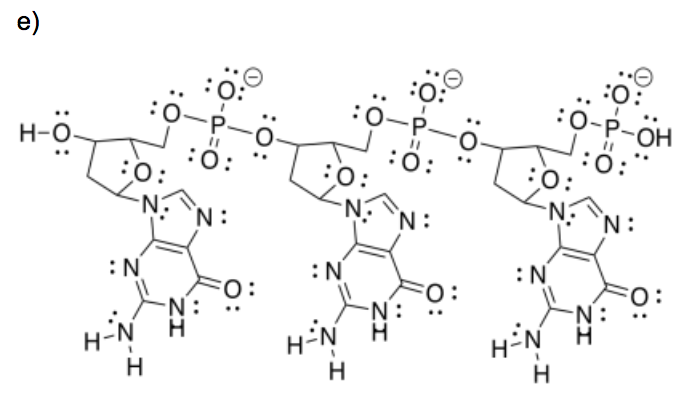
Después del tratamiento con HCl, el polímero se une a las moléculas de ADN. Aquí hay una breve sección de ADN. Cuenta con tres unidades repetitivas.

e) Agregar cualquier cargo formal.
f) Circular un azúcar. Ponga un cuadrado alrededor de un fosfato. Poner un triángulo alrededor de una base (como en “par de bases de ADN”). Poner un círculo discontinuas alrededor de un anillo aromático.
g) Mostrar cómo uno de estos otros pares de bases se une a la cadena de ADN

h) Uno de los pares de bases se une más fuertemente que el otro a la cadena de ADN. ¿Cuál? ¿Por qué?
i) ¿Por qué las nanopartículas poliméricas tratadas con ácido se unen al ADN?
Posteriormente se demostró que las soluciones salinas (como NaCl acuoso) desencadenaban la liberación de ADN de los complejos de ADN y nanopartículas.
j) ¿Por qué estas condiciones conducirían a la liberación de ADN?
Las soluciones de trietilamina ([CH 3 CH 2] 3 N) hacen que las nanopartículas se encojan y también desencadenan la liberación de ADN.
k) ¿Por qué la trietilamina inhibirá la unión al ADN?
l) ¿Por qué la trietilamina haría que las nanopartículas se encogieran?
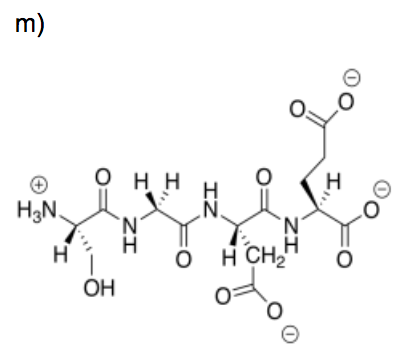
Ciertas soluciones peptídicas también desencadenan la liberación de ADN.
m) Esta no es la estructura de un péptido a pH neutro. Modificar la estructura para reflejar el pH neutro.

n) ¿Por qué este péptido desencadenaría la liberación de ADN?
o) Este péptido probablemente no desencadenaría la liberación de ADN. Modificar la estructura para mostrar por qué.

- Contestar a
-

- Respuesta b
-

- Respuesta c
-
- Respuesta d
-
La repulsión entre los grupos de amonio cuaternario cargados positivamente (poli-CH 2-N (H) (CH 3) 2 +) provocaría que la nanopartícula se desenrolla.
- Respuesta e
-
- Respuesta f
-

- Respuesta g
-

- Respuesta h
-
El de la derecha forma tres enlaces de hidrógeno con el ADN y se une más fuertemente que el de la izquierda, que forma solo dos enlaces de hidrógeno con el ADN.
- Contestar i
-
El polímero se carga positivamente después del tratamiento ácido. Se une al ADN cargado negativamente a través de interacciones ión-ion.
- Responder j
-
Si hay suficientes de ellos, los aniones cloruro podrían “lavar” el ADN aniónico. Estos aniones individuales reemplazarían al anión de ADN previamente unido a la nanopartícula.
- Responder k
-
La trietilamina podría eliminar el protón de la cadena polimérica. Si la cadena polimérica ya no estuviera cargada, ya no se uniría al ADN aniónico.
- Contesta l
-
Además, debido a que las nanopartículas ya no se cargarían, ya no habría fuerzas repulsivas que provocarían que el polímero se desenrolla.
- Contestar m
-
- Responder n
-
Este péptido aniónico (global) se uniría a las nanopartículas catiónicas, reemplazando al ADN.
- Responder o
-

Este péptido catiónico (global) no se uniría a las nanopartículas catiónicas, por lo que no desplazaría al ADN.
Ejercicio\(\PageIndex{3}\)
Las parejas frustradas de Lewis deberían reaccionar juntas pero no lo hacen. Un ejemplo de un par de Lewis frustrado es tri-t-butilfosfina, [(CH3) 3C] 3P, y tris (pentafluorofenil) borano, B (C6F5) 3.
- Dibuja ambas estructuras.
- Identificar el ácido de Lewis y la base de Lewis.
- Dibuje un mecanismo usando flecha (s) curva (s) para mostrar cómo interactuarían el ácido y la base.
- Afirma por qué no se produce esta interacción.
- Stephan & Erker demostraron que la frustrada pareja Lewis puede trabajar en conjunto para capturar una molécula de dióxido de carbono (Angewandte Chemie, 2015). Mostrar un mecanismo que explique cómo el ácido de Lewis interaccionaría con el CO 2, incluyendo flechas curvas.
Ejercicio\(\PageIndex{4}\)
Investigadores del laboratorio Rowan de la Universidad de Chicago han estado experimentando con materiales compuestos hechos de celulosa y plástico. (Adaptado de Amanda E. Way, Lorraine Hsu, Kadhiravan Shanmuganathan, Christoph Weder, y Stuart J. Rowan, ACS Macro. A lett. 2012, 1, 1001-1006. Copyright 2012, Sociedad Americana de Química. Usado con Permiso.)
La celulosa está hecha de bloques de construcción de glucosa o monómeros.
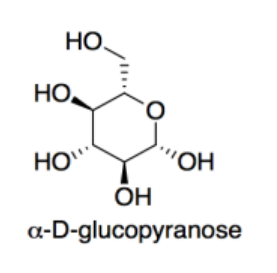
a) Mostrar la forma alfa-D-glucopiranosa de glucosa en su conformación de silla más estable.
Cuando esta forma de glucosa se une con otras moléculas a través de sus posiciones 1 y 4, con pérdida de una molécula de agua, forma celulosa, un polímero hecho de bloques de construcción de glucosa.

b) Mostrar una pequeña molécula de celulosa de 3 unidades de glucosa de largo.
c) La celulosa es un ejemplo de qué clase de biomoléculas: ¿carbohidratos/lípidos/ácidos nucleicos/proteínas?
d) Nombrar un material doméstico común que esté hecho de celulosa.
e) Dibuje una caricatura del polímero de celulosa, usando solo una línea ondulada para la cadena larga del polímero. Agrega las partes de la estructura que necesitarías para mostrar por qué dos cadenas de celulosa se pegarían entre sí. Nombra esta atracción intermolecular.
Los investigadores utilizaron poli (acetato de vinilo) (PVAc; a continuación se muestra una sección corta) como plástico en su estudio. El PVAc también es un polímero; las líneas discontinuas aquí indican que las unidades siguen repitiéndose en una cadena larga. El PVAc se utiliza principalmente en la pintura de látex.
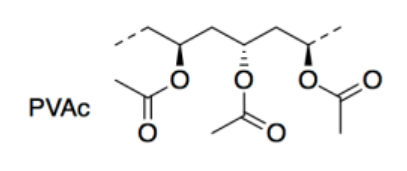
f) Nombrar el tipo de grupo funcional en PVAc.
g) Dibuje una caricatura del polímero PVAc, usando solo una línea ondulada para la cadena larga del polímero. Agrega las partes de la estructura que necesitarías para mostrar por qué dos cadenas de PVAc se pegarían entre sí. Nombra esta atracción intermolecular.
Por debajo de 35°C, el PVAc es “vítreo”, o fuerte y rígido, como el plástico en el parachoques de un automóvil. Por encima de 35°C, el PVAc se vuelve mucho más suave o “gomoso”, como una goma de borrar.
h) Explicar por qué esta propiedad impide el uso de PVAc para implantes médicos como una cadera artificial.
La mezcla de nanocristales de celulosa (CNCs) con el PVAc mantiene el material más fuerte hasta aproximadamente 45°C.
i) Mostrar por qué los CNC hacen que el PVAc sea más fuerte.
Claramente, los materiales compuestos, en los que otros materiales se mezclan con los plásticos para proporcionar una resistencia adicional, a veces pueden ser mejores que los plásticos por sí mismos.
Sin embargo, al laboratorio Rowan le interesa algo mucho más sophsticado que eso. Quieren hacer un material que pueda cambiar de gomoso a vidrioso, o viceversa, en un instante. Se inspiraron en tunicados, organismos marinos que pueden cambiar instantáneamente de cáscara suave a cáscara dura si se les molesta. Resulta que las conchas tunicadas contienen altos niveles de CNCs.
Un posible estímulo es el pH o la acidez; este factor podría cambiarse añadiendo HCl o NaOH.
j) El HCl es (ácido/básico) porque el enlace H-Cl está polarizado con electrones más cercanos a (H/Cl).
k) El NaOH es (ácido/básico) porque el enlace (Na-O/O-H) está más polarizado, con electrones más cercanos a (Na/O/H).
Modificaron los CNCs agregando diferentes grupos laterales. Aquí solo se muestra una porción de la cadena de celulosa.
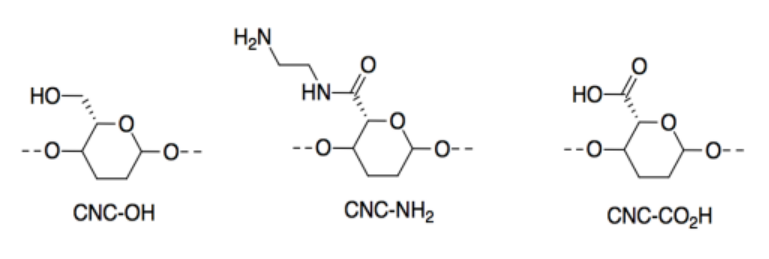
Los materiales resultantes responden a cambios en los niveles de pH o acidez; presentan acidez/basicidad de Brønsted.
l) ¿Cuál de estos tres materiales sería más ácido? Explicar por qué con una estructura de la base conjugada.
m) ¿Cuál de estos tres materiales sería el más básico? Explicar por qué con una estructura del ácido conjugado.
n) CNC-CO 2 H es más del doble de fuerte a pH 3 (es decir, cuando se agrega HCl) que a pH 11 (es decir, cuando se agrega NaOH). ¿Por qué? Explique en términos de IMF.
o) CNC-NH 2 es más del doble de fuerte a pH 11 (es decir, cuando se agrega NaOH) que a pH 3 (es decir, cuando se agrega HCl). ¿Por qué? Explique en términos de IMF.
p) A pH neutro, una mezcla de CNC-NH 2 y CNC-CO 2 H también produjo un material muy fuerte. Muestre las estructuras de los dos materiales cuando se mezclen, e identifique por qué el material es tan fuerte.
- Contestar a
-

- Respuesta b
-

- Respuesta c
-
hidratos de carbono
- Respuesta d
-
La celulosa es el componente principal del algodón (textiles y dinero) y el papel.
- Respuesta e
-
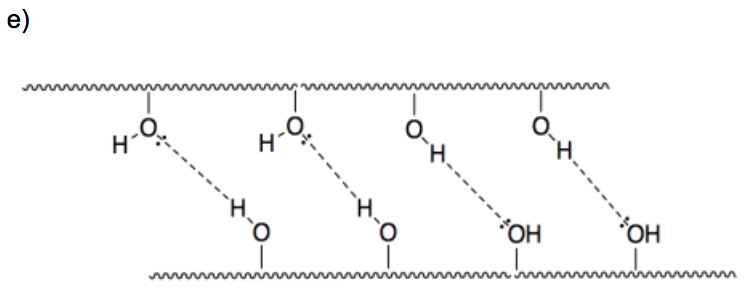
- Respuesta f
-
éster
- Respuesta g
-

- Respuesta h
-
La temperatura corporal está más cerca de los 40 grados centígrados, por lo que la cadera sería suave y gomosa. Eso haría que caminar fuera un poco impredecible.
- Contestar i
-
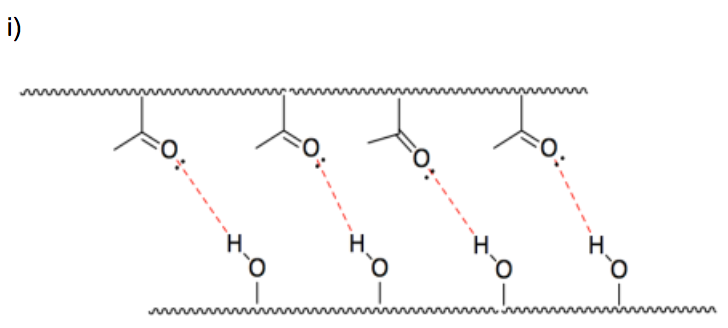
- Responder j
-
El HCl es ácido porque el enlace H-Cl está polarizado con electrones más cercanos a Cl.
- Responder k
-
El NaOH es básico porque el enlace Na-O está más polarizado, con electrones más cercanos a O.
- Contesta l
-
CNC-CO 2 H es más ácido debido al anión estabilizado por resonancia en la base conjugada.

- Contestar m
-
CNC-NH 2 es más básico porque, aunque los tres compuestos poseen pares solitarios, el par solitario en el nitrógeno está en un átomo menos electronegativo que los pares solitarios en oxígenos, por lo que se dona más fácilmente a un protón.

- Responder n
-
Este puede parecer contrario a la intuición. Las fuerzas intermoleculares a pH 11 son iónicas, las cuales deben ser más fuertes que los enlaces de hidrógeno. Sin embargo, las interacciones entre dos cadenas aniónicas son repulsivas, lo que disminuiría la atracción entre cadenas CNC vecinas.

- Responder o
-
Las fuerzas intermoleculares a pH 3 son iónicas, las cuales deben ser más fuertes que los enlaces de hidrógeno. Sin embargo, las interacciones entre dos cadenas catiónicas son repulsivas, lo que disminuiría la atracción entre las cadenas CNC vecinas.

- Responder p
-
Un protón se transferiría del sitio ácido al sitio básico. Las cadenas CNC con carga de oposición se atraerían fuertemente entre sí.


