1.3: Entropía
- Page ID
- 79544
La entropía es otro aspecto importante de la termodinámica. La entalpía tiene algo que ver con el contenido energético de un sistema o una molécula. La entropía tiene algo que ver con cómo se almacena esa energía.
A veces hablamos de la energía en un sistema como “particionada” o dividida en varios “estados”. Cómo se divide esta energía es la preocupación de la entropía.
A modo de analogía, imagina un conjunto de buzones. Es posible que tengas una pared de ellos en tu dormitorio o en tu edificio de departamentos. Los buzones son de varios tamaños diferentes: tal vez haya algunas filas de pequeñas, un par de filas de medianas y una fila de buzones grandes en la parte inferior.

En lugar de poner el correo en estas cajas, las vamos a usar para contener pequeños paquetes de energía. Más tarde, podrías sacar los paquetes de energía de tu propio buzón y usarlos para hacer un viaje al centro comercial o al gimnasio. Pero, ¿cómo llega el correo a tu buzón en primer lugar?
Los paquetes de energía no llegan a tu dormitorio molecular con direcciones en ellos. Los paquetes vienen en diferentes tamaños, porque contienen diferentes cantidades de energía, pero aparte de eso no hay información identificativa sobre ellos.
Algunos de los paquetes no caben en algunos de los buzones de correo, porque algunos de los paquetes son demasiado grandes y algunos de los buzones son más pequeños que los otros. Los paquetes de energía necesitan ir a los buzones de correo en los que encajarán.
Aún así, hay una gran cantidad de buzones en los que la mayoría de los paquetes de energía aún podrían caber. Tiene que haber algún sistema para decidir dónde poner todos estos paquetes. Resulta que, en el mundo molecular, existe tal sistema, y sigue una regla bastante simple. Cuando llega un montón de paquetes de energía, el jefe de correos hace todo lo posible para poner un paquete en cada buzón. Entonces, cuando cada buzón tiene uno, ella comienza a poner un segundo en cada caja, y así sucesivamente.
No tenía que ser así. Podría haber sido el caso de que toda la energía simplemente se pusiera en el primer par de buzones y el resto se dejara vacío. En otras palabras, la regla podría haber sido que toda la energía se debe ordenar en un mismo lugar, en lugar de esparcirse por ahí. Pero no es así como es.
- La energía siempre se divide en el número máximo de estados posibles.
La entropía es la clasificación de la energía en diferentes modos o estados. Cuando la energía se divide u ordena en estados adicionales, se dice que la entropía aumenta. Cuando la energía se agrupa en un número menor de estados, se dice que la entropía disminuye. El sesgo de la naturaleza es hacia un aumento de la entropía.
Esta es una ley fundamental del universo; no hay razón que pueda utilizarse para explicar por qué la naturaleza prefiere la alta entropía a la baja entropía. En cambio, aumentar la entropía es en sí misma la razón básica de una amplia gama de cosas que suceden en el universo.
La entropía se describe popularmente en términos de “trastorno”. Esa puede ser una idea útil, aunque en realidad no describe lo que está sucediendo enérgicamente.
Se puede construir una mejor imagen de la entropía observando cómo un grupo de moléculas podría ordenar alguna energía que se les agrega. Es decir, ¿cuáles son algunos ejemplos de “estados” en los que se puede ordenar la energía?
Si obtienes más energía —quizá desayunando— uno de los beneficios inmediatos es poder incrementar tu actividad física. Tienes más energía para moverte, para correr, para saltar. Una situación similar es cierta con las moléculas.
Las moléculas tienen una variedad de formas en las que pueden moverse, si se les da algo de energía. Pueden dar vueltas; este tipo de movimiento se suele llamar traducción. Pueden voltear y rodar; este tipo de movimiento se conoce como rotación. Además, pueden menearse, dejando que sus enlaces se hagan más y más cortos moviendo los átomos individuales alrededor un poco. Este tipo de movimiento se llama vibración.
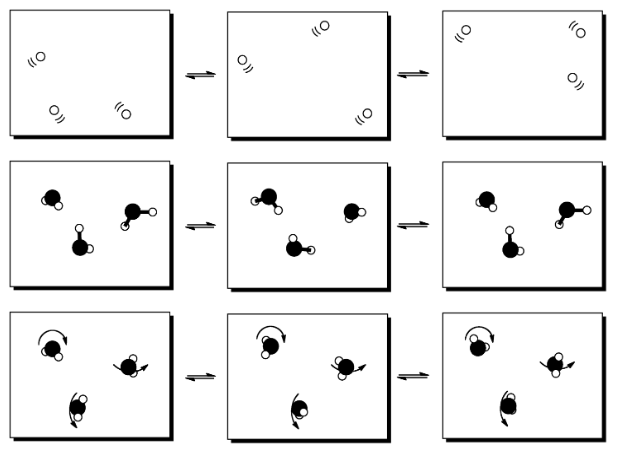
Cuando las moléculas absorben energía extra, pueden ser capaces de clasificar la energía en estados rotacionales, vibracionales y traslacionales. Esto solo funciona con paquetes de energía de cierto tamaño; otros paquetes se clasificarían en otro tipo de estados. No obstante, estos son solo algunos ejemplos de lo que queremos decir con estados.
OK, entonces la energía se almacena en estados, y se ordena en el número máximo posible de estados. Pero, ¿cómo cambia la entropía en una reacción? Sabemos que la entalpía puede cambiar al romper o formar ciertos vínculos, pero ¿cómo se vuelve a ordenar la energía?
Los cambios en la entropía interna durante una reacción suelen ser muy pequeños. Es decir, la energía que queda al final de la reacción se ordena más o menos como era antes de la reacción. Sin embargo, hay algunas excepciones muy comunes.
El caso más común en el que la entropía interna cambia mucho es cuando el número de moléculas involucradas cambia entre el inicio de la reacción y el final de la reacción. Tal vez dos moléculas reaccionen juntas para formar una, nueva molécula. Tal vez una molécula se divide para hacer dos, nuevas moléculas.
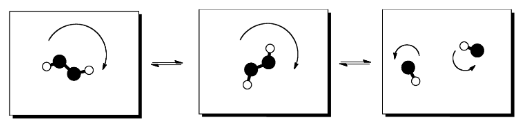
Si una molécula se divide en la reacción, la entropía generalmente aumenta. Dos moléculas pueden rotar, vibrar y trasladarse (o voltear, menear y deslizarse) independientemente una de la otra. Eso significa que el número de estados disponibles para dividir la energía aumenta cuando una molécula se divide en dos.
- La entropía generalmente aumenta cuando una reacción produce más moléculas de las que comenzó con.
- La entropía generalmente disminuye cuando una reacción produce menos moléculas de las que comenzó con.
Aparte de un factor como un cambio en el número de moléculas involucradas, los cambios de entropía interna suelen ser bastante sutiles. No son tan fáciles de predecir como los cambios de entalpía.
Sin embargo, a veces puede haber un equilibrio entre entalpía y entropía. Si una reacción divide una molécula en dos, parece probable que se involucre un aumento en la entalpía, de manera que se pueda romper el enlace que mantenía unidas las dos piezas. Eso no es favorable. Sin embargo, cuando eso sucede, acabamos de ver que habrá un aumento en la entropía, porque la energía puede entonces clasificarse en modos adicionales en las dos moléculas independientes.
Entonces tenemos dos factores diferentes para equilibrar. Hay una herramienta que solemos utilizar para decidir qué factor gana. Se llama energía libre, y la veremos a continuación.
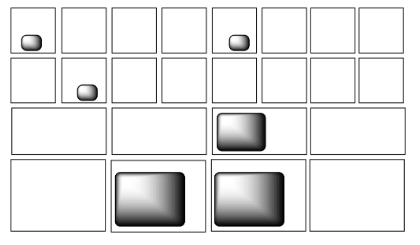
En cada uno de los siguientes pares, observe la distribución de paquetes de energía (formas grises) y decida qué sistema tiene la mayor entropía.
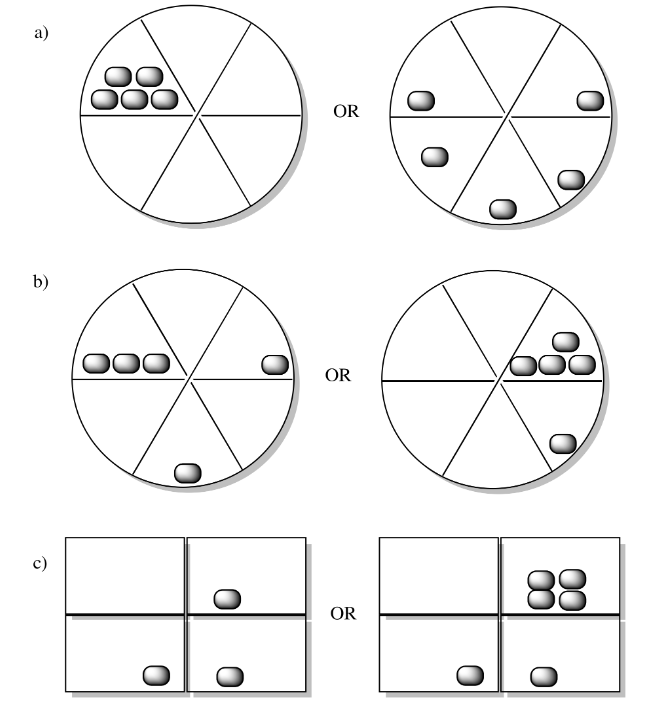
- Responder
-
La entropía es mayor si la energía se divide en más estados. Por ejemplo, en la pregunta b), la misma cantidad de energía se distribuye en tres estados del lado izquierdo y sólo dos estados a la derecha. La entropía es mayor en el ejemplo de la mano izquierda que en la derecha en ese caso.
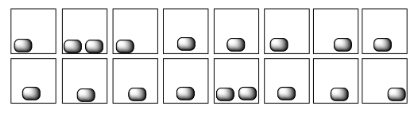
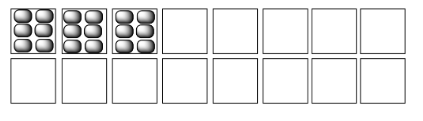
En cada uno de los siguientes pares, seleccione el sistema (i o ii) que tenga la mayor entropía.
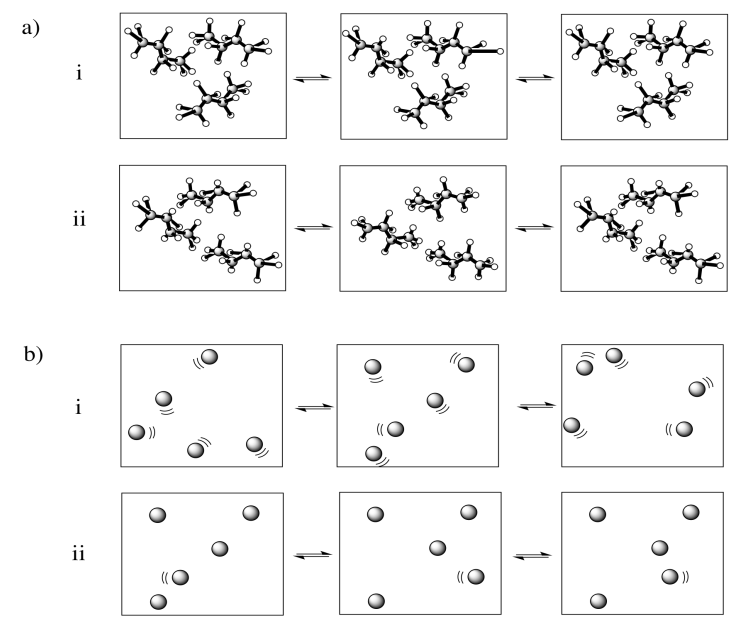
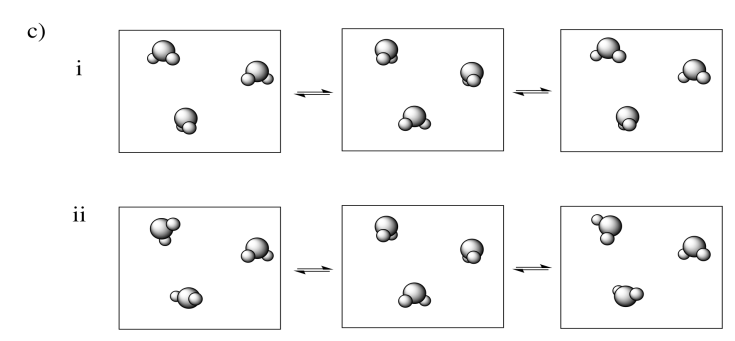
- Responder
-
Ejemplos de “estados” en los que se puede dividir la energía incluyen los estados moleculares vibracionales, rotacionales y traslacionales (que, hablando vagamente, corresponden a menear, girar y dar vueltas). La entropía es mayor si la energía se distribuye en más de estos estados. Eso podría incluir un mayor rango de estados vibracionales o rotacionales utilizados en (a) y (c), o estados similares empleados en un mayor número de moléculas en (b).
En base a lo que sabes, ¿se favorecerían entrópicamente o no las siguientes reacciones?
- La descarboxilación de una molécula del fármaco anti-Parkinson, L-DOPA, para producir una molécula de dióxido de carbono y una molécula del neurotransmisor, la dopamina.
- ¿Una molécula de nitrógeno y tres moléculas de hidrógeno reaccionan para producir dos moléculas de amoníaco?
- ¿Una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas de agua y una molécula de dióxido de carbono?
- Responder
-
Una observación general sobre la entropía interna es que aumenta si el número de moléculas aumenta durante una reacción y disminuye si el número de moléculas disminuye durante una reacción. Es solo cuestión de contar cuántas cosas de la izquierda se convierten en cuántas cosas a la derecha. Por ejemplo, en la pregunta (a), una molécula produce dos nuevas moléculas en la reacción de descarboxilación, por lo que la reacción se ve favorecida entrópicamente.

