1.4: Energía Libre
- Page ID
- 79533
La entropía y la entalpía son dos de los factores básicos de la termodinámica. La entalpía tiene algo que ver con el contenido energético de un sistema o una molécula. La entropía tiene algo que ver con cómo se almacena esa energía.
Existe un sesgo en la naturaleza hacia la disminución de la entalpía en un sistema. Las reacciones pueden ocurrir cuando la entalpía se transfiere a los alrededores.
- Se favorece una reacción si disminuye la entalpía.
También hay un sesgo en la naturaleza hacia el aumento de la entropía en un sistema. Las reacciones pueden ocurrir cuando aumenta la entropía.
- Se favorece una reacción si aumenta la entropía.
Considera la reacción de dibujos animados a continuación. Los cuadrados rojos se están convirtiendo en círculos verdes, siempre que la reacción prosiga de izquierda a derecha como se muestra.
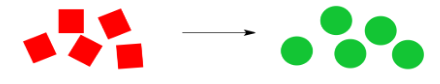
Que la reacción proceda o no a la derecha depende del equilibrio entre entalpía y entropía. Hay varias combinaciones posibles.
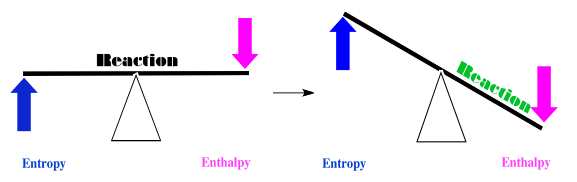
En un caso, tal vez la entropía aumenta cuando los cuadrados rojos se convierten en círculos verdes, y la entalpía disminuye. Si pensamos en el equilibrio entre estos dos factores, llegamos a una simple conlusión. Ambos factores inclinan el equilibrio de la reacción hacia la derecha. En este caso, los cuadrados rojos se convertirán en círculos verdes.
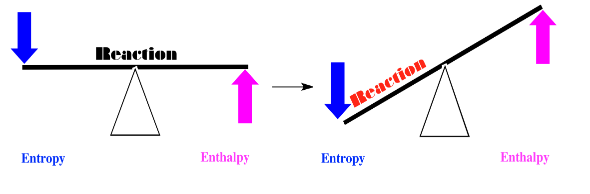
Alternativamente, tal vez la entropía disminuye cuando los cuadrados rojos se convierten en círculos verdes, y la entalpía aumenta. Si pensamos en el equilibrio entre estos dos factores, llegamos a otra simple conlusión. Ambos factores inclinan el equilibrio de la reacción hacia la izquierda. En este caso, los cuadrados rojos permanecerán tal como están.
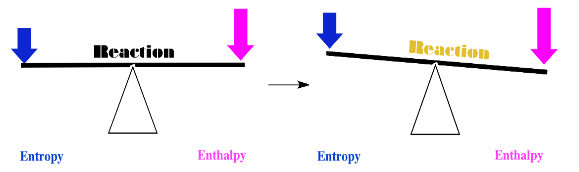
Tener dos factores puede llevar a complicaciones. Por ejemplo, ¿y si la entalpía disminuye, pero también la entropía? ¿Ocurre la reacción, o no?
En ese caso, es posible que necesitemos una cuantificación para tomar una decisión. ¿Cuánto disminuye la entalpía? ¿Cuánto disminuye la entropía? Si el efecto de la disminución de entalpía es mayor que el de la disminución de entropía, la reacción aún puede seguir adelante.
Los efectos combinados de la entalpía y la entropía a menudo se combinan en lo que se llama “energía libre”. La energía libre es solo una forma de hacer un seguimiento de la suma de los dos efectos. Matemáticamente, el símbolo para el cambio de entalpía interna es "ΔH” y el símbolo para el cambio de entropía interna es “ΔS”. La energía libre está simbolizada por “ΔG”, y la relación viene dada por la siguiente expresión:
\[\Delta G = \Delta H - T \Delta S \nonumber\]
(nota: eso puede parecer “? G” = “? H” - “? S” en algunos navegadores web, en lugar de ΔG = ΔH - TΔS; la? se mostrará como delta griego en Safari o Firefox)
La letra T en esta expresión representa la temperatura (en Kelvin, más que Celsius o Fahrenheit). La temperatura actúa como factor de escalado en la expresión, poniendo la entropía y entalpía en pie equivalente para que sus efectos puedan ser comparados directamente.
¿Cómo usamos la energía libre? Funciona de la misma manera que antes estábamos usando entalpía (es por eso que la energía libre tiene el mismo signo que la entalpía en la expresión matemática, mientras que la entropía tiene un signo opuesto). Si la energía libre disminuye, la reacción puede continuar. Si la energía libre aumenta, la reacción no puede continuar.
- Se favorece una reacción si disminuye la energía libre del sistema.
- No se favorece una reacción si aumenta la energía libre del sistema.
Debido a que la energía libre toma en consideración tanto los cambios de entalpía como de entropía, no tenemos que considerar nada más para decidir si ocurre la reacción. Ambos factores ya han sido tomados en cuenta.
Recordemos los términos “endotérmico” y “exotérmico” de nuestra discusión sobre entalpía. Las reacciones exotérmicas fueron favores (en las que disminuye la entalpía). Los endotérmicos no lo fueron. En términos de energía libre, decimos que se favorecen las reacciones exergónicas (en las que disminuye la energía libre). Los endergónicos (en los que aumenta la energía libre) no lo son.
Imagínese una reacción en la que los efectos de la entalpía y la entropía sean opuestos y casi igualmente equilibrados, de manera que no haya preferencia por si la reacción procede o no. Mirando la expresión de la energía libre, ¿cómo cree que cambiará la situación bajo las siguientes condiciones:
- la temperatura es muy fría (0.09 K)
- la temperatura es muy cálida (500 K)
- Contestar
-
La expresión ΔG = ΔH - TΔS incluye tanto una contribución de entalpía como una contribución de entalpía y las equilibra entre sí. Sin embargo, el efecto de la entropía se multiplica por la temperatura. Cuanto mayor sea la temperatura, mayor será la influencia de la entropía (y por tanto menor será la influencia de la entalpía). Cuanto menor sea la temperatura, menor será la influencia de la entropía (y por tanto mayor será la influencia de la entalpía).
¿Cuál de los siguientes perfiles de reacción describe las reacciones que procederán? ¿Cuáles describen reacciones que no procederán?

- Contestar
-
Ver problema Ejercicio 1.1.1
Cómo la entropía gobierna la termodinámica
A veces se dice que la entropía gobierna el universo.
Como sucede, los cambios de entalpía y entropía en una reacción están parcialmente relacionados entre sí. El motivo de esta relación es que si se agrega o libera energía del sistema, ésta tiene que dividirse en nuevos estados. Por lo tanto, un cambio de entalpía también puede tener un efecto sobre la entropía.
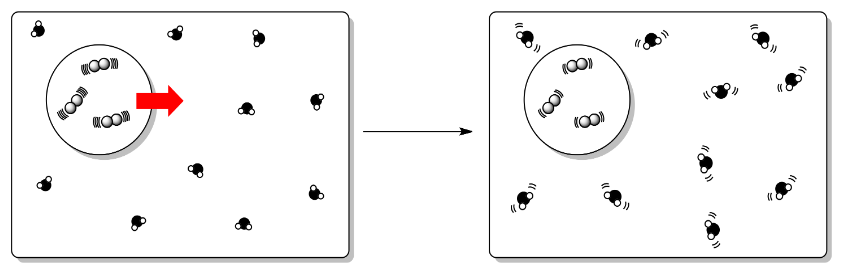
Específicamente, el cambio de entalpía interna que discutimos anteriormente tiene un efecto en la entropía del entorno. Hasta el momento, acabamos de considerar los cambios de entropía interna.
- En una reacción exotérmica, aumenta la entropía externa (entropía del entorno).
- En una reacción endotérmica, la entropía externa (entropía del entorno) disminuye.
La energía libre toma en cuenta tanto la entropía del sistema como los cambios de entropía que surgen por el intercambio de calor con el entorno. Juntos, el sistema y los alrededores se llaman “el universo”. Eso es porque el sistema es simplemente todo lo que está involucrado en la reacción, y los alrededores son todo lo que no está involucrado en la reacción.
Los cambios de entalpía en el sistema conducen a una partición adicional de la energía. Podríamos visualizar eso con la analogía del buzón que usamos para la entropía antes. En este caso, cada molécula tiene su propio conjunto de buzones, en los que ordena la energía entrante.
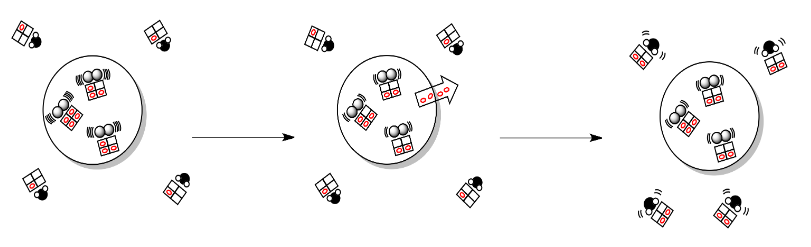
Mirada de esta manera, la termodinámica se reduce a una consideración importante, y esa es la entropía combinada tanto del sistema como de su entorno (conocidos juntos como el universo).
- Para que una reacción proceda, la entropía del universo debe aumentar.

