1.7: Equilibrio y pKa
- Page ID
- 79559
Las reacciones de transferencia de protones son muy comunes. Es útil saber si es probable que un protón sea transferido de una posición a otra. Los investigadores han trabajado muy duro para elaborar información que les dé una idea de ese problema. Los datos resultantes a menudo se compilan en una tabla pKa, como la siguiente.
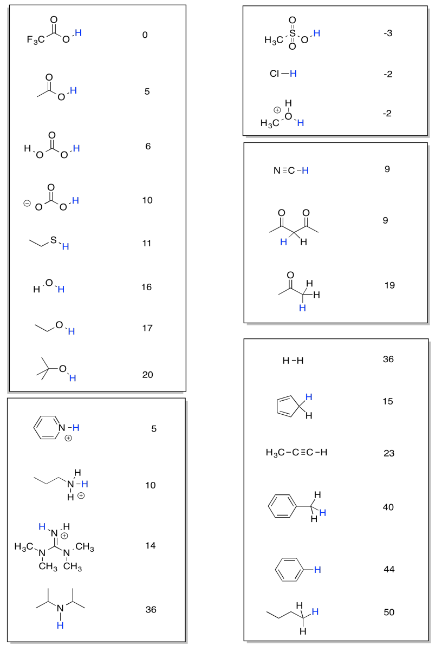
La tabla se organiza en columnas de compuestos. En cada compuesto, hay un hidrógeno coloreado en azul. El valor pK a listado junto al compuesto es un índice de la fuerza que mantiene el hidrógeno por el compuesto. Cuanto más grande es el pK a, más apretado se sostiene ese protón.
- Un pK a bajo significa que el protón se cede fácilmente. El compuesto es muy ácido.
- Un alto pK a significa que el protón se mantiene muy apretado. El compuesto no es muy ácido.
Por ejemplo, el ácido metanosulfónico, CH 3 SO 3 H, es bastante ácido. Tiene un pK a bajo. En esta tabla, su pK a aproximado se enumera como -3. ¿Qué significa eso exactamente? Bueno, la constante de equilibrio para la ionización de cualquier compuesto es de 10 -pKa. La constante de equilibrio para la ionización del ácido metanosulfónico es 10 3, o 1000. Esa es la constante de equilibrio para la reacción:
CH 3 SO 2 O-H = CH 3 SO 2 O - + H +
Por supuesto, es posible que ya sepas que un protón no es probable que deambular por sí solo. Normalmente está ligado a una pareja solitaria. En algunos estudios, el par solitario está en una molécula de agua. Entonces la reacción realmente se vería así:
CH 3 SO 2 O-H + H 2 O = CH 3 SO 2 O - + H 3 O +
En otros estudios, el par solitario está en otra molécula solvente, como DMSO, (CH 3) 2 SO. Entonces la reacción realmente se vería así:
CH 3 SO 2 O-H + (CH 3) 2 SO = CH 3 SO 2 O - + (CH 3) 2 SOH +
El valor real del pK a varía dependiendo de las condiciones de la medición. Por ejemplo, un pK a medido en agua es un poco diferente de un pK a medido en DMSO, pero las tendencias son generalmente las mismas.
Podemos usar el pK una tabla para comparar la acidez de diferentes compuestos. El ácido metanosulfónico es mucho, mucho más ácido que el butano, CH 3 CH 2 CH 2 CH 3, que tiene un pK a de aproximadamente 50. Además, podemos usar la tabla para predecir la dirección de una reacción, o el equilibrio de una reacción. Si se está transfiriendo un protón de una posición a otra, una comparación de los valores de pKa nos dirá si la reacción procederá o no.
Por ejemplo, considere la transferencia de un protón de etano tiol, CH 3 CH 2 SH, a piridina, C 5 H 5 N (parece un benceno con un carbono reemplazado por un nitrógeno). El pK a del etanotiol es 11. Si la piridina acepta el protón, formará un ion piridinio, C 5 H 5 NH +, con un pK a de 5. Cualitativamente, ya podemos predecir que la reacción no procederá tan bien. El etanotiol tiene un pK a mayor que el ion piridinio, por lo que mantendrá su protón, no lo regalará. Sin embargo, la diferencia entre los números no es tan grande. Tal vez habrá un equilibrio medible, es decir, un equilibrio en el que haya cantidades medibles tanto de productos como de reactivos.
Se puede demostrar que la constante de equilibrio para una reacción de transferencia de protones es K = 10 (pKA2-pKa1), en la que pK a 2 es el pK a del ácido en el lado del producto y pK a es el pK a del ácido en el lado reactivo. El ácido es simplemente la especie de cada lado que podría renunciar a su protón.
En este caso,
K = 10 (5-11) = 10 -6.
La constante de equilibrio se define realmente como la relación entre las concentraciones del producto y las concentraciones de los reactivos.
\[K = \frac{[products]}{[reactants]} \nonumber\]
K = [productos]/[reactivos]
En este caso,
\[K= \frac{[CH_{3}CH_{2}S^{-}][C_{5}H_{5}NH^{+}]}{[CH_{3}CH_{2}SH][C_{5}H_{5}N]} \nonumber\]
Tenemos dos números multiplicados juntos en el numerador y dos números multiplicados juntos en el denominador. Cada vez que un etanotiol y una piridina reaccionan juntos y transfieren un protón, obtendremos un anión tiolato y un catión piridinio. En un caso sencillo, podemos pensar en un número igual de aniones tiolato y cationes piridinio que se forman (ya que el mismo protón pasó de uno a otro).
Entonces la constante de equilibrio tiene una forma un poco más simple:
\[K= \frac{x^{2}}{y^{2}} \nonumber\]
en el que x = la concentración del tiolato o del piridinio e y = la concentración del tiol o de la piridina.
En ese caso, la relación de productos a reactivos, x/y, es igual a la raíz cuadrada de la constante de equilibrio. En este caso, la relación es la raíz cuadrada de 0.000001. Por lo que la relación de los productos a los reactivos es de 0.001.
a) Predecir la constante de equilibrio para la reacción de pentano-2,4-diona, CH 3 COCH 2 COCH 3, con terc-butóxido de sodio, NaOC (CH 3) 3.
- Contestar
-
K = 10 20-9 = 10 11
La mesa se puede utilizar a menudo aunque no veas el compuesto que estás buscando. A menudo, puedes ver algo que se parece bastante a lo que te interesa y puedes estimar el pK a que necesitas.
a) Predecir la constante de equilibrio para la reacción de 2-pentanona, CH 3 CH 2 COCH 2 CH 3, con metóxido de sodio, NaOCh 3.
- Contestar
-
K = 10 17-19 = 10 -2
Tenga en cuenta que este pK una mesa está organizada de manera que tipos similares de estructuras se colocan juntas en una caja. Se supone que ese arreglo te facilitará la búsqueda de tendencias y entender qué tipo de factores hacen que un protón se sujete más firmemente o se libere más fácilmente.
- Compara un par de compuestos en la caja de compuestos nitrogenados y explica por qué uno tiene un pKa mayor que el otro.
- Compara un par de compuestos en la caja de hidrocarburos y explica por qué uno tiene un pKa mayor que el otro.
- Compara un par de compuestos en la caja de compuestos que contienen O-H y explica por qué uno tiene un pKa mayor que el otro.

