3.4: Activación de Carbonilos
- Page ID
- 79403
Un tema secundario en la química del carbonilo se centra en el papel desempeñado por los pares solitarios de oxígeno. Un compuesto con pares solitarios puede actuar como una base de Lewis. ¿Pueden los compuestos carbonílicos actuar también como bases de Lewis? La respuesta es sí, aunque lo más importante es pensar en los carbonilos principalmente como ácidos de Lewis.
Una de las razones por las que importa la basicidad del par solitario es por la activación del carbonilo. Si un carbonilo dona un par solitario a un ácido de Lewis, formando un enlace, el carbonilo obtiene una carga positiva formal. Si el carbonilo tiene una carga positiva formal, atrae electrones con mayor fuerza. En ese caso, los nucleófilos reaccionan más fácilmente con el carbonilo. Se dice que el carbonilo está activado.
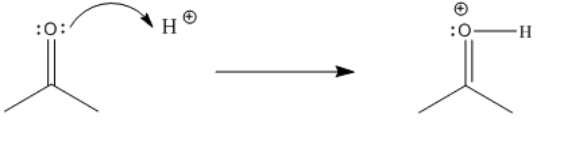
Un carbonilo puede activarse mediante la adición de un donante de protones, tal como HCl u otros ácidos comunes.
- Un carbonilo activado tiene una carga positiva.
- Los carbonilos se activan donando un par solitario a un ácido de Lewis (también llamado electrófilo).
- Una vez activados, los carbonilos se vuelven más reactivos.
- Los carbonilos activados atraen a los nucleófilos con mayor fuerza.
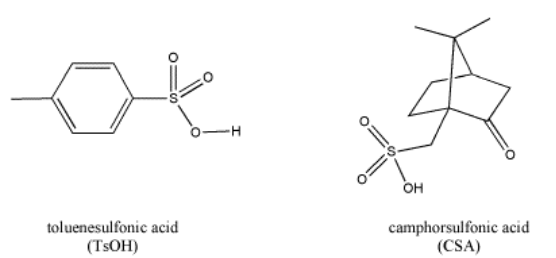
Los ácidos minerales más comunes se utilizan como soluciones acuosas (el conocido HCl, H 2 SO 4, HNO 3, H 3 PO 4 y así sucesivamente). El ácido sólo se encuentra en presencia de agua. Muchos de ellos son en realidad hidratos; si tomas ácido sulfúrico, H 2 SO 4, y lo pones a hervir en una placa calefactora, eventualmente vuelve a convertirse en trióxido de azufre, SO 3, a medida que el agua hierve y aparece una niebla sobre el vaso de precipitados. A veces, en una reacción de laboratorio, no es útil tener toda esa agua alrededor (las razones se aclararán más adelante). En su lugar, a veces se usan otros ácidos orgánicos, como el ácido canforsulfónico o el ácido toluenosulfónico; ambos son sólidos que son fáciles de ponderar y agregar a una reacción, y no agregan un montón de agua a la reacción.
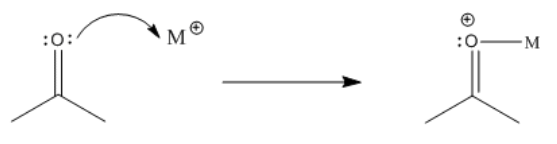
Los carbonilos también son activados por ácidos de Lewis más generales. A menudo, se utilizan sales de cloruro metálico. Estos pueden incluir metales del grupo principal, como aluminio, bismuto o indio, o metales de transición como el escandio, titanio o hierro.
Una vez que se activa el carbonilo, los nucleófilos se sienten más fuertemente atraídos por el carbono. El carbono ya era parcialmente positivo, pero con una carga positiva completa en la molécula, los electrones son atraídos con mucha más fuerza.
Es tentador donar electrones de un nucleófilo al oxígeno positivo. Sin embargo, el oxígeno ya tiene tres enlaces y un octeto. Recuerde, donar un par solitario de un nucleófilo significa que el par solitario se está convirtiendo en un enlace entre el nucleófilo y el electrófilo. Darle un par de electrones directamente al oxígeno le daría cuatro enlaces y más que un octeto— tendría 10 electrones. En cambio, la donación al carbono vecino permite que el enlace C=O pi se mueva al oxígeno y se convierta en un par solitario. La carga positiva sobre el oxígeno desaparece.
- El nucleófilo dona al carbón carbonílico activado
- Ese evento permite que el enlace pi se convierta en un par solitario en oxígeno
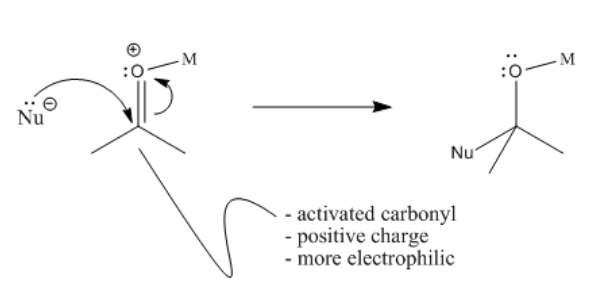
Figura\(\PageIndex{4}\): Donación de nucleófilo a un carbonilo activado.
Ejercicio\(\PageIndex{1}\)
Mostrar, con flechas, la activación de los siguientes carbonilos.
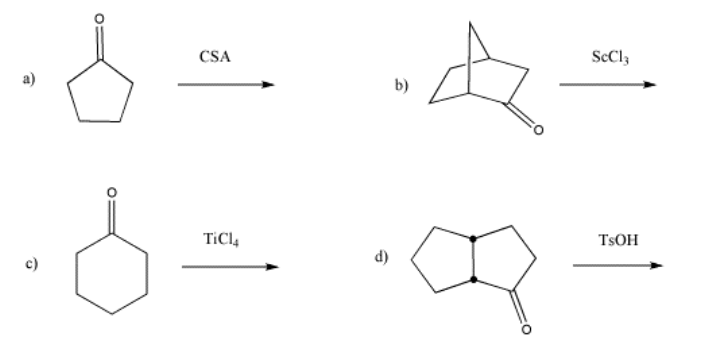
- Responder
-
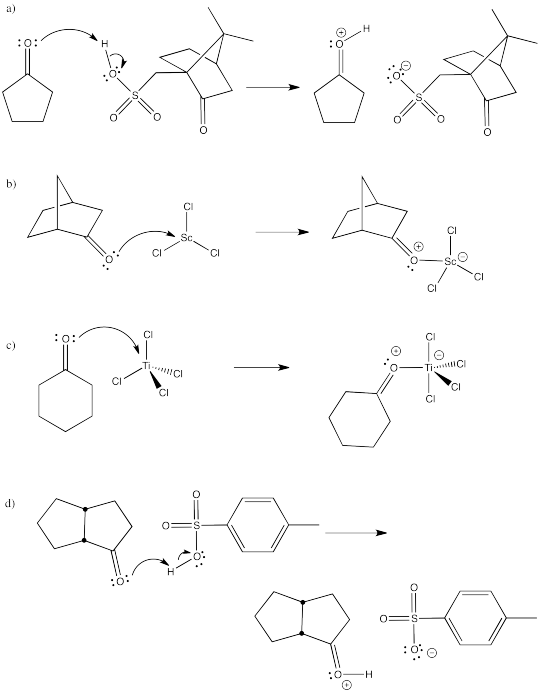
Ejercicio\(\PageIndex{2}\)
Mostrar, con flechas, la activación de los siguientes carbonilos, seguido de la donación del nucleófilo.
- Responder
-
Ejercicio\(\PageIndex{3}\)
Parte A. Utilice flechas curvas para denotar el flujo de electrones en el siguiente mecanismo para la adición Mukaiyama Aldol.
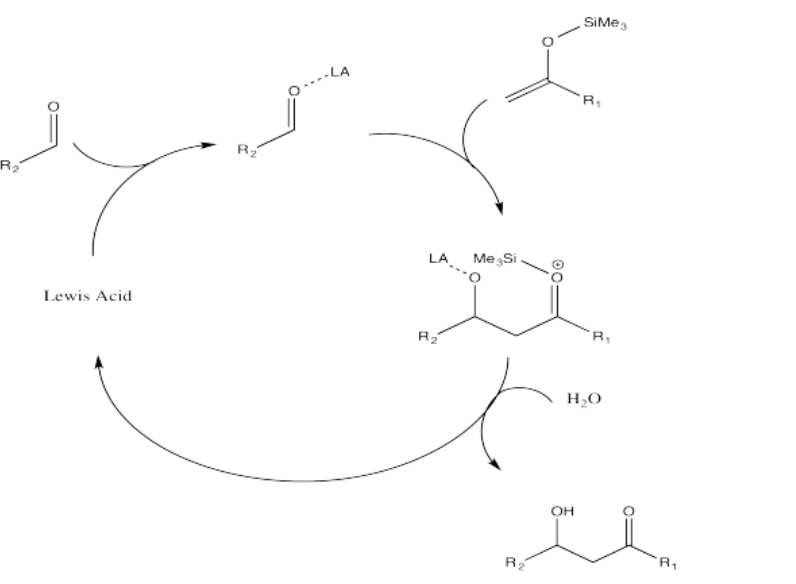
Parte b. Usando estas moléculas de partida en Mukaiyama Aldol Adición, predecir el producto formado.
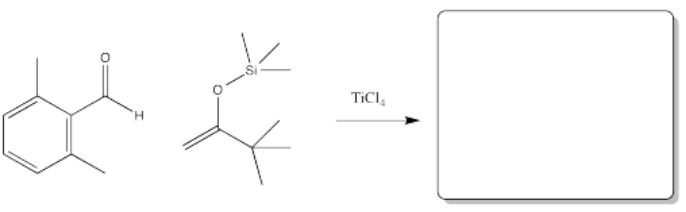
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Ejercicio\(\PageIndex{4}\)
Proporcionar estructuras Lewis-Kekule para los siguientes ácidos de uso común.
a) ácido clorhídrico, HCl b) ácido fluorhídrico, HF c) ácido bromhídrico, HBr
d) ácido nítrico, HNO 3 e) ácido perclórico, HClO 4 f) ácido fosfórico, H 3 PO 4
g) ácido fórmico, HCO 2 H h) ácido acético, CH 3 CO 2 H i) ácido benzoico, C 6 H 5 CO 2 H
j) ácido sulfúrico, H 2 SO 4 k) ácido toluenosulfónico, CH 3 C 6 H 4 SO 3 H l) ácido metanosulfónico, CH 3 SO 3 H

