3.23: Mecanismo de Reacción
- Page ID
- 79337
Gran parte del capítulo se centrará en los mecanismos de reacción. Un mecanismo de reacción es, como mínimo, la serie de etapas elementales necesarias para lograr una reacción global, y todas las estructuras intermedias que se formarían en el camino de los reactivos a los productos.
- Un mecanismo de reacción muestra las estructuras de los intermedios que ocurren después de cada etapa elemental.
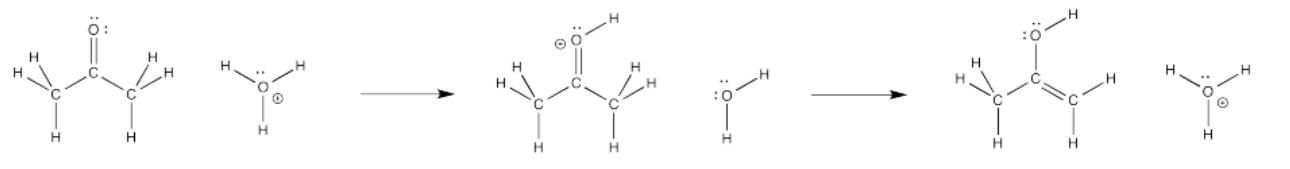
Considera la siguiente reacción. Se llama tautomerismo ceto-enol. Un tautomerismo es solo una reacción en la que, en general, un átomo de protón o hidrógeno ha cambiado de posición. La estructura de la izquierda es una cetona. La estructura de la derecha se llama enol, porque tiene un grupo hidroxilo (OH) unido directamente a un carbono alqueno (C=C). Con sólo mover un átomo de hidrógeno, pasamos de una estructura a otra.
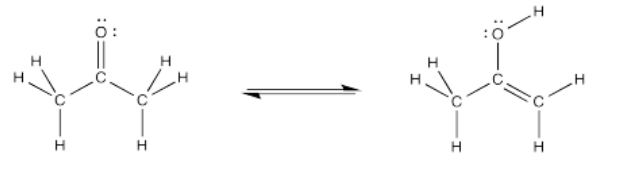
Ejercicio\(\PageIndex{1}\)
Intente dibujar la reacción anterior usando dibujos esqueléticos en lugar de estructuras completas de Lewis.
- Responder
-
Una reacción elemental es típicamente una etapa de formación de unión o una etapa de ruptura de unión. En una etapa de formación de enlaces, se donan un par de electrones de un átomo a otro. En un paso de ruptura de enlaces, un par de electrones que se compartieron entre dos átomos son atraídos a un extremo del enlace o al otro, de manera que el enlace se rompe y los electrones terminan en un solo átomo.
¿Cuáles son los pasos elementales en un tautomerismo ceto-enol? ¿Qué tipo de paradas hacemos en el camino?
Estas reacciones pueden ocurrir en realidad de un par de formas diferentes, dependiendo de si los compuestos están en condiciones ácidas o básicas. En condiciones ácidas, hay protones adicionales flotando alrededor. No son todos solos; recuerden, los protones tienden a apegarse a cosas que tienen parejas solistas para compartir.
Bajo condiciones básicas, no hay una cantidad significativa de protones adicionales alrededor. Podría haber iones hidróxido u otras especies nucleofílicas alrededor. Las especies nucleófilas son compuestos donadores de electrones que son atraídos por cargas positivas o electrófilos.
Vamos a ver esta reacción en condiciones ácidas. Si hay protones alrededor, tal vez se haya agregado algún ácido mineral, como el ácido clorhídrico o el ácido sulfúrico. Esas cosas se usan típicamente en el agua, así que asumiremos que hay algo de agua alrededor. Tenemos iones hidronio (H 3 O) + en solución. También debe haber algún contralión, pero lo ignoraremos.
Bajo esas condiciones, ¿cómo será el primer paso? Tal vez un protón se transfiere del ion hidronio al átomo de oxígeno en la cetona. Eso nos llevaría a mitad de camino. Recuerde, el tautomerismo ceto-enol implica la adición de un protón a ese oxígeno.
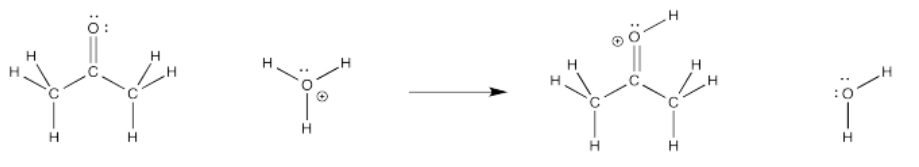
El evento de formación de enlaces involucra el oxígeno carbonilo. ¿Qué diferencias ve en ese átomo antes y después de la transferencia? Ciertamente ha aparecido un protón, y una carga positiva, pero también falta un par solitario. ¿A dónde fue?
En el ion hidronio, en tanto, ha aparecido un par solitario junto con la salida del protón. ¿De dónde vino eso?
Por supuesto, un enlace covalente es un par de electrones compartidos entre dos átomos. Si estamos haciendo y rompiendo enlaces, los electrones están jugando un papel destacado. Puede ser útil para ilustrar el papel que están desempeñando.
Muy a menudo, se utilizan flechas curvas para mostrar el camino que toman los electrones en estos pasos elementales. Estas flechas siempre se dibujan desde la fuente de los electrones hasta el lugar al que son atraídos los electrones. Estas flechas ayudan a ilustrar los pasos de creación y ruptura de enlaces y también cumplen una función de contabilidad, lo que nos ayuda a realizar un seguimiento de los electrones en el transcurso de la reacción.
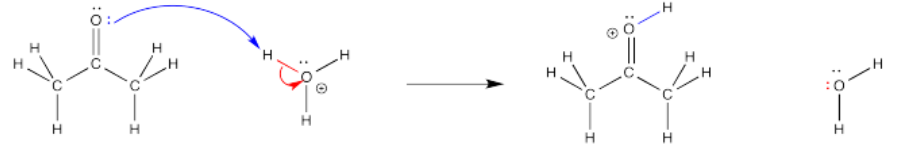
Observe que, en el paso elemental mostrado anteriormente, se forma un enlace entre el oxígeno carbonilo y uno de los protones sobre el ion hidronio (H 3 O +). Un enlace covalente es un par de electrones compartidos por dos átomos. ¿De dónde vienen los electrones para formar ese enlace? Solían ser un par solitario en el oxígeno carboyl. Se utiliza una flecha curva para mostrar eso.
Al mismo tiempo, el enlace se rompe entre ese hidrógeno y el oxígeno en el ion hidronio. ¿A dónde van esos electrones? Se convierten en un par solitario sobre el oxígeno. Otra flecha curva muestra ese evento.
Aún no hemos terminado. ¿Qué sucede después de esa transferencia inicial? Parece razonable que podríamos simplemente quitar un protón del carbono al lado del carbonilo. Esa posición, justo al lado del carbono carbonilo, se llama la posición alfa. Estamos tomando un protón que estaba unido a un carbono alfa.
¿Está bien quitarse protones y romper los lazos C-H? Sólo a veces, pero este es uno de esos casos. La eliminación de un protón de una posición alfa ocurre todo el tiempo en reacciones orgánicas y bioquímicas (aquellas que involucran moléculas basadas en carbono, y aquellas involucradas en sistemas vivos).
Rellenar flechas curvas muestra que los enlaces se han hecho o roto.
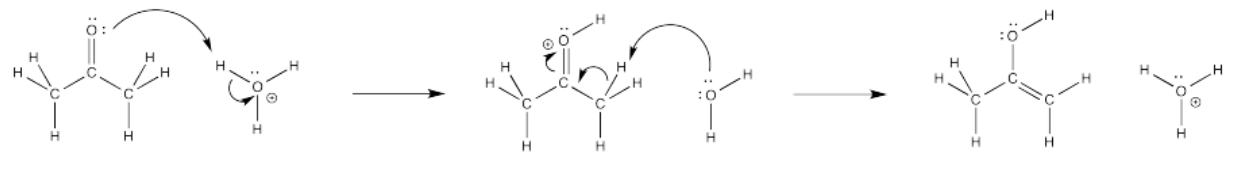
- Las flechas curvas del nucleófilo al electrófilo muestran la trayectoria de los electrones en la reacción.
- Las flechas curvas ilustran eventos de fabricación y ruptura de uniones.
En ocasiones, solo se requiere una flecha para mostrar un paso elemental, pero no siempre. A menudo, un paso de creación de bonos puede ocurrir al mismo tiempo que un paso de ruptura de enlaces. Esto suele suceder cuando un átomo no es lo suficientemente grande como para acomodar los electrones del nuevo enlace y alféizar mantener los electrones de un enlace antiguo. En este caso, dos pares de electrones se mueven en un mismo paso elemental, por lo que se muestran dos flechas curvas. Muy raro, se necesitan más de dos flechas curvas para mostrar los eventos en un paso elemental.
Es así como los químicos han pensado en las reacciones, sobre el papel, desde hace unos cien años. Siempre tratan de dibujar una secuencia de intermedios razonables a lo largo del transcurso de una reacción. Las reacciones rara vez ocurren en un solo paso, especialmente si se forman y rompen múltiples vínculos, aunque eventualmente aprenderás sobre algunos que suceden de esa manera. Por lo general, especialmente en las reacciones orgánicas y bioquímicas, se utilizan flechas curvas en un intento de trazar el movimiento de los electrones.
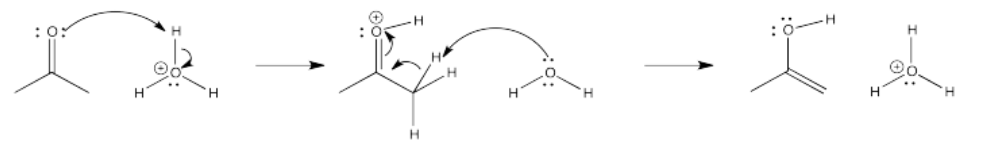
Ejercicio\(\PageIndex{2}\)
Dibuje todo el mecanismo de tauomerismo ceto-enol mostrado anteriormente usando dibujos esqueléticos en lugar de estructuras completas de Lewis. Recuerda, es importante que aún muestres los pares solitarios, para fines de contabilidad electrónica.
A veces se muestra otra información en un mecanismo de reacción. Los químicos computacionales a menudo omitirán la notación de flecha curva, pero en su lugar indicarán las diferencias de energía relativas entre todas las estructuras intermedias a lo largo de la ruta de reacción. Estas energías pueden determinarse experimentalmente (es decir, pueden basarse en la medición de reacciones reales) o pueden calcularse usando un nivel apropiado de teoría cuántica. Las energías pueden mostrarse numéricamente, posiblemente en una tabla, o pueden ilustrarse usando una imagen, tal como un perfil de reacción.
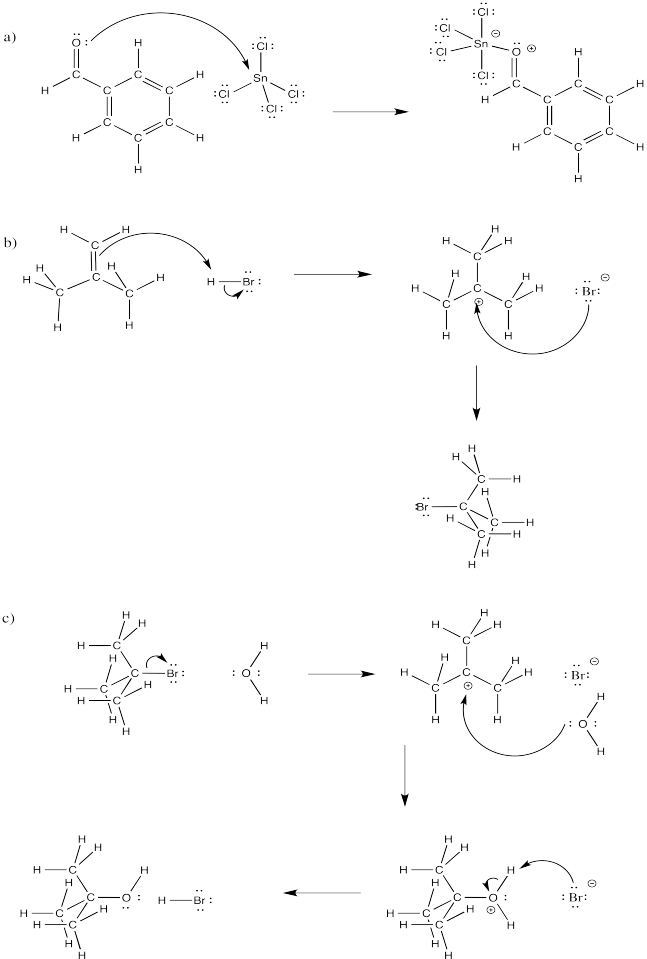
Ejercicio\(\PageIndex{3}\)
Rellene las flechas curvas en los siguientes mecanismos.
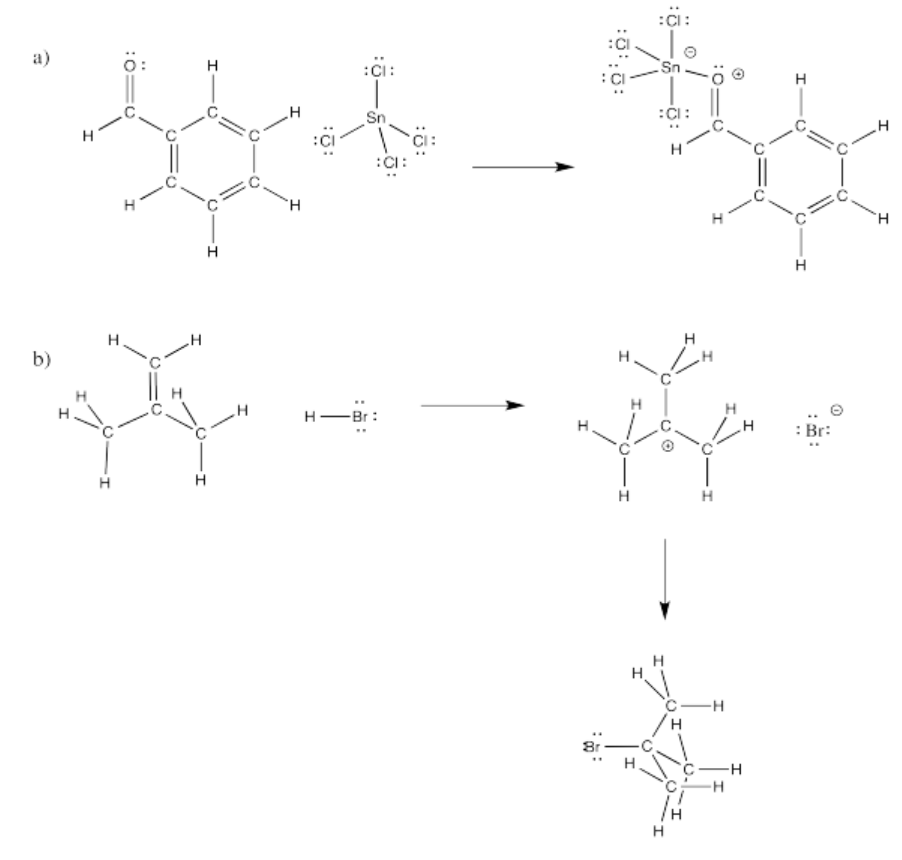
Figura\(\PageIndex{8}\):
- Responder
-
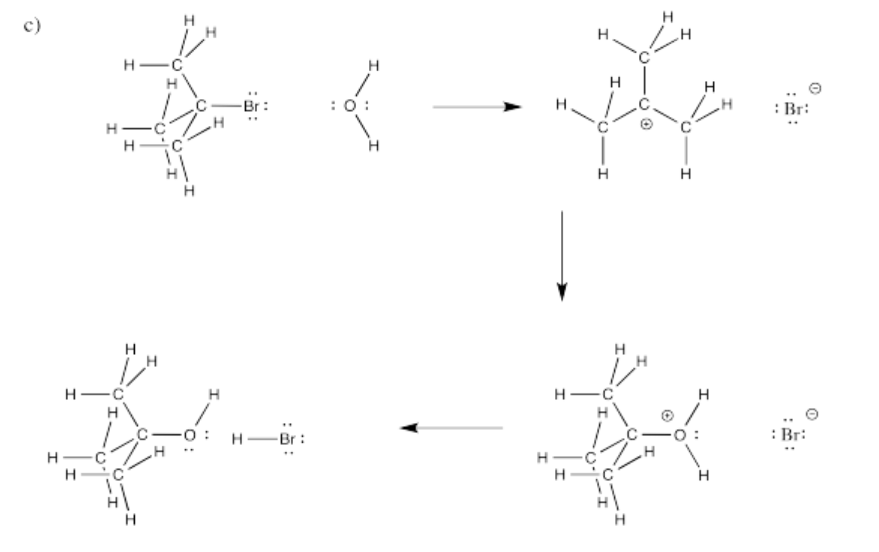
Ejercicio\(\PageIndex{4}\)
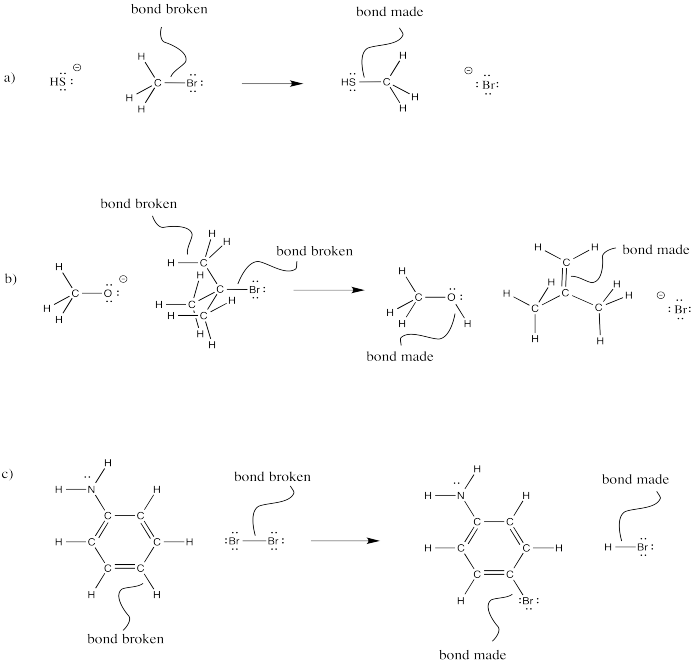
En las siguientes reacciones globales, identificar dónde se han roto los bonos y dónde se han hecho los bonos.
Figura\(\PageIndex{9}\):
- Responder
-
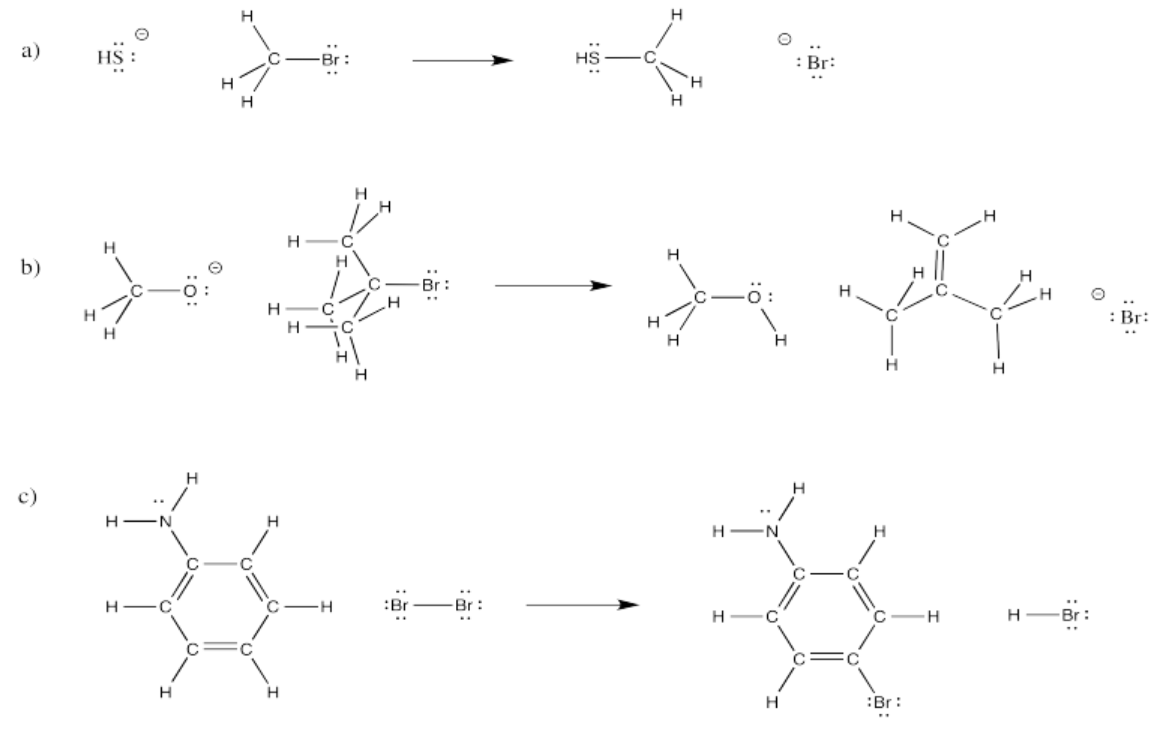
Ejercicio\(\PageIndex{5}\)
En las siguientes reacciones, átomos específicos se han trasladado a lugares específicos. Proponer mecanismos elementales para estas transformaciones.
Ejercicio\(\PageIndex{6}\)
Proponer un mecanismo, con flechas, para el tautomerismo ceto-enol anterior, pero esta vez bajo condiciones básicas. Supongamos que hay algo de hidróxido de sodio disuelto en solución acuosa.

