3.22: Patrones de reactividad general
- Page ID
- 79349
En las siguientes imágenes, se agregan varios aniones a un compuesto de carbonilo simple, una cetona (2-propanona, o acetona). En cada caso, la adición del nucleófilo va seguida de la adición de una fuente de protones. Obsérvese que, en general, la reacción implica la adición del nucleófilo al carbono carbonilo y la adición del protón al oxígeno carbonilo.
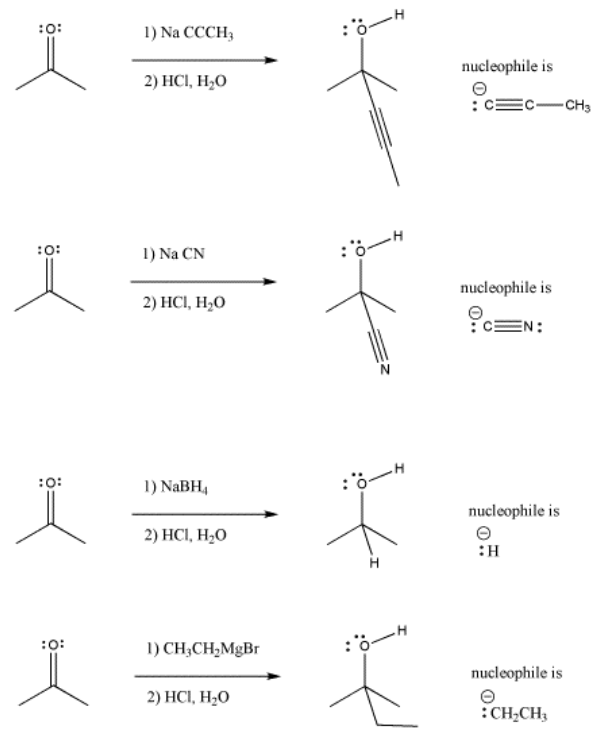
- La adición de nucleófilos aniónicos a cetonas o aldehídos transforma el carbonilo en un alcohol.
Mira la forma en que se presenta la reacción en cada caso. El material de partida orgánico (a base de carbono) se presenta en el lado izquierdo de la flecha de reacción. El reactivo agregado a este material de partida a menudo se muestra sobre la flecha. Este reactivo transforma el material de partida en otra cosa. Esa otra cosa, el producto, se muestra a la derecha de la flecha.
Muy a menudo, el disolvente para la reacción se muestra debajo de la flecha. El disolvente es el líquido que se utiliza para disolver el material de partida y los reactivos. Esto se hace por varias razones. Primero, las reacciones generalmente ocurren mucho más rápidamente en solución que sin un solvente. Cuando se disuelven, los reactivos pueden moverse más fácilmente y chocar entre sí, como si estuvieran nadando. Además, las reacciones más útiles generan calor, y el solvente actúa como un disipador de calor, transportando el exceso de calor lejos. (Las personas que no han pensado en la importancia del solvente a veces inician incendios accidentalmente como resultado.) Sin embargo, hay excepciones, y no todas las reacciones necesitan disolvente.
Estas reacciones mostradas anteriormente sí necesitan disolvente, pero el disolvente no se muestra por otras razones. Hay algo más en lo que enfocarse, y el solvente acabaría de abarrotar la imagen. En cambio, el foco de la imagen es que estos reactivos deben agregarse en un orden particular: primero el nucleófilo y luego el ácido. No se puede permitir que el nucleófilo y el ácido se mezclen antes de que el nucleófilo tenga la oportunidad de reaccionar con el carbonilo. Si lo hicieran, simplemente reaccionarían entre sí, y dejarían en paz al electrófilo carbonilo.
Ejercicio\(\PageIndex{1}\)
- Para cada uno de los casos mostrados anteriormente, use flechas curvas para mostrar el movimiento de los electrones en la reacción entre el anión y el carbonilo.
- Mostrar el intermedio que resulta.
- Use flechas curvas para mostrar el movimiento de los electrones en la reacción del intermedio con ácido para formar el producto.
- Responder
-
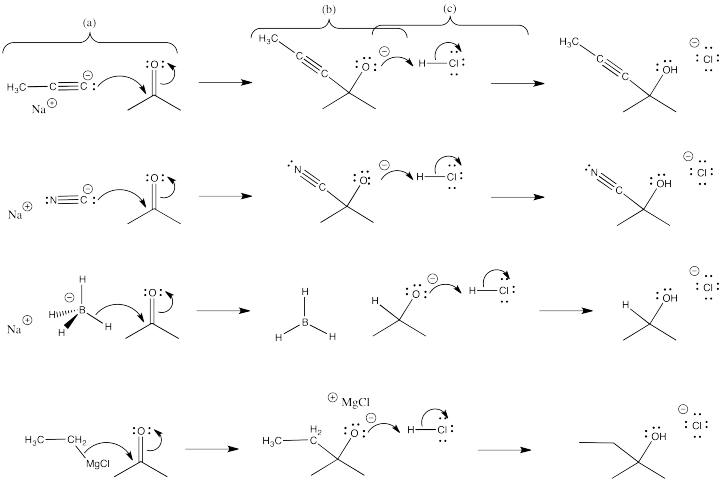
Ejercicio\(\PageIndex{2}\)
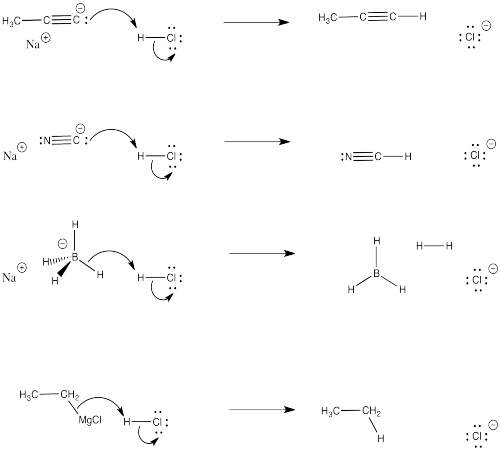
Problema CO3.2.
a) Para cada uno de los casos mostrados anteriormente, se utilizaron flechas curvas para mostrar lo que sucedería si el ácido se mezclara con el nucleófilo.
b) ¿Por qué el nucleófilo ya no podría reaccionar con el carbonilo?
- Responder
-
Anteriormente, vimos que los nucleófilos se suman a los electrófilos de carbonilo, rompiendo el enlace pi del carbonilo y convirtiéndolo en un grupo OH.
El patrón de reactividad es muy diferente con otra clase de nucleófilos. Estos podrían llamarse nucleófilos neutros (a diferencia de los aniónicos). Los nucleófilos neutros no tienen una carga negativa como los anteriores. No obstante, todavía tienen una pareja solitaria, y ese hecho aún los convierte en nucleófilos.
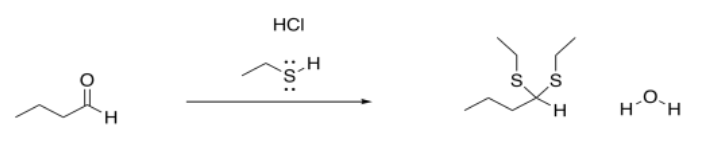
Sin embargo, el resultado de la reacción se ve un poco diferente de lo que vimos con los nucleófilos aniónicos anteriores. En este caso, el carbonilo no se convierte en un grupo OH. (En algún momento veremos que puede ser bajo algunas circunstancias, pero esa es la excepción más que la regla). En cambio, el osygen está completamente desplazado del carbonilo. Se pierde como agua. Se sustituye por dos nucleófilos, en cambio.
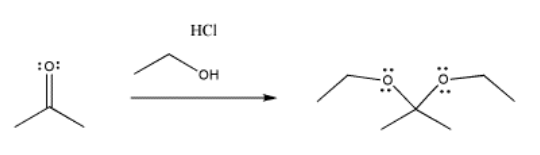
Lo mismo sucede en el siguiente caso, involucrando un nucleófilo de oxígeno en lugar de un azufre. El oxígeno está en la misma columna de la tabla periódica que el azufre, por lo que un comportamiento similar no es realmente una sorpresa.
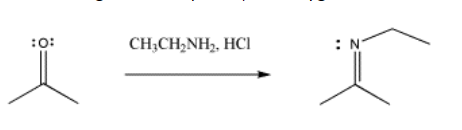
Con los nucleófilos nitrogenados, el oxígeno del carbonilo aún se desplaza como agua, pero el nucleófilo no parece agregar dos veces. En cambio, el C=O se reemplaza por un C=N.
Otros compuestos nitrogenados dan un producto similar, con el doble enlace en un lugar ligeramente diferente. Veremos que la diferencia tiene que ver con cuántos hidrógenos hay en el átomo de nitrógeno original. Si hay dos, es un comercio parejo: el nitrógeno reemplaza al oxígeno carbonílico, y el oxígeno toma los dos hidrógenos para formar agua. Si solo hay un NH, el oxígeno necesita recoger un segundo hidrógeno de otra parte, y lo toma de la posición alfa, junto al carbonilo anterior.
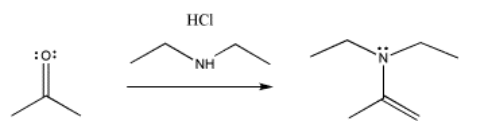
Estos nucleófilos son un poco menos propensos a reaccionar con el ácido, por lo que no hemos tenido cuidado de agregarlos en un orden en particular. Tienen menos probabilidades de reaccionar con el ácido porque no son aniones. Son neutrales, por lo que no atraerán el protón con tanta fuerza como lo harían los aniones. En realidad, hay que tener un poco de cuidado al realizar reacciones como estas. Con los nucleófilos de amina en particular, si agregas demasiado ácido, los nucleófilos reaccionarán con el ácido después de todo.
Eche otro vistazo al patrón general de reactividad para los nucleófilos aniónicos y los nucleófilos neutros. En el caso de los nucleófilos aniónicos, el patrón es relativamente fácil de descubrir. El producto ha incorporado al nucleófilo en su estructura (o al menos la parte aniónica del nucleófilo, de la que pronto conocerás). El nucleófilo se ha unido al carbono carbonilo. El oxígeno carbonilo se ha convertido en parte de un grupo hidroxilo. Estos son patrones muy comunes en la adición de nucleófilos a los carbonilos.
En el caso de los nucleófilos neutros, existen algunas similitudes y algunas diferencias. El nucleófilo aún se incorpora a la estructura del producto. Se ha añadido en la posición carbonilo en el electrófilo. Sin embargo, el destino del oxígeno carbonílico es un poco diferente con los nucleófilos neutros. Generalmente, este átomo se pierde como molécula de agua en estos casos. Si miras de cerca, podrás decir de dónde vienen los dos protones en cada caso para formar la molécula de agua. No es realmente el HCl, que solo se agrega en cantidades muy minúsculas y actúa catalíticamente. Los protones provienen de otras posiciones en el nucleófilo, y a veces del electrófilo, también.
Este capítulo te ayudará a desarrollar habilidades para que puedas reconocer dónde han tenido lugar las adiciones nucleofílicas en las reacciones. También podrás predecir qué productos pueden resultar de una adición nucleofílica.

