3.25: Reactividad Relativa de Carbonilos
- Page ID
- 79348
Estéricos
El impedimento estérico, o hacinamiento alrededor del electrófilo, es un factor importante que influye en la reactividad.
- Cuanto menos abarrotado esté el electrófilo, más fácilmente reaccionará.
- Los aldehídos son más reactivos que las cetonas.
La aglomeración afecta la reactividad simplemente al evitar que los nucleófilos se acerquen fácilmente al sitio electrófilo en el carbonilo. Si el nucleófilo golpea algo que no sea el carbono carbonilo, probablemente simplemente rebotará. Necesita colisionar con el carbono carbonílico para poder entregar sus electrones al lugar correcto.
Cargar
La cantidad de carga positiva en el electrófilo es un factor importante que influye en la reactividad.
- Cuanto más positivo sea el electrófilo, más fácilmente reaccionará.
Los factores que colocan más carga positiva en el carbonilo (grupos extractores de electrones cercanos) hacen que el carbonilo sea más positivo y reactivo. Los factores que colocan densidad electrónica adicional en el carbonilo (donadores de electrones cercanos) hacen que el carbonilo sea menos reactivo.
Hay otra estructura de resonancia en la que podemos pensar que ilustra la electrofilicidad de un carbonilo. Esa estructura coloca una carga negativa completa sobre el oxígeno y una carga positiva completa sobre el carbono. Esta no es una buena estructura de Lewis porque el carbono no tiene octeto. Sin embargo, cuando se toma junto con la estructura regular de Lewis, sugiere algo real sobre la naturaleza del carbonilo: hay carga positiva parcial en el carbono y carga parcial negativa en el oxígeno.
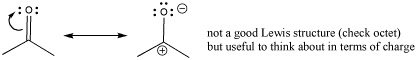
Existe una regla general sobre la estabilidad catiónica en los átomos de carbono: un carbocatión con más carbonos unidos a él es más estable que un carbocatión con más hidrógenos unidos a él.
Esta observación a veces se explica como un efecto inductivo. El carbono cargado positivamente es más electronegativo que los carbonos no cargados, por lo que atrae electrones lejos de ellos. Puede polarizar los carbonos vecinos, atrayendo alguna carga negativa hacia sí mismo y dejando alguna carga positiva en los otros carbonos. De esa manera, su carga es deslocalizada y estabilizada.
En una explicación más sofisticada, el catión se estabiliza por una interacción orbital molecular que involucra el orbital p vacío en el carbocatión y enlaces C-H en los carbonos vecinos.
Una situación similar resulta en el carbono parcialmente positivo en el carbonilo. El carbono carbonilo en la cetona es un poco más estable que el carbono carbonilo en el aldehído.
- La carga positiva parcial en un carbono de aldehído carbonilo es menos estable que la carga positiva parcial en un carbono de cetona carbonilo.
- Nuevamente, los aldehídos son más reactivos que las cetonas.
Ejercicio\(\PageIndex{1}\)
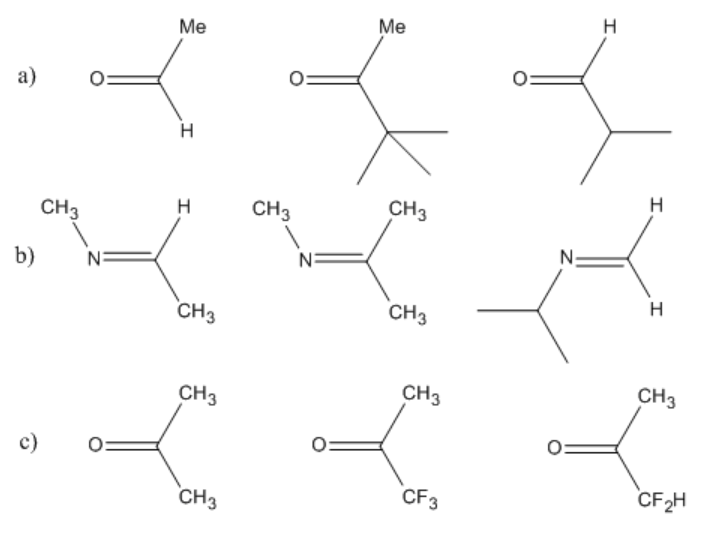
Clasificar los siguientes compuestos carbonílicos de los más reactivos a los menos reactivos hacia la adición nucleofílica. Explica tu razonamiento.
- Contestar a
-
Sobre la base del hacinamiento estérico, el primero es el más reactivo, luego el último, luego el medio.
- Respuesta b
-
Sobre la base del hacinamiento estérico, el último es el más reactivo, luego el primero, y luego el medio.
Si bien hay un grupo grande sobre el nitrógeno en ese último compuesto, el sitio de reactividad es el carbono, que está menos abarrotado.
- Respuesta c
-
Sobre la base de la electrónica, el medio es más reactivo, luego el último, y luego el primero. El átomo de flúor es muy electronegativo y atrae la densidad electrónica hacia sí mismo. Eso deja más carga positiva en el carbono carbonilo cercano. Cuantos más flúor haya en ese carbono cercano, más positivo será el carbono. Cuanto más positivo es el carbono, más atrae electrones de un nucleófilo.
Ejercicio\(\PageIndex{2}\)
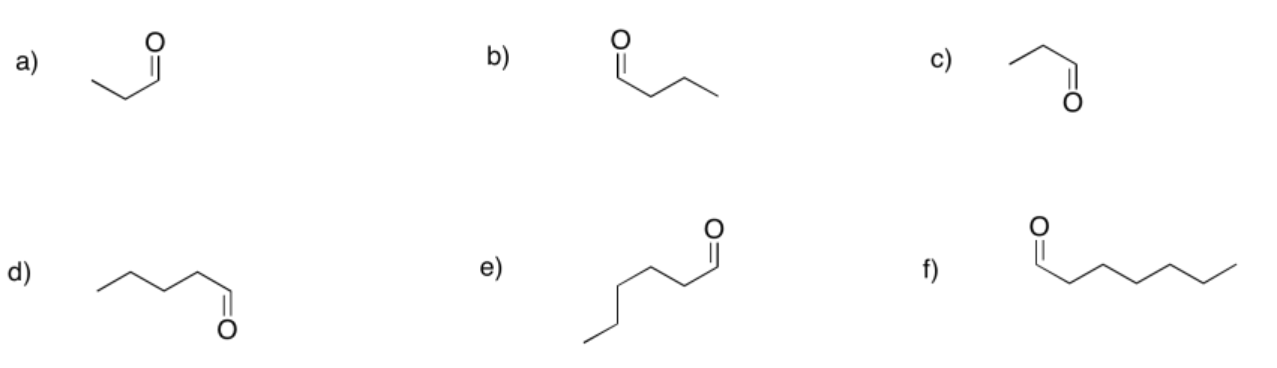
Proporcione nombres para los siguientes aldehídos.
- Contestar a
-
propanal
- Respuesta b
-
butanal
- Respuesta c
-
¡Propanal, otra vez!
- Respuesta d
-
pentanal
- Respuesta e
-
hexanal
- Respuesta f
-
heptanal
Ejercicio\(\PageIndex{3}\)
Problema CO6.3.
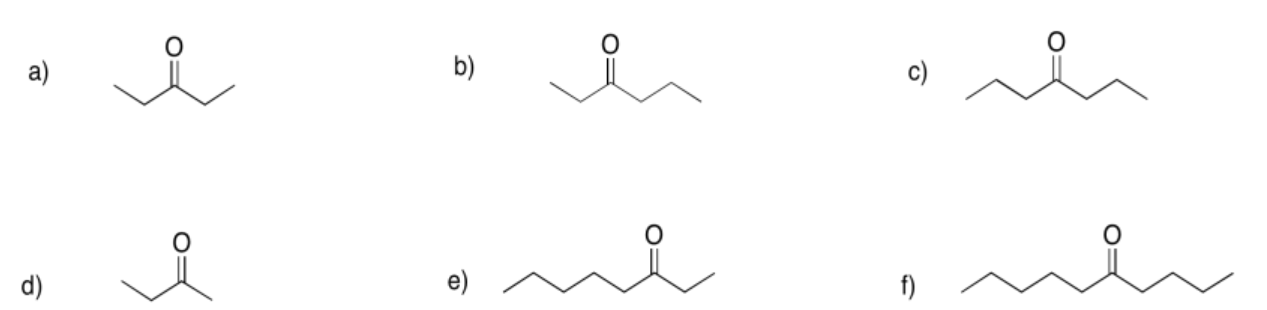
Proporcione nombres para las siguientes cetonas.
- Contestar a
-
3-pentanona
- Respuesta b
-
3-hexanona
- Respuesta c
-
4-heptanona
- Respuesta d
-
2-butanona
- Respuesta e
-
3-octanona
- Respuesta f
-
5-decanona
Ejercicio\(\PageIndex{1}\)
Problema CO6.4.
Proporcione nombres para las siguientes cetonas.
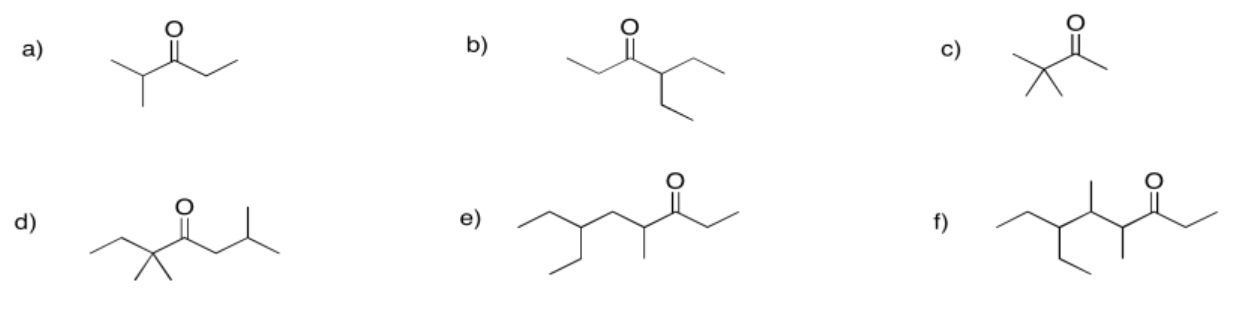
Figura\(\PageIndex{5}\):
- Contestar a
-
2-metil-3-pentanona o 2-metilpentan-3-ona
- Respuesta b
-
4-etil-3-hexanona o 4-etilhexan-3-ona
- Respuesta c
-
3,3-dimetil-2-butanona o 3,3-dimetilbutan-2-ona
- Respuesta d
-
2,5,5-trimetil-4-heptanona o 2,5,5-trimetilheptan-4-ona
- Respuesta e
-
6-etil-4-metil-3-octanona o 6-etil-4-metiloctan-3-ona
- Respuesta f
-
6-etil-4,5-dimetil-3-octanona o 6-etil-4,5-dimetiloctan-3-ona

