3.26: El Mecanismo de Adición de Carbonilo- Paso Uno
- Page ID
- 79455
Los carbonilos actúan más importante como electrófilos. Atraen un par de electrones de un nucleófilo. Cuando eso sucede, se forma un enlace entre el nucleófilo y el carbono carbonílico.
Al mismo tiempo, se rompe el enlace carbono-oxígeno. Pensamos en eso como consecuencia de donar un par de electrones al LUMO del carbonilo. El LUMO en el carbonilo es el orbital antienlace C-O pi. Cuando ese orbital está poblado, ya no hay una disminución neta en la energía debido a la interacción pi entre el carbono y el oxígeno. El enlace pi se rompe. El par de electrones del enlace pi va al oxígeno, el más electronegativo de los dos átomos en el enlace original. Se convierte en una pareja solitaria.
Después de que el enlace pi se rompe, la reacción alcanza un punto de ramificación o punto de decisión. La reacción puede ir hacia adelante o hacia atrás.
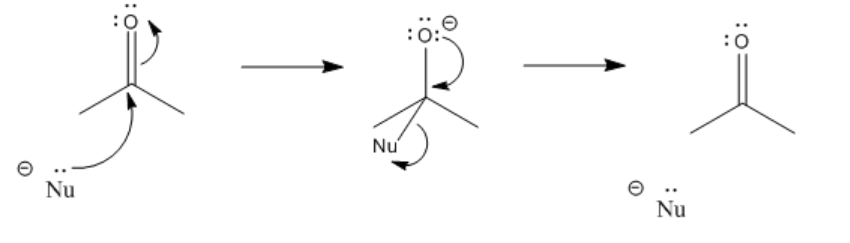
En otras palabras, esta reacción puede ocurrir en equilibrio.
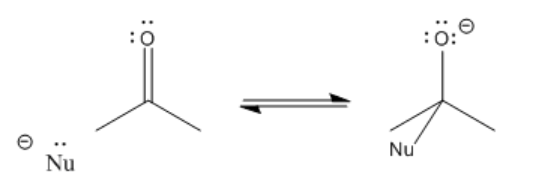
Para ir hacia atrás, la reacción simplemente se desliza al revés. Un par solitario en el oxígeno dona al carbono, formando un enlace pi nuevamente, y empuja al nucleófilo fuera. Si la reacción termina avanzando o deslizándose hacia atrás depende en parte de la estabilidad relativa de esos dos extremos de la reacción. Eso suele ser muy difícil de evaluar cualitativamente, porque hay demasiados factores involucrados. Sin embargo, un factor que juega un papel es la estabilidad de carga. Debido a que en esta reacción se produce un “O menos” o alcóxido, si el nucleófilo original era un ion más reactivo que un alcóxido, la reacción probablemente va a la derecha.
Por esa razón, muchos de los mejores nucleófilos para estas reacciones involucran aniones de carbono o aniones de hidrógeno. Esos aniones son menos estables que los aniones de oxígeno.
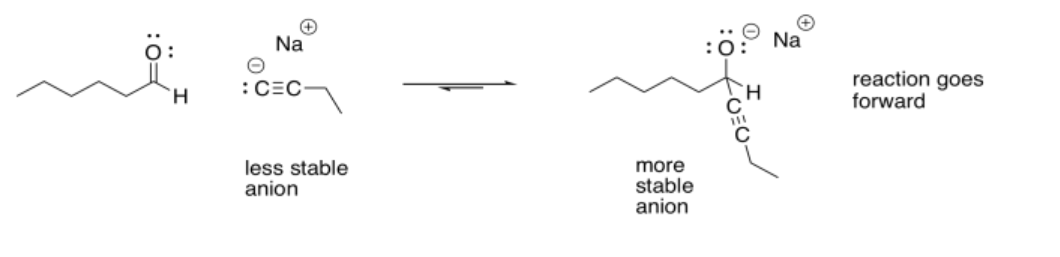
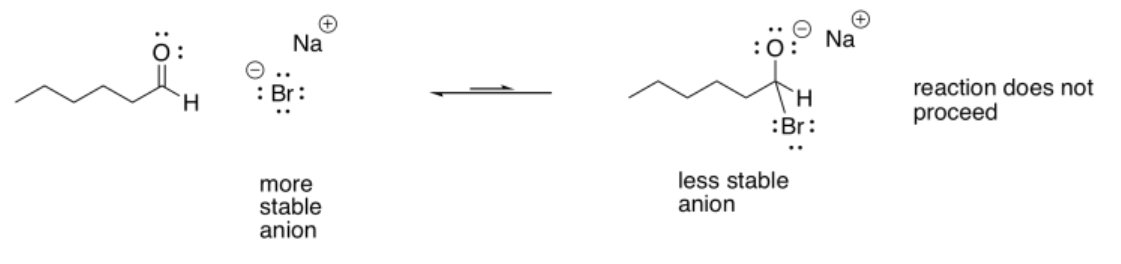
Si el nucleófilo fuera menos reactivo que el alcóxido, la reacción podría ir fácilmente de nuevo a la izquierda. Por esa razón, los iones haluro estables (fluoruros, cloruros, bromuros, yoduros) no son muy buenos nucleófilos para estas reacciones. Tienen pares solitarios, incluso tienen cargas negativas, pero el anión que se produciría generalmente sería menos estable que el ion haluro original.
Ejercicio\(\PageIndex{1}\)
Proporcionar flechas curvas y predecir la dirección del equilibrio en los siguientes casos.
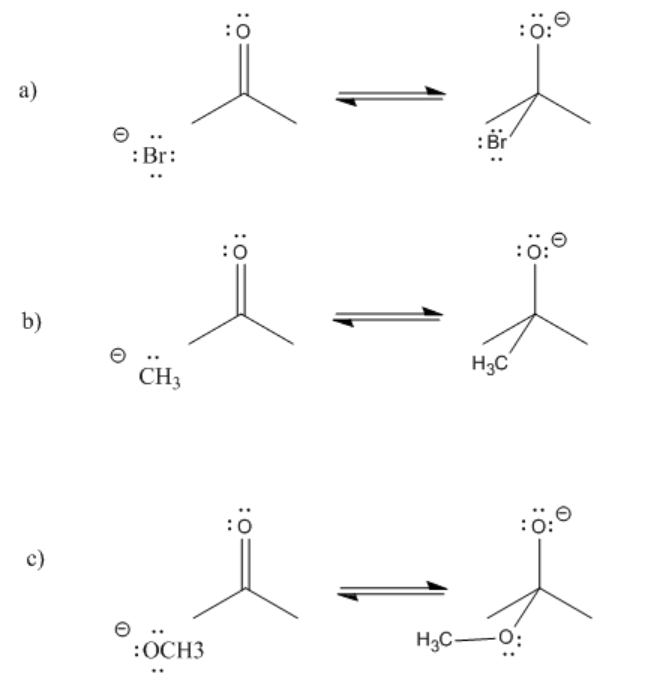
- Contestar
-

- Más nucleófilos reactivos empujan el equilibrio hacia la derecha
- Nucleófilos menos reactivos no empujan la reacción hacia la derecha; la reacción permanece a la izquierda
¿Qué sucede después del equilibrio inicial? En la mayoría de los casos, el alcóxido que se forma se protonará. Recogerá un protón para convertirse en alcohol. La fuente del protón puede ser un ácido, agregado deliberadamente para proporcionar el H +. Alternativamente, puede ser simplemente una molécula muy ligeramente ácida como el agua u otro alcohol.

