4.2: Encuadernación CO
- Page ID
- 79502
La inserción migratoria implica la transferencia de un grupo hidruro o alquilo de un metal a un monóxido de carbono unido. Debido a que esta reacción involucra específicamente monóxido de carbono unido, deberíamos echar un vistazo a cómo el CO se une a los metales de transición. Deberíamos comenzar por revisar la estructura Lewis del monóxido de carbono.
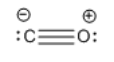
Tenga en cuenta el par solitario sobre monóxido de carbono. Es una base potencial de Lewis o nucleófilo. Por varias razones, los metales de transición son casi siempre electrófilos: a menudo son iones cargados positivamente, pero en general tienen un octeto de 18 electrones que es difícil de llenar, por lo que frecuentemente necesitan más electrones.
- Lewis: El CO es un donador de dos electrones
- Los metales de transición son electrófilos
- El CO se une a átomos o iones metálicos
- El carbono es el átomo donante habitual; tiene un par solitario y una carga formal negativa
En la figura se muestra la donación de un par de electrones a un catión metálico\(\PageIndex{2}\).

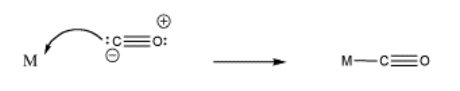
Recuerde, debido a que la regla de 18 electrones para los metales de transición los hace electrofílicos, el par de electrones no necesita una carga positiva para atraerlo (figura\(\PageIndex{3}\)).

Frecuentemente, las cargas formales y los pares solitarios ni siquiera se muestran en el compuesto de metal de transición, debido a la complejidad del cuadro.
Tenga en cuenta que el CO en el contexto de los complejos metálicos a menudo se denomina carbonilo. Por ejemplo, Cr (CO) 6 se llama hexacarbonilcromo.
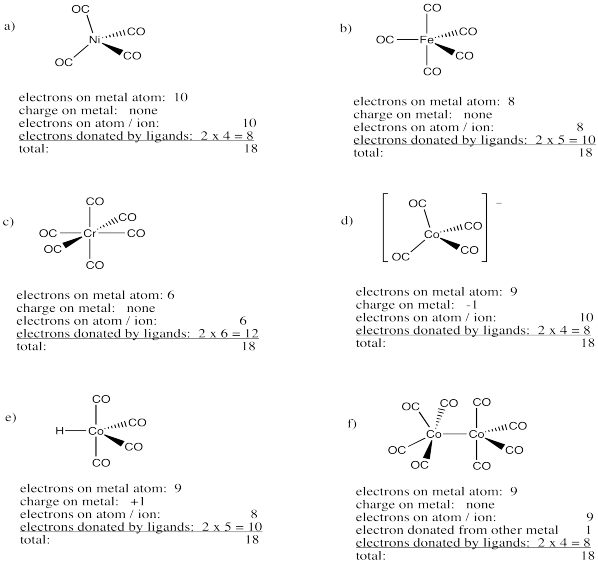
Dibujar estructuras para los siguientes compuestos carbonílicos metálicos. Para cada compuesto, indique
i) el recuento de electrones en el metal en el complejo (muestra tu trabajo)
ii) la geometría en el metal
- níquel tetracarbonilo, Ni (CO) 4
- pentacarbonilhierro, Fe (CO) 5
- hexacarbonilo cromo, Cr (CO) 6
- anión tetracarbonilcobalto, Co (CO) 4 -
- hidruro de tetracarbonilcobalto, Co (CO) 4 H
- octacarbonilcobalto, Co 2 (CO) 9 (hay un enlace entre los dos átomos de cobalto)
- Contestar
-
Dibujar, con estructuras y flechas, el equilibrio entre pentacarbonilhierro y tetracarbonilhierro, Fe (CO) 4 más monoóxido de carbono.
- Contestar
-
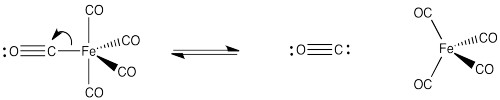
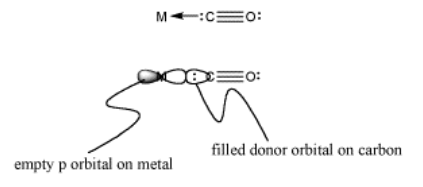
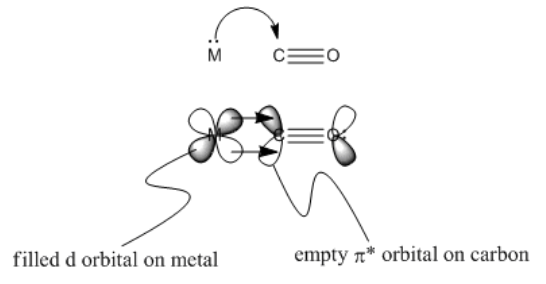
Un aspecto importante de la unión de CO se llama “donación de retorno”. En la retrodonación, no sólo el ligando dona electrones al metal, sino que el metal también dona al ligando. Podemos pensar en el CO como donar un par de electrones de un orbital basado en carbono a un orbital vacío en el metal, como un orbital p (figura MI2.5). El metal tiene d orbitales que tienen buena simetría superpuesta con los orbitales antiadhesión pi en el CO. La densidad de electrones puede ser donada de un orbital de metal d al nivel pi* (figura MI2.6). Así, la unión a un metal en realidad debilita el enlace CO porque un orbital pi* recibe densidad electrónica del metal.
- Imagen MO: donación de orbital basada en carbono a orbital p de metal vacante
- Imagen MO, parte 2: donación de metal ocupado d orbital a CO pi* orbital
- esta interacción debilita el enlace múltiple C-O
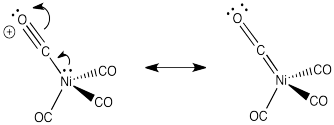
Dibujar una estructura de Lewis que tome en cuenta el efecto de la donación de electrones de metal a carbonilo en níquel tetracarbonilo.
- Contestar
-
La espectroscopia infrarroja se usa a menudo para evaluar el orden de enlace entre átomos específicos dentro de una molécula. Debido a que las frecuencias de estiramiento son proporcionales a la fuerza de unión, una comparación de frecuencias de un enlace de una molécula a un enlace similar en otra puede dar una idea de los órdenes de enlace en cada caso.
- Un enlace C-O en compuestos orgánicos muestra entre 1000-1200 cm -1 en la mayoría de los casos. Un enlace C=O normalmente se muestra cerca de 1600-1700 cm -1. Explique por qué estos dos enlaces dan lugar a dos frecuencias de estiramiento diferentes.
- Con base en la estructura de Lewis, ¿qué predice para esta frecuencia de enlace en una molécula de CO?
- ¿Qué pasará con la frecuencia de estiramiento de CO en monóxido de carbono si la molécula se une a un átomo de paladio?
Explicar las diferencias en las frecuencias de estiramiento de CO en los siguientes pares de compuestos. (Nota: el número de picos está relacionado con la simetría molecular y la teoría de grupos; enfocarse únicamente en la diferencia de magnitud de la frecuencia.)
- CO a 2143 cm -1 vs Mo (CO) 6 a 2004 cm -1.
- Ni (CO) 4 a 2060 cm -1 vs Fe (CO) 4 2- a 1790 cm -1.
- Cr (CO) 6 a 2000 cm -1 vs Mn (CO) 6 + a 2090 cm -1.
- (PF 3) Mo (CO) 3 a 2055 y 2090 cm -1 vs (PPh 3) Mo (CO) 3 a 1835 y 1934 cm -1.
- Cr (CO) 6 a 2000 cm -1 vs. (C 6 H 5 CH 3) Cr (CO) 3 a 1963 y 1869 cm -1.
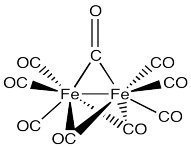
En ocasiones, los carbonilos pueden tender puentes entre dos metales. Por ejemplo, el grupo de hierro Fe2 (CO) 9 contiene seis carbonilos “terminales”, unidos a un solo hierro cada uno, y tres carbonilos “puente”, cada uno de los cuales está unido a ambos átomos de hierro. Este complejo también cuenta con un enlace metal-metal.
- dibujar una estructura para este compuesto.
- explicar por qué los carbonilos terminales muestran frecuencias de estiramiento de 2082 y 2019 cm -1, pero los carbonilos puente muestran una frecuencia de estiramiento de 1829 cm -1.
- Contestar
-
Los carbonilos “orgánicos”, como los aldehídos y las cetonas, también pueden unirse a los metales de transición, como habrás visto antes. Estos compuestos se unen a los metales de transición de una manera muy diferente al monóxido de carbono. Normalmente, pensamos en ellos como simples donantes de pares solitarios. El par solitario de oxígeno dona al átomo o ion metálico. Los complejos resultantes son importantes porque el carbonilo se “activa” o está listo para aceptar nucleófilos.
- Los carbonilos orgánicos también pueden unirse a átomos o iones metálicos.
- La unión suele ser a través del heteroátomo.
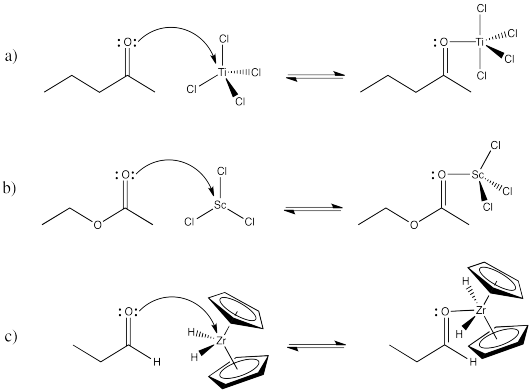
Dibujar, con flechas, la coordinación de los siguientes compuestos orgánicos carbonílicos a complejos metálicos.
- 2-pentanona con TiCl 4.
- acetato de etilo con ScCl 3.
- propanal con Cp 2 ZrH 2 (Cp = anión ciclopentadienilo, C 5 H 5 -).
- Contestar
-