5.2: Modificación de proteínas
- Page ID
- 79266
Después de que las proteínas se sintetizan a través de la transcripción del ADN, sus estructuras pueden modificarse de varias maneras. Este proceso, en general, se denomina “modificación postraduccional”. Podría implicar la unión de pequeños grupos orgánicos a la proteína, la unión de otras biomoléculas, o incluso la alteración completa de un residuo de aminoácido en otra forma, de manera que la proteína en realidad contiene un residuo que no existe en el alfabeto básico de aminoácidos del principiante.
Las modificaciones menores de las proteínas pueden ser muy importantes en la regulación de la actividad enzimática. Los cambios modestos en la estructura pueden tener un gran impacto en la conformación de la proteína, lo que a su vez podría abrir o cerrar el acceso al interior de la enzima o alterar la forma del sitio activo. Alternativamente, estos cambios podrían afectar la ubicación de una proteína al moverla de la membrana celular al interior de la célula o viceversa. También podrían resultar en la formación o disociación de ensamblajes supramoleculares, al aumentar o disminuir la atracción entre dos biomoléculas separadas.
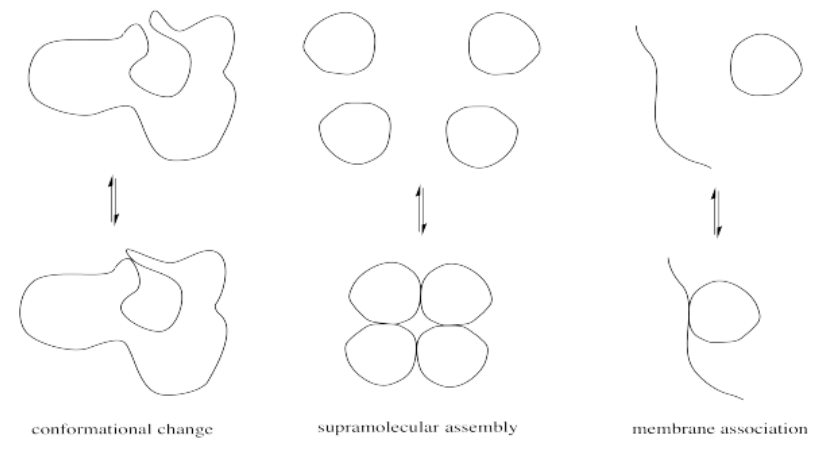
Las razones físicas de estos cambios estructura-propiedad se basan en simples atractivos intermoleculares o, en el caso de una proteína grande y complicada, atracciones intramoleculares entre diferentes partes de una misma proteína. Una interacción de enlaces de hidrógeno o interacción ión-dipolo que mantiene la proteína en una conformación puede verse alterada si un jugador clave en esa interacción es enmascarado repentinamente. Por ejemplo, una cadena lateral catiónica de amonio puede reaccionar para convertirse en un grupo amida; la ausencia de una carga positiva completa en este grupo altera significativamente sus atracciones intermoleculares.
Probablemente hay cientos de formas en las que se modifican las proteínas. Analizaremos solo algunas modificaciones diferentes que ocurren en las proteínas, algunas de las cuales están estrechamente ligadas a la sustitución de carboxilato. Tenga en cuenta que cualquiera de estas modificaciones podría actuar para apagar o “encender” una enzima; los detalles dependen del caso individual.
Acetilación
La acetilación es la unión de un grupo acetilo, CH 3 C=O, a otro compuesto tal como un residuo de aminoácido. Los grupos serina y treonina pueden estar acetilados para producir ésteres, las cadenas laterales de cisteína pueden estar acetiladas para hacer tioésteres o grupos amino. Frecuentemente, la acetilación se refiere específicamente a la reacción en un grupo amino, tal como el extremo N de una proteína o en una cadena lateral de lisina, formando una amida.
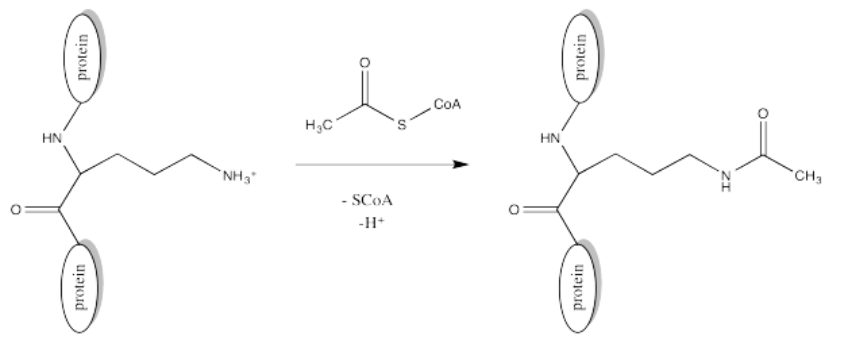
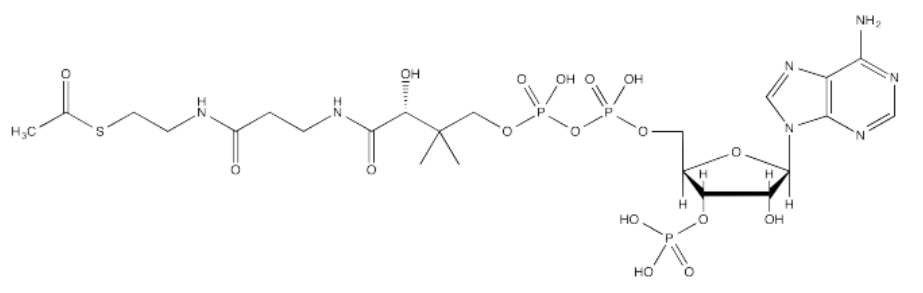
La fuente del grupo acetilo es la acetil coenzima A (AcsCoA, abajo), el caballo de batalla tioéster de la célula. Esta estructura puede parecer un poco complicada, pero en el nivel más básico es solo un electrófilo carboxilo (CH 3 C=O) unido a un grupo saliente de tiolato muy grande.
Por supuesto, las cadenas laterales de lisina y los terminales N de las proteínas suelen estar en un estado protonado bajo condiciones biológicas. Eso significa que debe haber un paso de desprotonación a lo largo de la vía de reacción.
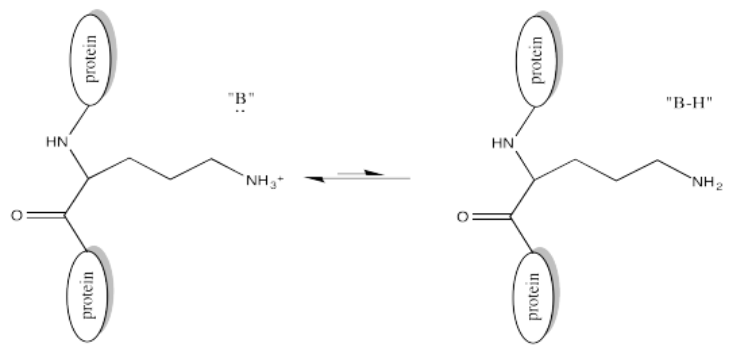
Un ejemplo del papel de la acetilación se observa en las histonas. Las histonas son proteínas que se encuentran en la cromatina, la mezcla de ADN y proteínas en el núcleo celular. La hélice de ADN ya enrollada se envuelve aún más alrededor de las histonas, agrupándola en un paquete más pequeño. El ADN tiene muchas, muchas cargas negativas a lo largo de él porque las unidades de fosfato en su cadena principal de copolímero de fosfato-azúcar están cargadas negativamente a pH biológico típico. El ADN interactúa fácilmente con las histonas porque son ricas en residuos de lisina cargados positivamente.
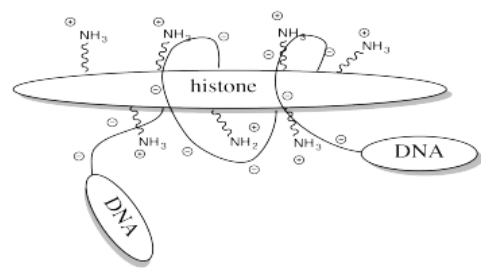
Almacenar ADN en paquetes más pequeños te permite mantener más basura en tu núcleo, pero no quieres dejar que el ADN se asiente ahí. De vez en cuando quieres sacarlo y hacer algo con él, pero ¿cómo puedes hacerlo cuando está pegado a esas malditas histonas? La respuesta es, sólo hay que apagar el campo de fuerza de las historias. Deshazte de esa carga positiva, y el ADN ya no se quedará atascado. Es fácil hacerlo acetilando las histonas.
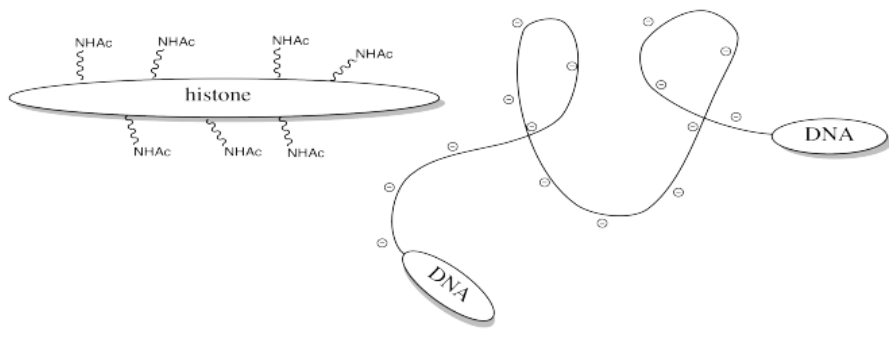
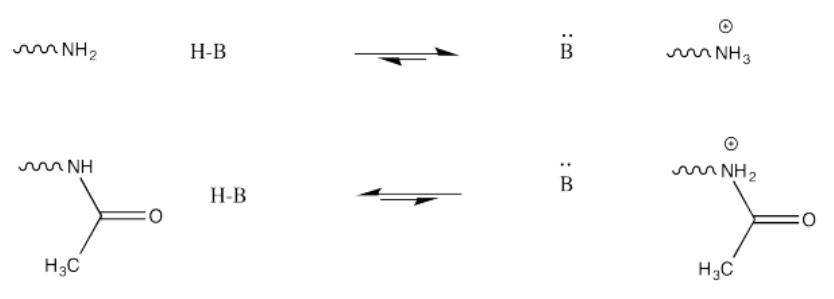
Este cambio en la carga resulta porque, aunque las aminas se protonan fácilmente, las amidas no lo son. Por lo tanto, es probable que las aminas porten carga positiva en condiciones biológicas, mientras que las amidas probablemente sean neutras.
Ejercicio\(\PageIndex{1}\)
Explique por qué una amina es fácilmente protonada pero una amida no lo es.
- Responder
-
Este cambio en la carga resulta porque, aunque las aminas se protonan fácilmente, las amidas no lo son. La protonación de una amida resultaría en un catión adyacente al carbono carbonílico muy positivo, conduciendo a una acumulación de carga positiva localizada. Eso no sería fácil. Además, no es muy probable que el nitrógeno de la amida done sus electrones a un protón en primer lugar. Sus protones están demasiado ocupados. Están atados en conjugación con el carbonilo, por lo que realmente no están disponibles para actuar como el par solitario de una base.

Ejercicio\(\PageIndex{2}\)
Proporcionar un mecanismo para la acetilación de una cadena lateral de lisina. Asumir la presencia de histidina y su ácido conjugado, ion histidinio; estas especies son lanzaderas de protones comunes en reacciones biológicas.
Fosforilación
Los residuos de serina, tirosina y treonina se modifican frecuentemente por fosforilación, que es la formación de un éster fosfato. La fosforilación de estos grupos da como resultado un cambio de una cadena lateral neutra a una cadena lateral aniónica. El donante de fosfato en estos casos es otro ejecutante celular ubicuo, ATP.
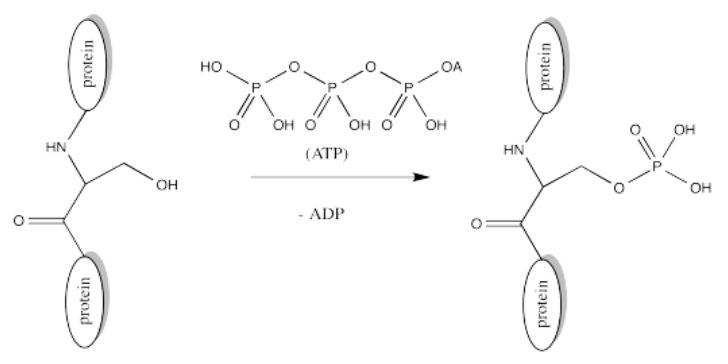
Aquí se muestra la estructura completa del ATP. Es un poco menos complicado que ACScoA. Una vez más, al nivel más básico de reactividad, proporciona un electrófilo de fosfato, unido a un grupo saliente de fosfato.
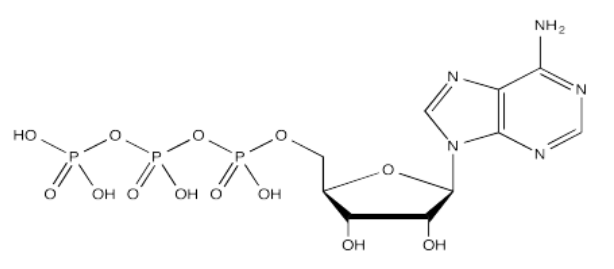
La naturaleza aniónica del fosfato puede no ser evidente en el dibujo anterior de ATP, pero en realidad, a pH biológico, un fosfato sería desprotonado. Los fosfatos en realidad experimentan múltiples equilibrios que implican la pérdida de dos protones.
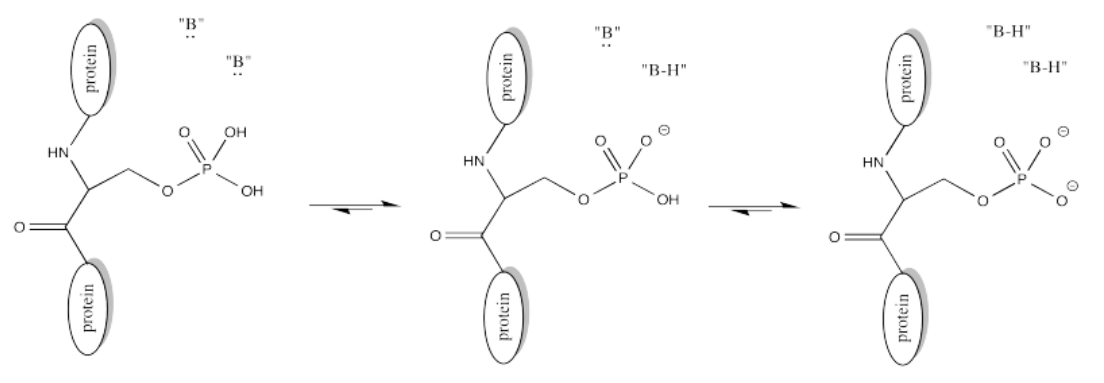
Ejercicio\(\PageIndex{3}\)
Proporcionar un mecanismo para la fosforilación de serina en presencia de una lanzadera de protones biológica apropiada.
Alquilación (Farnesilación)
Hay otras modificaciones que ocurren a través de diferentes mecanismos. En una farnesilación, la reacción ni siquiera tiene lugar en un carbonilo. No se realiza en un fosfonato ni en un sulfonato.
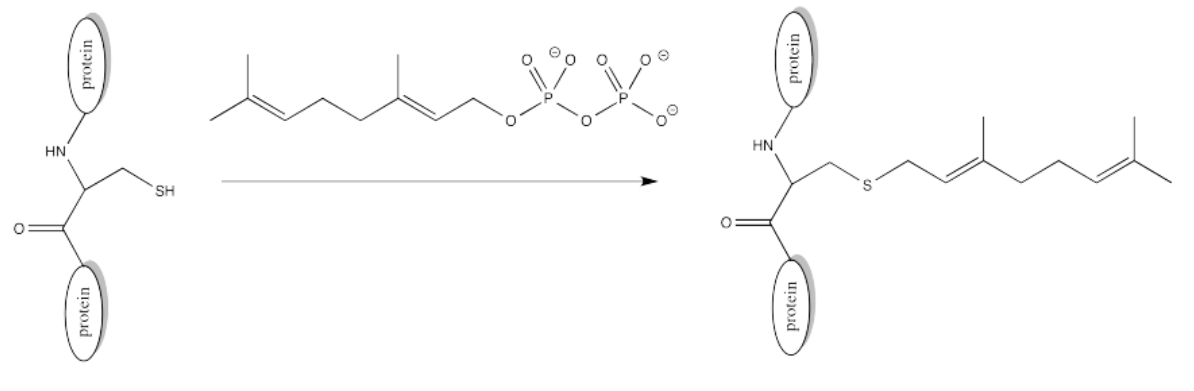
Ejercicio\(\PageIndex{4}\)
El azufre es el nucleófilo en la farnesilación mostrada anteriormente. Identificar el electrófilo y mostrar un mecanismo con flechas curvas.
Ejercicio\(\PageIndex{5}\)
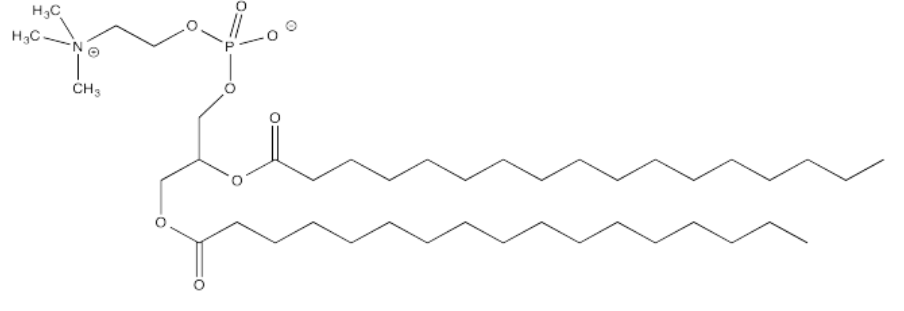
La palmitilación está estrechamente relacionada con la acetilación, pero el electrófilo en este caso es un grupo palmitoílo en lugar de un acetilo.
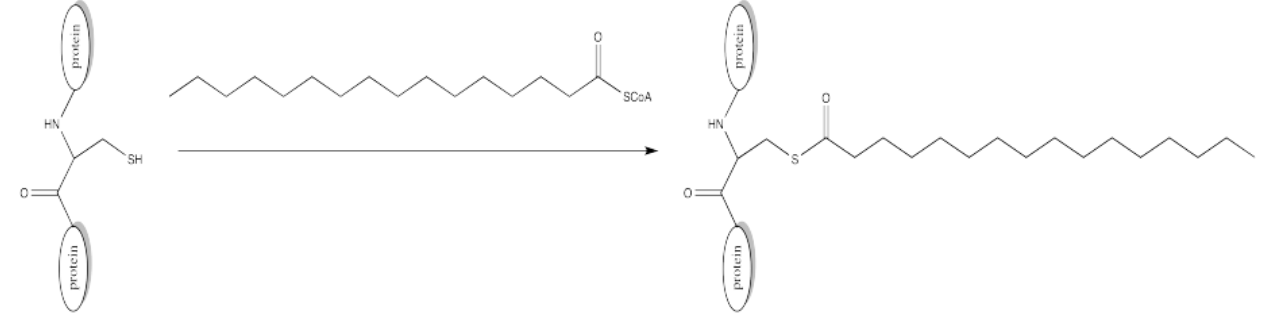
- Proporcionar un mecanismo para la palmitoilación de cisteína en presencia de un lanzadera de protones biológica apropiada.
- Explica cómo la palmitoilación podría influir en la interacción de una proteína con una membrana celular, compuesta por fosfolípidos como este: