5.6: Patrones de reactividad general
- Page ID
- 79257
Así como un simple carbonilo es un electrófilo, también lo es un carboxiloide. Los carboxiloides reaccionan con muchos de los mismos nucleófilos que reaccionan con aldehídos y cetonas. El resultado general de la reacción es muy diferente. Sin embargo, el mecanismo de la reacción es realmente bastante similar.
Los nucleófilos tienen el efecto general de agregar a través del grupo carbonilo de un aldehído o cetona. La adición de un protón produce un alcohol. El enlace C=O se rompe a un enlace C-O. En algunos casos, el enlace C=O está completamente roto y después de varios pasos el oxígeno carbonilo es reemplazado por algún otro heteroátomo. Por otro lado, los nucleófilos se suman a los carboxiloides y terminan reemplazando el heteroátomo junto al carbonilo. El carbonilo en sí permanece intacto después de que se completa la reacción.
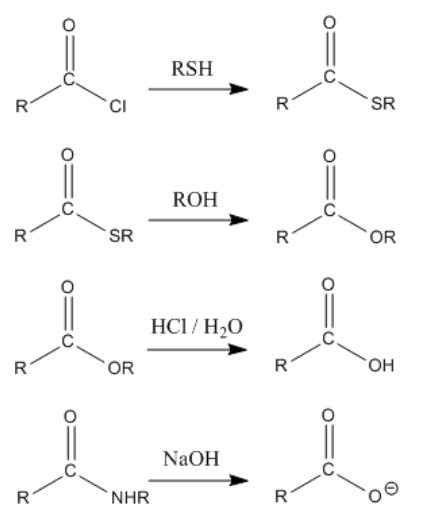
El patrón general en la química de carboxiloides es que los nucleófilos sustituyan al grupo heteroatómico próximo al carbonilo. En estas reacciones, el grupo próximo al carbonilo a veces se denomina “grupo lástima”. Ese término simplemente significa que este grupo ha sido sustituido por el final de la reacción.
Nótese que no hay razón para creer que la reacción elemental inicial entre un carboxiloide y un nucleófilo sea diferente a la de un carbonilo simple con un nucleófilo. Un examen de los orbitales fronterizos en un carboxiloide sugiere que el nivel de antiunión pi sería el sitio de población por un par solitario nucleofílico. El enlace carbonilo pi se rompería a medida que se acercara el nucleófilo.
Sin embargo, una característica importante de la química del carbonilo es que dos heteroátomos en un carbono tetraédrico no pueden durar. Uno siempre empuja al otro. Si el oxígeno carbonilo anterior empuja fuera del nucleófilo, el sistema vuelve a los materiales de partida. Sin embargo, si el oxígeno carbonilo anterior desplaza al grupo heteroatómico próximo a él, hay un cambio general en la unión y se forma un producto diferente. El resultado neto es la sustitución del grupo junto al carbonilo.
Ejercicio\(\PageIndex{1}\)
El resultado global de la reacción con un carboxiloide es desplazar el grupo heteroátomo próximo al carbonilo. Este grupo se libera típicamente como anión.
- ¿Qué característica de los heteroátomos típicamente encontrados unidos al carbonilo en los carboxiloides les permite ser desplazados de la molécula como aniones?
- ¿Por qué no ocurre esta misma reacción con aldehídos y cetonas?
- Contestar a
-
La electronegatividad del heteroátomo unido al grupo carbonilo en un carboxiloide es un factor que le permite salir y formar su propio anión estable.
- Respuesta b
-
Si bien el carbono y el hidrógeno son más electronegativos que muchos de los elementos de la tabla periódica, no son lo suficientemente estables como aniones para formarse fácilmente por sí mismos.
Ejercicio\(\PageIndex{2}\)
Sugerir un orden de reactividad para los carboxiloides: clasificarlos de los más reactivos a los menos reactivos. Proporcione una razón para su tendencia.
Ejercicio\(\PageIndex{3}\)
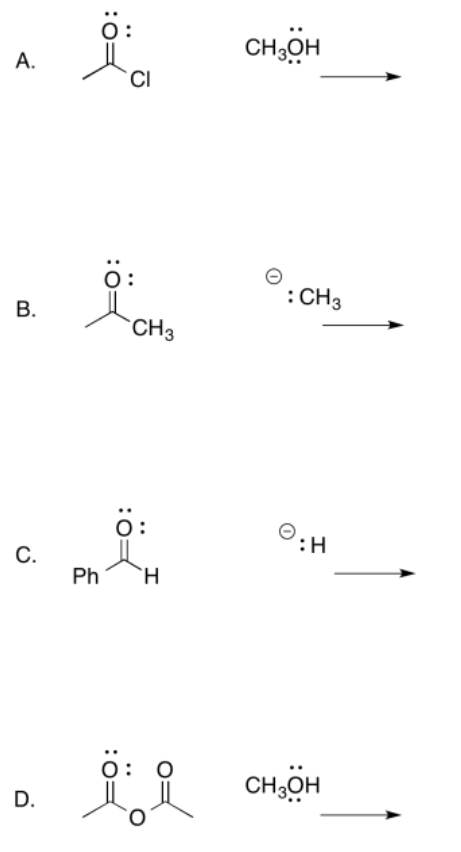
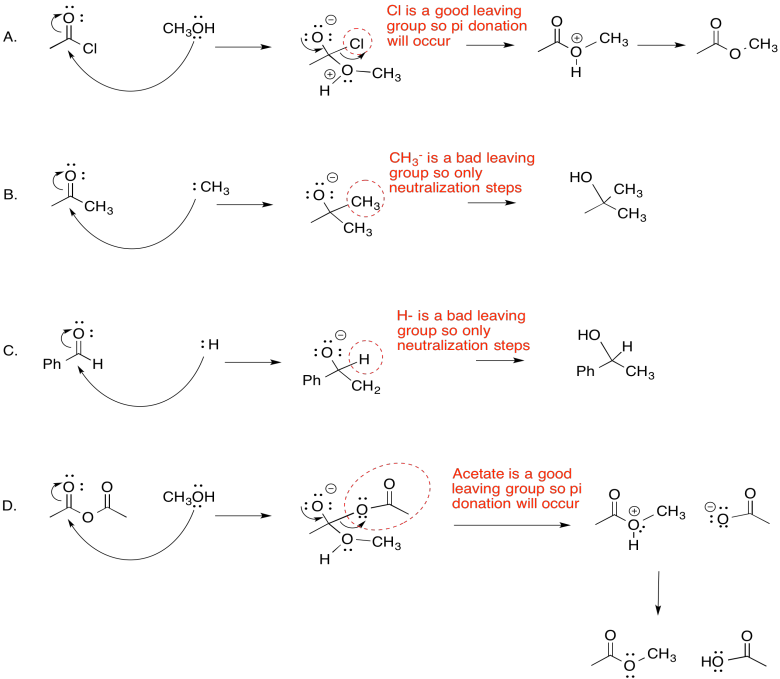
Para las siguientes reacciones
a. Dibujar flechas mecanicistas para la adición nucleofílica. Mostrar claramente la estructura tetraédrica formada inmediatamente después de las adiciones nucleofílicas.
b. Determinar si un grupo de salida está presente. Si es así, mostrar el paso de donación de pi y el producto resultante. Si no, dibuja el producto en forma neutra.
- Responder
-
Ejercicio\(\PageIndex{4}\)
Cuando se producen compuestos ácidos como el HCl en una reacción, la reacción suele ir seguida de un tratamiento con una base que neutralizará el ácido. Proporcionar estructuras Lewis-Kekule de las siguientes bases.
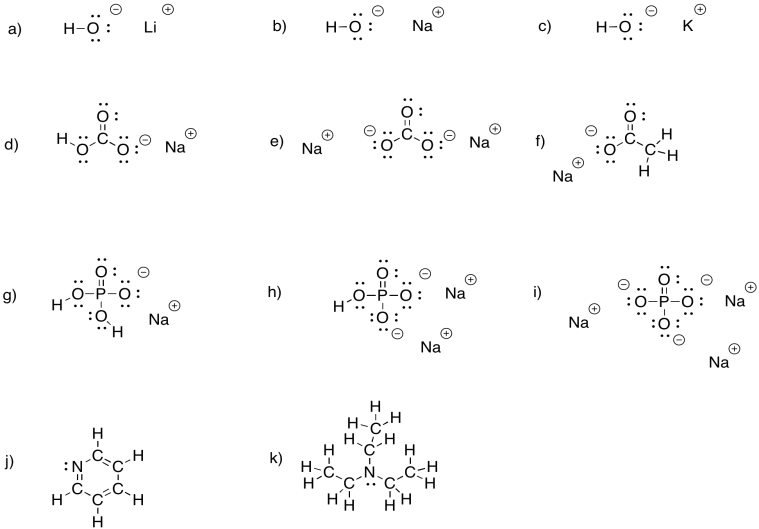
a) hidróxido de litio, LiOH b) hidróxido de sodio, NaOH c) hidróxido de potasio, KOH
d) bicarbonato de sodio, NaHCO 3 e) carbonato de sodio, Na 2 CO 3 f) acetato de sodio CH 3 CO 2 Na
g) dihidrogenofosfato de sodio, NaH 2 PO 4 h) hidrogenofosfato de sodio, Na 2 HPO 4 i) fosfato de sodio, Na 3 PO 4
j) piridina, C 5 H 5 N k) trietilamina, (CH 3 CH 2) 3 N
- Responder
-