5.7: Energías Comparadas- La Colina de Esquí
- Page ID
- 79256
En la mayoría de los casos, la reactividad de los carboxiloides implica convertir un carboxiloide en otro. Esto se hace reemplazando un sustituyente heteroátomo por otro. Por ejemplo, el cloruro en un cloruro de ácido puede ser reemplazado por un alcohol o ion alcóxido para hacer un éster.
El hecho de que un carboxiloide pueda convertirse en otro sugiere que habría un equilibrio entre ellos. La relación de dos carboxiloides en equilibrio estaría determinada por su estabilidad relativa, así como la estabilidad de otras especies asociadas en solución.
Podemos trazar la estabilidad de los carboxiloides en una superficie de energía potencial, como se muestra a continuación. Los carboxiloides de mayor energía, menos estables y más reactivos se muestran en la parte superior de la curva de energía potencial. Los carboxiloides de menor energía, más estables y menos reactivos se encuentran más abajo en la curva de energía potencial.
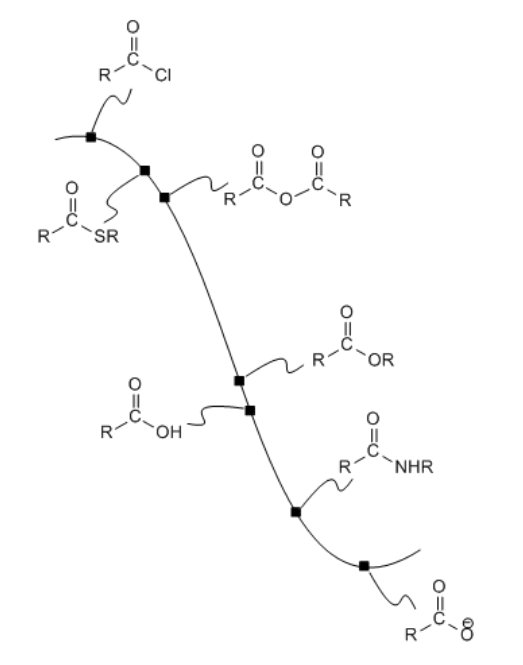
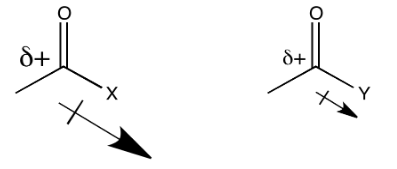
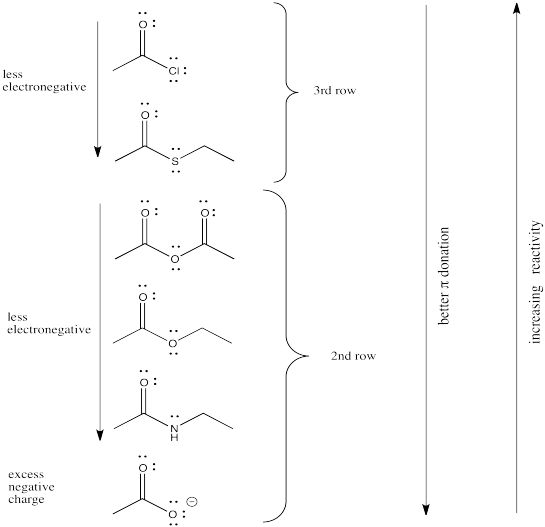
El heteroátomo unido al carbonilo en un carboxiloide es siempre un átomo electronegativo con un par solitario. Cualquiera de esas dos características podría ser útil para comprender la tendencia de reactividad ilustrada anteriormente. Por ejemplo, un átomo electronegativo haría que el carbono carbonílico fuera más positivo. Ese carbono ya es muy positivo por el doble enlace al oxígeno. Agregar un átomo electronegativo adicional debería hacerlo aún más. La cantidad de carga positiva en el carbono carbonílico sería aún mayor si el átomo unido a él fuera excepcionalmente electronegativo.
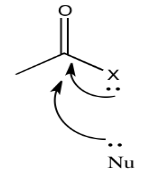
Por otro lado, un par solitario cercano podría contrarrestar el poder de atracción de electrones del carbono carbonilo. En cierto sentido, podríamos pensar en esa pareja solitaria como competir con la donación de un nucleófilo potencial.
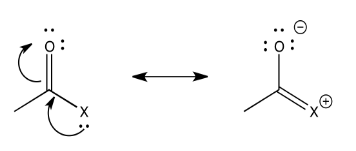
La capacidad de un átomo para donar π, entonces, podría tener una influencia en la fuerza con la que el carbonilo atraerá a los nucleófilos. Por supuesto, hay algún trade-off involucrado en π-donación. Por lo general, el átomo que dona debe asumir una carga positiva, ya que está prestando un par de electrones propios a otro átomo. Los factores que influyen en la facilidad con la que esto puede suceder podrían ser importantes para determinar la reactividad de los carboxiloides.
Ejercicio\(\PageIndex{1}\)
Con base en la electronegatividad del átomo unido al carbono carbonilo, podríamos esperar una tendencia específica en la reactividad carboxiloide. Explicar cómo este factor afectaría la electrofilicidad en el carbono carbonilo y predecir la tendencia correspondiente en la reactividad. Compare esta tendencia con la información de la Figura\(\PageIndex{1}\) (CX3.1).
- Responder
-
Podríamos esperar que los carboxiloides con los elementos más electronegativos unidos al carbonilo sean los más reactivos y menos estables hacia la sustitución (es decir, los carboxiloides con los heteroátomos más electronegativos se sustituirían más fácilmente).
En ese caso, predeciríamos que los carboxiloides con el sustituyente más electronegativo (oxígeno) serían los más reactivos. Hay una serie de tipos diferentes y vamos a pensar en cómo se relacionan entre sí en breve.
Después de los derivados del oxígeno predeciríamos ya sea los derivados del nitrógeno o el cloruro, dependiendo de qué escala de electronegatividad pasemos a usar (recuerde, la electronegatividad no es una propiedad experimentalmente pura, sino el resultado de un cálculo que se puede realizar de diferentes maneras). El derivado de azufre sería menos reactivo.

Todavía hay varios derivados de oxígeno diferentes para comparar: ácidos carboxílicos (OH), carboxilatos (O-), ésteres (OR, en los que R es una cadena alquílica o carbonada) y anhídrido de ácido (OC=O). El más fácil de diferenciar es el carboxilato, por su carga negativa. Debe ser menos atractivo para un nucleófilo que los otros derivados del oxígeno, porque ofrecería más repulsión a un par solitario entrante.
Sin embargo, realmente no podemos predecir si sería menos reactivo que los análogos de nitrógeno, cloro o azufre, porque ¿quién sabe si la carga o la naturaleza del átomo importan más?
A medida que sucede, el cargo probablemente importe más. Aprendemos que simplemente mirando la tendencia experimental y viendo que el carboxilato es el menos reactivo de todos los carboxiloides.
Volviendo a los otros tres derivados de oxígeno, sería difícil diferenciar entre el efecto de un átomo de hidrógeno remoto versus una cadena alquílica en el éster frente al ácido carboxílico, por lo que diremos que esos dos son aproximadamente los mismos. Por otro lado, el grupo carbonilo adicional aceptor de electrones en el anhídrido de ácido probablemente tenga un efecto profundo, por lo que esperaríamos que ese compuesto atraiga más fuertemente a los nucleófilos.
Por supuesto, la serie que hemos producido anteriormente no es la “respuesta correcta”. No coincide con la serie experimentalmente observada de reactividades carboxiloides. Sin embargo, es muy útil en términos de construir una comprensión de los carboxiloides. Nos dice que la electronegatividad puede jugar un papel aquí, pero que no puede ser el único factor.
Algún otro factor es poner fuera de orden algunos de los derivados. En particular, el cloruro de ácido (C=OCl) y el tioéster (C=OSR) no encajan.
Ejercicio\(\PageIndex{2}\)
La donación de pares solitarios del átomo unido al carbono carbonilo también podría influir en la reactividad de los carboxiloides. Explicar cómo este factor afectaría la electrofilicidad en el carbono carbonilo y predecir la tendencia correspondiente en la reactividad. Compara esta tendencia con la información de la Figura\(\PageIndex{1}\).
- Responder
-
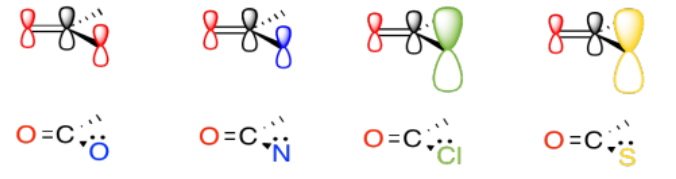
La electronegatividad es un factor abvious que podría influir en la capacidad de un átomo para donar π, pero acabamos de ver ese factor en la sección anterior, así que veamos otra propiedad atómica en su lugar. Por supuesto, diferentes átomos tienen diferentes tamaños. En particular, si observamos los átomos involucrados en los sustituyentes carboxiloides, podemos dividirlos en átomos de segunda fila y átomos de tercera fila.
De hecho, está bien documentado que el grado de superposición entre dos orbitales influye en qué tan bien se unen entre sí. Dado que el carbono está en la segunda fila, tiene aproximadamente el mismo tamaño que, y se superpone bastante bien con, otros átomos de la segunda fila. Los átomos de la tercera fila son un poco demasiado grandes, por otro lado.

Ese factor rompe los carboxiloides en dos grupos diferentes. Suponiendo que la donación de π-es un factor importante, el azufre y el cloro pueden colocarse por encima de los demás en temas de reactividad. No pueden donar tan bien como la lata de oxígeno o nitrógeno.
A partir de ahí, las diferencias entre los átomos de una misma fila pueden resolverse en función de las diferencias de electronegatividad.
Ejercicio\(\PageIndex{3}\)
Usando la información de la Figura\(\PageIndex{1}\), explique por qué los péptidos (que contienen varios enlaces amida, R (C=O) N) son una característica estructural tan común en biología.
- Responder
-
Los enlaces amida se encuentran entre los carboxiloides más estables posibles. Esa estabilidad los hace adecuados para formar estructuras útiles que no se descompondrán fácilmente. Recuerde, cualquier cambio que ocurra en la materia ocurre a través de reacciones químicas, incluyendo la formación y descomposición de biomateriales. El cierre de una posible reacción química significa que un material será más duradero.
La curva de energía potencial en la Figura\(\PageIndex{1}\) (CX3.1) es un índice útil para la interconversión de carboxiloides. En general, es fácil ir cuesta abajo en la curva, pero más difícil ir cuesta arriba. Eso significa que los compuestos más abajo en la colina de esquí se pueden hacer fácilmente a partir de compuestos más arriba de la colina de esquí.
En general, la donación de pi del heteroátomo unido al carbonilo es un factor primario que determina la reactividad carboxiloide. Cuanto más capaz es el heteroátomo de donar sus electrones pi, menos electrófilo es el carbonilo. El nitrógeno es muy bueno para donar su par solitario. Tiene aproximadamente el mismo tamaño que el átomo de carbono al que necesita donar, y solo es un poco más electronegativo que el carbono.
El oxígeno (en ésteres y ácidos carboxílicos) es el siguiente en la línea, ya que el oxígeno es más electronegativo que el nitrógeno.
El cloro y el azufre son un poco demasiado grandes para donar muy bien a un átomo de carbono. El desajuste de tamaño y energía entre estos átomos conduce a una mala unión pi y una mala donación de pi.
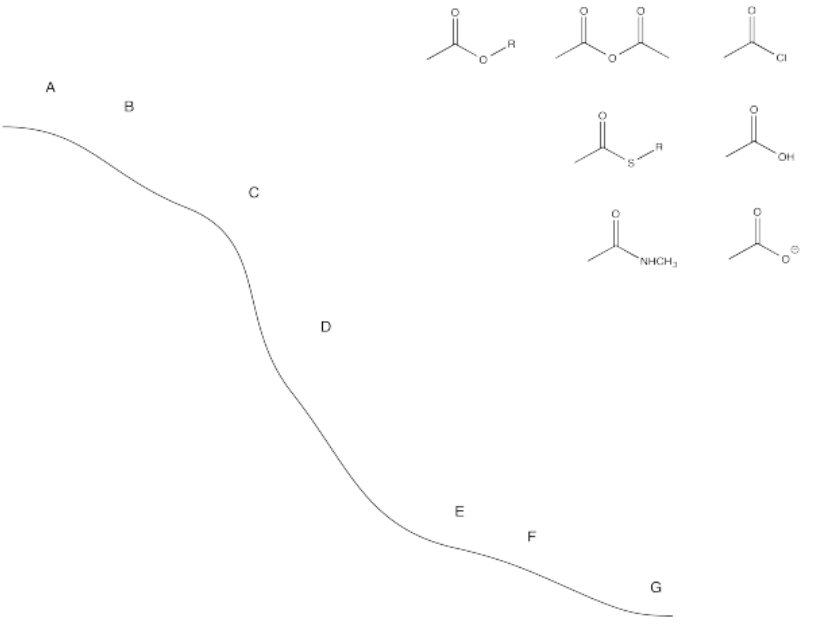
Ejercicio\(\PageIndex{4}\)
Colocar los siguientes compuestos en sus posiciones relativas en el cerro de esquí.
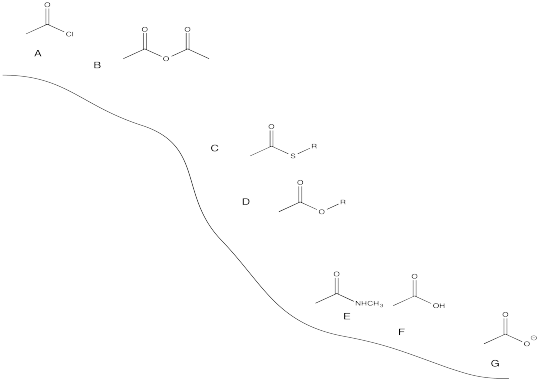
- Responder
-
Ejercicio\(\PageIndex{5}\)
El cloruro de oxalil (izquierda) y el cloruro de tionilo (derecha) son aún más altos en la colina de esquí que los cloruros de ácido regulares. Proponer una razón que explique esta relativa inestabilidad como electrófilos.

- Responder
-
Una posibilidad es la presencia de un sustituyente electronegativo adicional. En el cloruro de oxalil, la presencia de un carbonilo adicional junto al grupo cloruro de ácido electrófilo haría que cada carbonilo fuera aún más electrófilo. En el cloruro de tionilo, la presencia de dos cloros, en lugar de solo uno, podría hacer que este compuesto sea mucho menos estable y más electrófilo.

