6.5: Tipos de Inhibidores Reversibles
- Page ID
- 79436
Los inhibidores reversibles son extremadamente importantes en la regulación de la actividad enzimática. A diferencia de los inhibidores irreversibles, no apagan una enzima completamente al desactivarla permanentemente. Son mucho más sutiles, solo lo ralentizan temporalmente. Sin embargo, hay varias formas diferentes en que el inhibidor podría hacer eso, y así vamos a echar un vistazo a esas posibilidades aquí.
La idea más simple es que un inhibidor puede unirse en el sitio activo de la enzima. Si el inhibidor ya está unido ahí, el sustrato no puede. El inhibidor está en el camino. A esto se le llama inhibición competitiva.
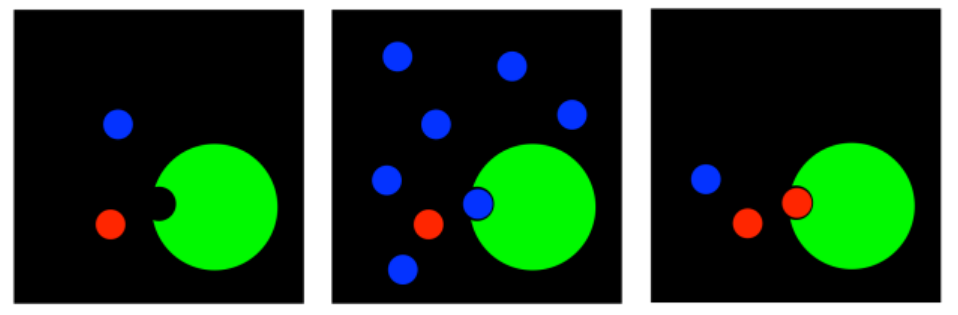
Este caso es una verdadera competencia. Si hay más moléculas inhibidoras que moléculas de sustrato, los inhibidores probablemente ganarán, bloqueando que el sustrato ingrese al sitio activo. Pero si hay más moléculas de sustrato que moléculas inhibidoras, entonces lo más probable es que el sustrato pueda unirse, y la reacción posterior procederá.
Sin embargo, hay una serie de casos en los que el inhibidor no se une en absoluto al sitio activo. Se une en algún otro lugar de la enzima, en un lugar llamado sitio alostérico. Cuando el inhibidor se une al sitio alostérico, de alguna manera interfiere con la función de la enzima. Un inhibidor que se une a un sitio distinto del sitio activo generalmente se denomina inhibidor alostérico.
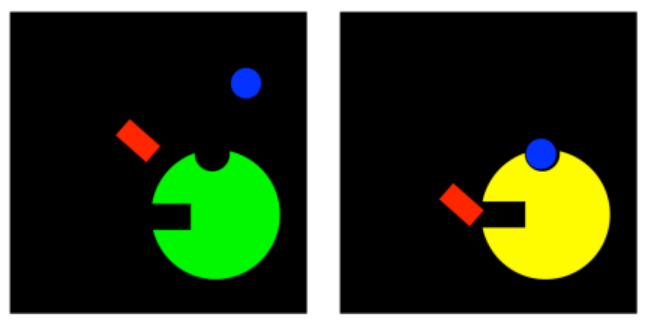
Los inhibidores alostéricos pueden funcionar de varias maneras diferentes. Quizás en el caso más simple, cuando el inhibidor alostérico se une a la enzima, provoca algún tipo de cambio conformacional que impide que la enzima lleve a cabo reacciones. No interfiere con la unión al sustrato, por lo que el sustrato aún puede complejarse con la enzima, pero no pasará nada después de eso. Este tipo de inhibición se llama inhibición no competitiva, o a veces pura inhibición no competitiva, por la sencilla razón de que el inhibidor no está interfiriendo directamente con el sustrato; está inhabilitando temporalmente la enzima de alguna otra manera.
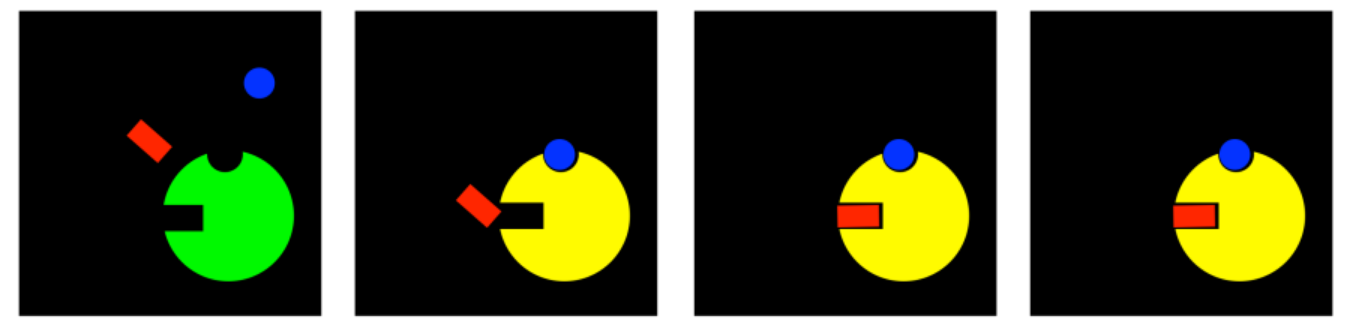
La inhibición no competitiva interfiere con la maquinaria de la reacción enzimática, pero deja solo la unión al sustrato. Pero si los inhibidores alostéricos causan algún tipo de cambio conformacional en la enzima, entonces es fácil imaginar que de alguna manera podrían estropear el sitio de unión. Como resultado, podrían interferir con la unión del sustrato, incluso sin estar en competencia directa con el sustrato. A este modo se le llama inhibición mixta no competitiva. Aunque el inhibidor no está compitiendo directamente por el mismo sitio de unión que el sustrato, termina impidiendo que el sustrato se una de todas formas.
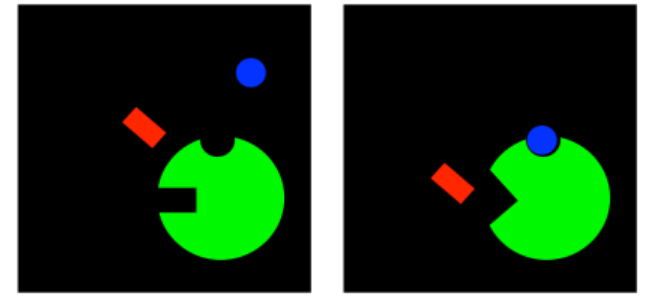
Bueno, ese juego puede ir en ambos sentidos. Si un inhibidor puede cambiar el sitio de unión del sustrato, tal vez el sustrato pueda cambiar el sitio de unión del inhibidor. En la inhibición no competitiva, el inhibidor no es capaz de unirse a la enzima libre. Sin embargo, cuando el sustrato se une, induce un cambio conformacional en el sitio alostérico, permitiendo que el inhibidor se una. Si el inhibidor se une, interfiere con la maquinaria de la enzima, por lo que la enzima no puede hacer su trabajo, aunque el sustrato esté unido.
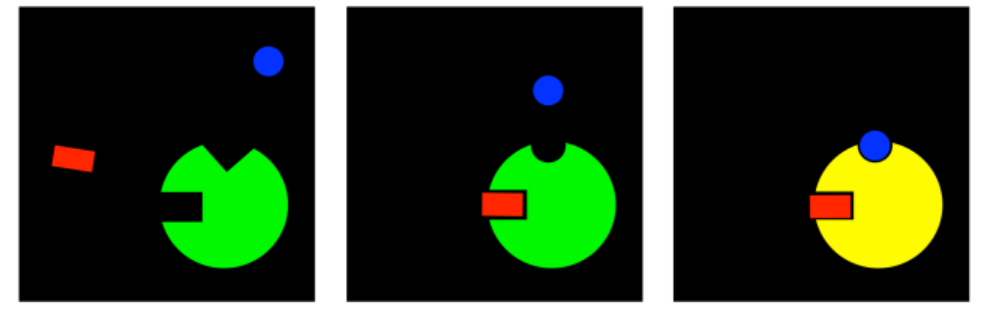
Hay un caso más que es una idea complemetaria; no se trata en absoluto de inhibición. Si un compuesto puede unirse en un sitio alostérico, cambiando la conformación del sitio activo para que un sustrato ya no pueda unirse, entonces tal vez lo contrario sea cierto. Tal vez un compuesto puede unirse en un sitio alostérico, permitiendo que un sustrato se una que anteriormente no podía.
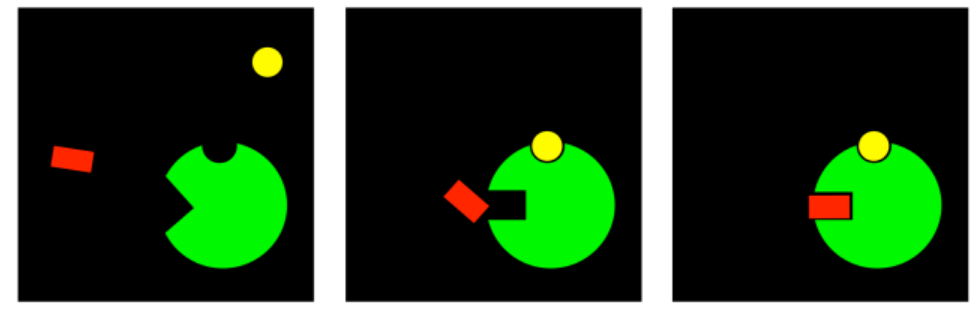
En lugar de inhibir la enzima, este compuesto la estaría activando. Haría posible la unión, y de pronto la enzima podría hacer ts trabajo. Este compuesto es un activador alostérico. Al igual que en la inhibición, puede haber diferentes modos a través de los cuales el activador alostérico podría activar la enzima. Lo importante es saber que para regular una enzima completamente, hay nood que haya tanto interruptores de encendido como de apagado. Los activadores encienden las enzimas que están a la espera de ser utilizadas. Los inhibidores apagan las enzimas que no necesitamos en estos momentos.

